PT109改善链脲佐菌素诱导的散发性阿尔茨海默病小鼠认知功能障碍的作用及机制
2021-10-12陈秋荷涂亚林侯加卫鲁俊锋皮荣标
陈秋荷,涂亚林,侯加卫,陈 晨,鲁俊锋,皮荣标
(1.中山大学药学院药理与毒理教研室,广东广州510006;2.广州中医药大学中药学院,广东广州510006;3.中山大学医学院药理教研室,广东深圳518107)
阿尔茨海默病(Alzheimer’s disease,AD)是最常见的痴呆症类型,预计2050年,AD患者人数将达到1.35亿人,将会给患者家庭和社会带来沉重负担[1]。AD病因复杂,但常见治疗药物靶点单一、疗效有限,不能从源头缓解疾病发生发展;因此,开发新型AD药物意义重大。以往基于单靶点策略的AD药物研发屡屡失败,部分研究人员认为将两个或多个药效团结合到单一分子中,针对AD多个病理过程,获得协同治疗AD作用的单分子多靶点策略有望成功治疗AD的新途径[2]。AD从发病特点上可分为家族性AD(familial Alzheimer’s disease,fAD)和散发性AD(sporadic Alzheimer’s disease,sAD),其中sAD占绝大多数(>95%)[3]。大鼠/小鼠侧脑室注射链脲佐菌素(intracerebroventricular streptozotocin,icv-STZ)会诱导意识障碍[4],引起胰岛素受体的自身磷酸化和增加内在酪氨酸激酶、磷酸化酪氨酸磷酸酶的活性,进而会导致胰岛素信号转导被抑制,破坏脑中的葡萄糖和能量代谢[5]。并且侧脑室注射STZ除了会影响海马和皮层的葡萄糖代谢外,还能导致小胶质细胞的激活所引起炎症反应、氧化应激、突触功能障碍、Tau蛋白过度磷酸化等AD样病理特征[4,6-7],因此被认为是研究AD(尤其是sAD)发病机制及相关药物研发的重要动物模型之一[8]。PT109[5-(1、2-二硫戊环-3-yl)-n-(4-(异喹啉-5-基氨基)环己基)戊酰胺]是基于单分子多靶点策略设计的多激酶抑制剂,可抑制GSK3β等蛋白激酶的活性;前期实验已表明PT109能改善APP/PS1小鼠的学习记忆障碍,缓解神经炎症,降低Tau蛋白的磷酸化水平并且具有良好的药物代谢特性及血脑屏障透过性[9]。本研究拟进一步在icv-STZ小鼠模型中探讨PT109对sAD的作用,希望能进一步阐明PT109的作用机制,为其深入研究提供研究基础。
1 材料与方法
1.1 主要试剂
本实验用到的试剂如下:链脲佐菌素(sigma,美国);PT109[5-(1、2-二硫戊环-3-yl)-n-(4-(异喹啉-5-基氨基)环己基)戊酰胺]由实验室制备(图1,纯度99%);免疫组化试剂盒(KIT-9710,迈新);DAB(博奥森,C02-04001);BCA试剂盒(Thermo,#23225);一抗:anti-Iba1(wako,#019-19741);anti-MAP2(CST,#4542S);anti-Tuj1(Bio⁃Legend,#801201);anti-NLRP3(CST,#15101);an⁃ti-PSD95(CST,#3450S);anti-p-Tau(abcam,#ab109390);anti-p-GSK3β(Bioword,#BS4084);an⁃ti-β-actin(Thermo,#MA5-15739);免疫荧光二抗:Rhodamine red-X goat anti-rabbit IgG(life technolo⁃gies,#R-6394);免疫印迹二抗:Goat anti-Rabbit IgG H&L(HRP)(碧云 天,A0208);Goat anti-Mouse IgGH&L(HRP)(碧云天,A0216);DAPI(碧云天,C1002);ECL显影液(Millipore,美国);高尔基染色试剂盒(FDNeuro Technologies,美国)。

图1 PT109结构Fig.1 The structure of PT109
1.2 实验动物
7周龄雄性健康的SPF级C57BL/6小鼠购于南京大学南京生物医药研究院,生产许可证号:SCXK(苏)2015-0001,实验动物质量合格证号:No.32002100003485;饲养于中山大学实验动物中心,使用许可证:SYXK(粤)2016-0112。动物饲养于屏障环境,温度为(20~26)℃,湿度为40%~70%,昼夜明暗交替时间为12/12 h。小鼠分笼饲养,自由饮水进食。小鼠适应性喂养一周后开展实验,相关实验伦理申请获得中山大学实验动物管理与使用委员会批准(No.2017-417XS)。
1.3 动物模型建立与分组给药
腹腔注射戊巴比妥钠溶液(50 mg/kg)麻醉小鼠,固定于脑立体定位仪(NeuroStar),打开头皮,确定注射位置后,使用微量注射器将STZ(每天3 mg/kg,第1、3天)注射入小鼠的左右侧脑室,每个注射位点5µL;正常组与模型组前期操作一致,但注射等量生理盐水。术后缝合,涂抹红霉素软膏,待苏醒后将模型小鼠随机分组。实验过程中将小鼠共分为正常组、模型组、低剂量组(30 mg/kg)、高剂量组(100 mg/kg)。PT109使用含等摩尔量柠檬酸钠的20%羟丙基-β-环糊精溶液溶解,腹腔注射给药2周后,通过Morris水迷宫、避暗实验评价小鼠学习记忆能力,行为学实验期间,小鼠仍每日给药,整个实验周期为4周。
1.4 Morris水迷宫实验
给药2周后,开展Morris水迷宫实验评价小鼠学习记忆能力[9]。实验分为适应性实验、训练实验、探索实验3部分。适应性实验期间,平台露出水面,记录小鼠60 s内的游泳速度及找到平台的潜伏期。第2~6天开展训练实验,训练实验期间,隐藏平台(第三象限)。小鼠从第一象限放入池中,如在60 s内找不到平台,将引导小鼠找到平台并在平台上保持15 s;每天每只小鼠分别以四个象限为入水点,进行4轮学习。第7天开展探索实验,将平台撤去,小鼠从第一象限放入池中,记录小鼠60 s内穿越平台次数和在目标象限(原平台所在象限)的游泳时间和游泳路径比。
1.5 避暗实验
水迷宫实验结束后次日开展避暗实验[9]。该实验分为3个阶段:适应性实验、训练实验和测试实验。第1天,将小鼠从亮室中放入装置中,另其自由探索,对装置进行适应180 s。第2天,将装置暗室电击装置打开,小鼠从亮室放入装置中,记录300 s内小鼠活动情况。24 h后,对小鼠进行无电击记忆保留实验。将小鼠从亮室放入装置内,记录小鼠在300 s内进入暗室的次数和进入暗室的时间。
1.6 免疫荧光实验
将各组小鼠脑片用PBS润洗3次,在室温下使用含有Triton X-100的免疫荧光封闭液孵育1 h。随后孵育一抗,4℃过夜。次日用PBS润洗3次,每次5 min。使用荧光标记的二抗对避光孵育1 h,随后用PBS润洗3次,每次5 min。使用DAPI进行染核7 min,随后使用PBS润洗3次,每次5 min。将脑片捞出置于玻片,暗处阴干后滴加荧光淬灭剂进行封片,拍摄。
1.7 免疫组化实验
根据免疫组化试剂盒说明书对脑片进行免疫组化染色[9]。使用PBS润洗脑片3次后,加入A液孵育30 min,PBS润洗3次,每次5 min,然后使用B液进行封闭1 h,随后在4℃孵育一抗过夜。次日用PBS对润洗3次,每次5 min。室温孵育C液1 h,随后用PBS润洗3次,每次5 min。使用D液室温下孵育1 h。用PBS润洗后,使用DAB进行染色,自来水终止染色,80%-100%乙醇梯度脱水,含二甲苯中性树脂封片,拍摄。
1.8 免疫印迹法
将提取的蛋白样品定量后加上样缓冲液沸水煮5 min,进行SDS-PAGE凝胶电泳,然后转到PVDF膜,5%BSA溶液室温封闭2 h,分别加NL⁃RP3、p-Tau、p-GSK3β一抗(1:1 000)4℃孵育过夜,二抗(1:5 000)室温孵育1.5 h,用化学发光液显影,曝光成像。
1.9 高尔基染色
采用高尔基染色试剂盒进行染色。每组处死3只小鼠,用ddH2O润洗脑组织。然后在室温下用A+B混合液暗处浸泡14 d,再用C液浸泡5 d。使用冷冻切片机切片,厚度为180µm。切片按说明书所述用D溶液染色,封片拍摄。
1.1 0 统计学方法
实验数据以均数±标准误差表示。数据进行单因素方差分析或双因素方差分析,多重比较采用Tukey法。Iba1阳性细胞数、树突棘密度以及免疫印迹蛋白灰度值采用Image J软件进行分析。所有数值均通过GraphPad Prism 5软件进行分析,P<0.05表示差异有统计学意义。
2 结果
2.1 PT109改善icv-STZ小鼠学习记忆障碍
给药2周后,开展Morris水迷宫实验、避暗实验对小鼠学习记忆能力进行评价。在水迷宫实验中,如图2A、B、D所示,经单因素方差分析,结果发现各组小鼠游泳速度未存在统计学差异(适应实验:F=2.733,P=0.062 5;训练实验:F=1.621,P=0.187 2;探索实验:F=0.081 12,P=0.969 7)。如图2 C所示,经双因素方差分析,结果发现第2~6天的训练实验结果表明,各组小鼠的潜伏期会随着训练时间增加而逐渐缩短,且各组小鼠潜伏期存在统计学差异[训练时间:[F(3,174)=10.67,P<0.001;组间:F(3,174)=12.36,P<0.001]。如图2(E-G)所示,经单因素方差分析,结果发现在探索实验中,各组小鼠在平台穿越次数(F=4.493,P=0.009 5)、目标象限的时间比例(F=4.517,P=0.010 5)、路径比例(F=5.122,P=0.006)存在统计学差异;采用Tukey法进一步做两两比较,结果发现与模型组相比,低剂量和高剂量PT109均能显著增加小鼠穿越平台次数(P<0.05,P<0.05),提高小鼠在目标象限的时间比例(P<0.01,P<0.05);低剂量PT109能显著增加小鼠在目标象限路程比例(P<0.01),高剂量组与模型组间差异无统计学意义(P>0.05)。如图2H、I所示,经单因素方差分析,结果发现避暗实验中,各组间潜伏期(F=5.695,P=0.003 3)和错误次数(F=10.03,P<0.000 1)存在统计学差异;采用Tukey法进一步做两两比较,结果发现与模型组相比,高剂量PT109能显著增加小鼠进入暗室的潜伏期(P<0.05),而低剂量组数据与模型组差异无统计学意义(P>0.05);但PT109在低剂量和高剂量条件下均能减少小鼠进入暗室的错误次数(P<0.05,P<0.01)。

图2 PT109改善icv-STZ小鼠的学习记忆能力Fig.2 PT109 improved spatial learning ability of icv-STZ mice
2.2 PT109减少icv-STZ小鼠的小胶质细胞数量
通过免疫荧光及免疫组化法检测小鼠海马及皮层Iba1阳性细胞数量。如图3 A-D所示,经单因素方差分析,结果发现各组小鼠Iba1阳性细胞数量在海马区域存在统计学差异(F=17.15,P=0.001),而在皮层区域不存在统计学差异(F=2.958,P=0.063 9);采用Tukey法进一步做两两比较,结果发现模型组小鼠海马区小胶质细胞数量明显增加(P<0.001),与正常组数据存在统计学差异。PT109干预后海马区域小胶质细胞的数量减少(P<0.001),与模型组数据存在统计学差异。但在皮层区域与模型组却差异无统计学意义(P>0.05)。同时我们检测了小鼠海马内NLRP3炎症小体的蛋白表达水平,各组间数据存在统计学差异(F=6.326,P=0.016 6)。结果发现高剂量的PT109能显著下调icv-STZ小鼠海马NLRP3蛋白水平(P<0.05,图3E、F)。

图3 PT109减少icv-STZ小鼠小胶质细胞数量并降低NLRP3蛋白表达水平Fig.3 PT109 reduced the number of microglia and decreased NLRP3 levelsin icv-STZ mice
2.3 PT109减少icv-STZ小鼠的神经元丢失
我们通过免疫荧光法检测神经细胞标记蛋白Tuj1和MAP2的表达情况,如图4所示,经单因素方差分析,结果发现各组小鼠海马(F=6.882,P=0.002 3)和皮层区域(F=20.33,P<0.000 1)相关数据存在统计学差异;采用Tukey法进一步做两两比较,结果与正常组相比,模型组小鼠海马和皮层中Tuj1和MAP2阳性细胞数量均大幅减少,结果具有统计学差异(P<0.01,P<0.001)。与模型组相比,高剂量PT109干预后可增加icv-STZ小鼠海马和皮层Tuj1和MAP2阳性细胞数量(P<0.05,P<0.01),但低剂量组与模型组差异无统计学意义(P>0.05)。

图4 PT109增加icv-STZ小鼠Tuj1和MAP2表达水平Fig.4 PT109 increased the Tuj1 and MAP2 expression of icv-STZ mice
2.4 PT109增加icv-STZ小鼠树突棘密度
我们用高尔基染色法对小鼠脑组织进行染色。如图5A所示,经单因素方差分析,各组小鼠树突棘密度存在统计学差异(F=33.07,P<0.000 1);采用Tukey法进一步做两两比较,结果发现与正常组相比,模型组小鼠额叶皮质树突棘密度下降(P<0.001),具有统计学差异。而低剂量和高剂量PT109能增加icv-STZ小鼠树突棘密度(P<0.001,P<0.001),相关数据与模型组具有统计学差异。另外,我们检测海马PSD95蛋白水平,发现各组PSD95蛋白表达存在统计学差异(F=6.32,P=0.016 7);高剂量PT109可增加icv-STZ小鼠PSD95的表达水平(P<0.05)。
2.5 PT109对icv-STZ小鼠Tau蛋白、GSK3β磷酸化水平的影响
我们检测了各组小鼠海马中Tau蛋白磷酸化水平,经单因素方差分析,发现各组数据存在统计学差异(F=12.95,P=0.001 9);采用Tukey法进一步做两两比较,结果发现与正常组相比,模型组小鼠Tau蛋白磷酸化水平具有统计学差异(P<0.01),低剂量和高剂量的PT109能降低icv-STZ小鼠Tau蛋白磷酸化水平,结果具有统计学差异(P<0.05,P<0.01)。同时,我们检测了GSK3β的磷酸化水平,经单因素方差分析,结果显示各组数据存在统计学差异(F=7.006,P=0.012 5);采用Tukey法进一步做两两比较,结果发现模型组S9位点的GSK3β磷酸化水平明显降低(P<0.05),高剂量的PT109能逆转下调趋势(P<0.05;图6)。
3 讨论
本研究发现,PT109能改善icv-STZ小鼠学习记忆障碍。进一步研究结果显示,PT109减少icv-STZ小鼠中小胶质细胞数量,降低NLRP3炎症小体的蛋白表达水平,表明PT109可改善icv-STZ小鼠的神经炎症;PT109提高icv-STZ小鼠Tuj1和MAP2阳性细胞数量,增加树突棘密度,上调海马区PSD95蛋白表达,表明PT109可一定程度要减少STZ引起的神经元损伤,具有神经保护及突触保护作用;此外,PT109可降低icv-STZ小鼠Tau蛋白磷酸化水平,并且能够提高GSK3β的磷酸化水平。
sAD在AD患者中占比居多,开发针对性药物意义重大。icv-STZ小鼠因具有神经炎症、氧化应激、神经退行性变等AD样病理性指标,常被用作为研究sAD动物模型[6,10]。因此本研究采用icv-STZ小鼠作为sAD模型动物进行研究,给予PT109治疗后,采用Morris水迷宫实验、避暗实验评价了PT109对icv-STZ小鼠学习记忆能力的影响。研究结果表明icv-STZ小鼠出现了学习记忆缺陷,这与已有研究一致[7];而给予PT109治疗后,icv-STZ小鼠学习记忆障碍得到改善(图2)。水迷宫实验过程中,各组小鼠游泳速度没有存在统计学差异,说明药物不影响小鼠的运动能力。本课题组前期以APP/PS1小鼠作为fAD模型,同样发现了PT109对fAD模型小鼠学习记忆的改善作用[9],这些结果进一步说明了PT109具有抗AD的潜力。
小胶质细胞是中枢神经系统中的主要吞噬细胞,是神经炎症的主要参与者。小胶质细胞的过度激活会释放大量的炎症介质,进而加剧炎症反应[11]。而NLRP3炎症小体是神经系统中研究最广泛的炎症小体,主要集中在星形胶质细胞和小胶质细胞中,活化后可诱导炎症及免疫应答,在神经炎症中扮演者重要角色[12]。本研究发现PT109能够显著减少icv-STZ小鼠脑内激活的小胶质细胞,同时能显著降低NLRP3的蛋白表达水平(图3)。这些研究结果表明PT109改善了icv-STZ小鼠的神经炎症。
AD发病过程中会出现神经元损伤以及丢失等情况[13]。前期研究表明,STZ具有神经毒性,可导致小鼠脑内神经元减少、顶叶皮层变薄[6]。为了评价PT109对icv-STZ小鼠脑内神经元的作用,我们用免疫荧光方法检测了icv-STZ小鼠脑中神经元标记蛋白Tuj1和MAP2的表达,在我们的研究中同样发现icv-STZ小鼠脑中Tuj1和MAP2阳性细胞明显减少。给药治疗后,阳性细胞明显增加(图4)。这提示我们PT109可减轻STZ诱导的神经元损伤。
突触是神经元间信息传递的重要结构,突触功能异常会导致学习记忆功能障碍,在AD发病过程中至关重要[14]。研究表明icv-STZ小鼠出现突触可塑性损伤[15]。在本研究中发现类似现象,icv-STZ小鼠脑组织中树突棘大量减少,突触相关蛋白PSD95显著减少,表明STZ诱导了脑组织中突触结构的损伤;而给予PT109治疗后,树突棘的密度显著增加,PSD95显著增加(图5)。这些结果提示我们PT109可以改善STZ诱导的突触损伤。
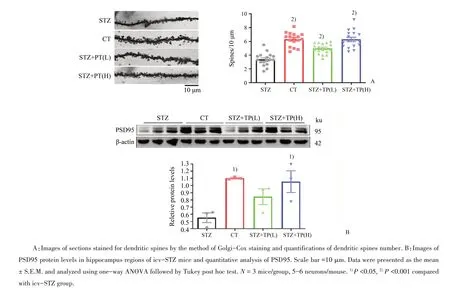
图5 PT109增加icv-STZ小鼠树突棘密度和PSD95蛋白表达水平Fig.5 PT109 increased the number of dendritic spines and PSD95 protein levels of icv-STZ mice
Tau蛋白异常磷酸化形成的神经纤维缠结是AD的一个重要病理表现[16]。在AD患者脑内,Tau蛋白处于高度磷酸化水平,最终会导致微管的解体。同时游离的磷酸化Tau蛋白会随着轴索传送到其他神经元内,并形成小颗粒和神经纤维缠结,最终造成神经元死亡和突触功能障碍[17]。而GSK3β是调控Tau蛋白磷酸化的重要激酶。在AD中,活化的GSK3β表达增加,并能促使Tau蛋白磷酸化位点的形成[18]。另有研究表明,GSK3β还可通过调控Aβ异常聚集、神经细胞凋亡和炎症反应等参与AD的发病过程[19]。已有实验表明PT109能减少APP/PS1转基因小鼠Tau蛋白的磷酸化水平,且在10µmol/L的浓度下具有较好的GSK3β活性抑制作用(61%)[9]。因此,本研究进一步评价了PT109对icv-STZ小鼠脑组织中Tau蛋白磷酸化和GSK3β的影响。研究发现,PT109可提高icv-STZ小鼠脑组织中GSK3β的水平并减少Tau蛋白磷酸化(图6)。这提示GSK3β可能参与介导PT109对Tau蛋白磷酸化的调节。

图6 PT109对icv-STZ小鼠Tau蛋白、GSK3β磷酸化水平影响Fig.6 The effects of PT109 on phosphorylation of Tau proteins and GSK 3βin icv-STZ mice
综上所述,PT109可通过减少小胶质细胞数量、神经元丢失,增加树突棘密度,减少Tau蛋白磷酸化等多途径改善icv-STZ小鼠学习记忆障碍,相关作用可能与调节GSK3β信号通路有关。这与PT109在APP/PS1转基因小鼠中获得的结果基本一致[9],表明PT109有可能是一种潜在的预防或治疗AD的多靶点先导化合物,但尚需进一步验证。
