Hhip和Lpar2基因表达与胃癌相关性的研究进展
2021-10-12李国熊方家恒孙倚天
董 赛,李国熊,方家恒,陈 鑫,孙倚天
董赛,李国熊,方家恒,陈鑫,孙倚天,杭州师范大学附属医院消化内科 浙江省杭州市 310015
0 引言
胃癌(Gastric cancer,GC)是严重危害人类健康的最常见的恶性肿瘤之一.根据国际癌症研究机构的统计数据,2012年全球GC发病率位于恶性肿瘤发病率第5位、死亡率位于第3位[1].GC的发生经过一系列胃粘膜病理变化,胃上皮内瘤变(gastric intraepithelial neoplasia,GIN)是指基底膜以上上皮的一种非浸润性肿瘤学改变,包括低级别胃上皮内瘤变(low-grade gastric intraepithelial neoplasia,LGIN)和高级别上皮内瘤变(high-grade gastric intraepithelial neoplasia,HGIN).根据专家共识意见,推荐在早期胃癌和HGIN状态下及时通过ESD或EMR进行干预,能显著减少GC的发生率以及改善GC预后.已知与GC相关的基因数目众多,随着研究深入,越来越多的基因被发现,针对基因或基因表达产物的靶向治疗药物也逐渐产生,如人表皮生长因子受体2 (HER-2)拮抗剂曲妥珠单抗、酪氨酸激酶抑制剂阿帕替尼.未来GC基因研究前景可观,不仅可以发掘与GC相关的新基因,也可以研究基因与GC及GIN预后之间的相关性,预测GC及GIN的发生发展并且作为潜在靶点为GC的治疗提供更多选择.
1 Hhip基因与胃癌
人刺猬相互作用蛋白(human hedgehog-interacting protein,Hhip)基因位于染色体3q31.21-31.3,与人类多种肿瘤的发生相关.Hhip基因的过表达抑制非小细胞肺癌与肝癌细胞的增殖、迁移与侵袭,Hhip基因的表达水平或可作为确定非小细胞肺癌分型及TNM分期的参考标准[2,3];早有研究[4]表明Hhip基因沉默与结直肠癌淋巴结转移、弥漫型胃癌TNM分期有关,体外实验中,下调Hhip基因的表达水平可显著增强结肠癌细胞的生长和侵袭能力.近年来,越来越多的研究发现Hhip作为Hh信号通路的负性调控基因,通过抑制Hh信号通路的激活,保持通路的稳定,从而抑制GC的发生发展.
1.1 Hhip基因与Hh信号通路的相关性及其分子机制 多项研究显示,Hh信号通路的激活与人类多种肿瘤的形成有关,如胃癌、非小细胞肺癌、结肠癌等[5-7].Hh信号通路涉及的成分包括三种Hh配体:SHH (Sonic hedgehog)、IHH (Indian hedgehog)、DHH (Desert hedgehog)及跨膜受体PTCH1 (Patched1)、G-蛋白偶联受体SMO(Smoothed)、负性调节分子SUFU (Suppressor-of-fused)和转录因子GLI (Glioblastoma-associated-protein)家族等.在非配体状态下,PTCH1受体被主动抑制,阻止激活剂SMO进入初级纤毛,GLI蛋白被磷酸化后部分降解,产生GLI阻遏物形式(GLIR),关闭Hh靶基因的表达.当配体存在时,PTCH1的抑制作用被解除,使Hh信号通路激活,激活过程如图1所示[8].三种Hh配体通过结合跨膜受体PTCH1激活相同的信号级联,但这些配体的分布呈现组织特异性,SHH和IHH主要在胃肠道内表达,而DHH的表达仅限于睾丸和神经系统[8].SHH在人类多种消化系统肿瘤中表达上调,如胃癌、结直肠癌,导致Hh信号通路异常激活[9,10].SHH与跨膜受体PTCH1结合后通过七次跨膜蛋白SMO传导信号至细胞内,使转录因子GLI从KIF7和SUFU中解离,转录激活因子(GLIs)进入细胞核,诱导多种靶基因的表达.靶基因包括Ptch1、Ptch2及Gli1,其表达增加是激活信号通路的一个高度可靠的指标,Ptch1和Gli1表达产物分别通过负反馈和正反馈回路机制调控Hh信号通路;其他靶基因包括Hhip、Ccnd2、Bcl2、Mycn等以及Wnt信号通路成员,这些靶基因的激活和失活可能参与了正常组织和器官的发育以及肿瘤的发生[8,11].HHIP是一种Ⅰ型膜糖蛋白,由4个主要结构域组成,被认为是三种Hh配体SHH、IHH、DHH的潜在拮抗剂,可以与PTCH1受体竞争性结合三种Hh配体,通过负反馈机制抑制Hh信号通路的激活[12].
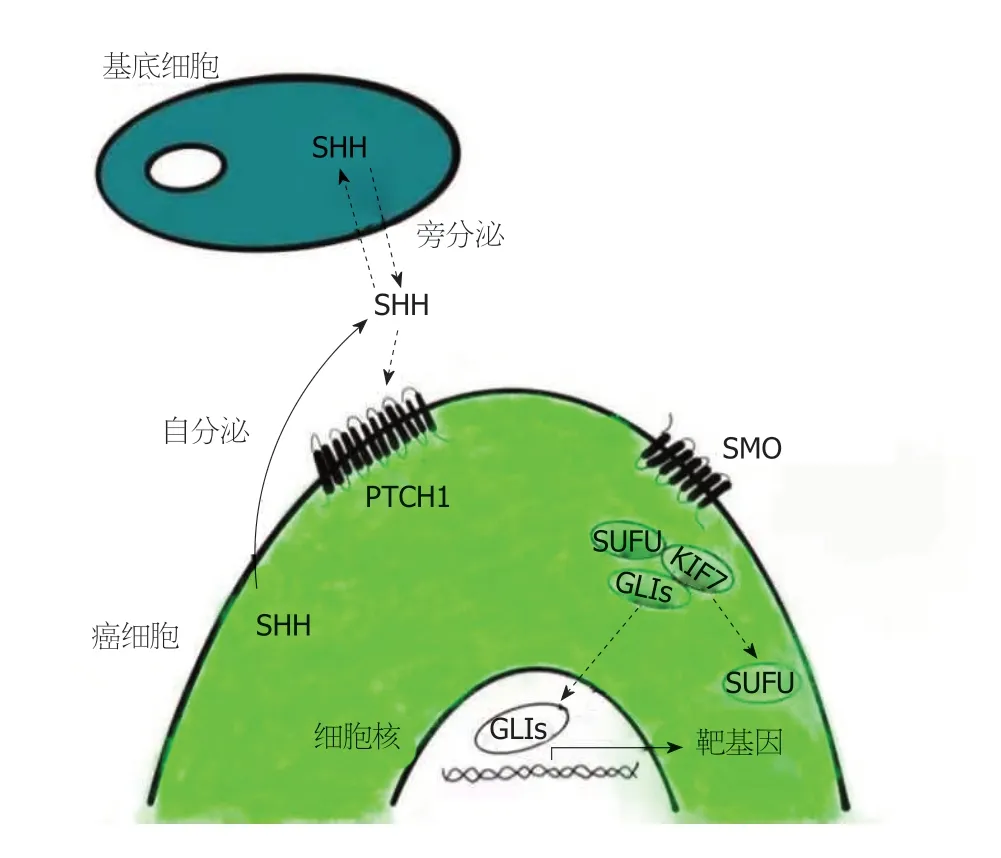
图1 Hh信号通路激活过程.
Hh信号通路涉及多种发育和生理过程,在胚胎发育和组织稳态中起着至关重要的作用.在成人胃中,Hh信号通路不仅调节胃上皮细胞的分化和成熟,而且在胃的生理活动中也是必不可少的.正常胃粘膜上皮细胞分泌SHH,被基质细胞上的受体识别,从而启动Hh信号级联,增加下游靶基因的转录,这就是所谓的“旁分泌”调控.在GIN中,这种“旁分泌”调节的平衡被打破,SHH表达增加,刺激Hh信号通路过度激活,从而导致化生转化和纤维组织的生长,进而发生癌变.在GC胃粘膜组织中,除了“旁分泌”调节外,“自分泌”调节也有助于癌症的进展,GC细胞SHH的表达上调进一步激活Hh信号通路,促进GC的发生发展[8].幽门螺杆菌感染正常胃粘膜后,可直接控制SHH的分泌,间充质干细胞(MSCS)被招募到慢性炎症部位,重新填充胃上皮细胞,促进胃粘膜正常细胞向异型增生转变[13].
1.2 Hhip基因表达水平与GIN及GC预后的相关性 Sun等[14]对95例GC、癌旁正常胃粘膜组织及29例GIN患者的胃粘膜组织进行免疫组织化学染色,发现Hhip基因在GC组织中的表达水平显著降低,在GIN组织中的表达水平低于相邻正常胃粘膜组织,但高于GC组织样本;Hhip基因表达水平与淋巴结转移(P=0.041)、神经系统浸润(P=0.001)、TNM分期(P=0.007)呈负相关;此外,Hhip基因表达水平较高的GC患者总生存期(overall survival,OS)与无病生存期更长,是GC患者OS的独立预测因子(P<0.01).另有研究[15]通过PT-PCR法检测52对GC组织和相应的癌旁正常组织中的Hhip基因表达水平,也得到了类似结果;随访3年发现,GC患者中Hhip基因表达水平虽与局部复发无相关性(P=0.58),但与GC转移呈负相关(P=0.035).上述研究表明,从正常胃粘膜发展到GIN最后成为GC的过程中,Hhip基因的表达水平逐渐下降,相对低表达的GC患者预后较差,其或许能预测GIN的发生发展及GC预后.
1.3 抑制Hhip基因启动子甲基化是治疗GC的潜在新靶点 Song等[15]通过构建病毒Hhip表达载体并转染AGS细胞株,使GC细胞HHIP蛋白水平升高,对转染后的GC细胞进行细胞增殖和Transwell实验,发现GC细胞的增殖和侵袭能力下降;采用甲基化特异性聚合酶链反应(MSPCR,MSP)法分析GC细胞启动子甲基化水平,结果显示被病毒Hhip表达载体转染后的GC细胞启动子CpG岛甲基化比例为13.85%,显著低于未被转染的GC细胞.在一项研究中[16],对30例GC及癌旁正常组织的手术标本采用MSP法进行Hhip基因启动子甲基化水平检测,结果表明GC组织Hhip基因启动子甲基化水平显著高于癌旁正常组织,启动子甲基化水平与Hhip基因mRNA的表达水平呈负相关性(P=0.000).药物5-氮杂胞苷(5-aza-dc)是DNA甲基转移酶抑制剂,能有效抑制DNA甲基化水平.用不同浓度的5-aza-dc干预GC细胞,均能使GC细胞增殖活力显著降低,凋亡率升高,其最佳剂量为2.0 μm (P=0.000);5-aza-dc干预后GC细胞的Hhip mRNA及HHIP蛋白水平显著高于未干预组.因此,抑制Hhip基因启动子甲基化水平可上调Hhip基因的表达,抑制GC细胞的增殖,诱导GC细胞的凋亡.目前已有研究[8]认为Hh信号通路涉及的某些分子是GC的治疗靶点,如抗SHH单克隆抗体5E1通过结合假活性位点阻断Hh信号通路,环巴胺衍生物IPI-92直接与SMO的蛋白螺旋体结构结合而使其失活,Hhip基因启动子序列或许也可以成为GC治疗的潜在新靶点.
2 溶血磷脂酸受体2基因与GC
溶血磷脂酸受体2 (Lysophosphatidic acid receptor 2,Lpar2)基因位于染色体19p12,其编码的LPA2是一个G蛋白偶联受体,由348个氨基酸组成,分子量约为39 kDa,属于内皮分化基因受体(EDG)家族[17,18].研究表明,LPA2与人类许多肿瘤相关,LPA2与其配体LPA结合可激活LPA信号通路,进而促进细胞增殖和恶性转化,如乳腺癌中LPA2受体表达水平高提示预后不良[19],肝癌中Lpar2 mRNA的高表达与癌细胞低分化有关[20],结肠癌细胞中 LPA2受体的高表达促进了耐药性的获得,促使抗癌药物失效[21].
2.1 Lpar2基因表达产物与ATX-LPA信号轴及其分子机制 近年来的研究表明,LPA2受体与异三聚体G蛋白Gi/o、Gq/11和G12/13家族结合,这些G蛋白通过Ras、Rac、PI3K、MAPK、PLC、二酰基甘油分子等启动下游信号通路,这些信号通路与肿瘤的存活、转移等密切相关[22].Yamashita等[23]通过免疫组织化学方法检测204例GC组织中LPA2受体的表达水平,结果显示LPA2受体在肠型癌中优先表达(67%),明显高于弥漫型癌(32%);此外,弥漫型癌中LPA2受体的表达水平提高了癌细胞的淋巴管浸润率(P=0.0421)、静脉浸润率(P=0.0023)以及淋巴结转移率(P=0.0159),而在肠型癌中未发现两者有显著相关性,表明LPA2的表达水平可能与弥漫型癌的肿瘤分期(T1-4)呈正相关.Zhang等[24]的研究结果表明ATX-LPA信号轴通过PI3K/Akt和MAPK/ ERK介导的机制诱导骨桥蛋白(osteopontin,OPN)的表达,OPN是一种细胞因子,在细胞粘附、趋化、凋亡、侵袭和迁移等过程中发挥着重要作用,OPN在ATX-LPA轴诱导的GC细胞迁移中是不可或缺的,它能保护GC细胞躲避紫杉醇诱导的凋亡.
ATX-LPA信号轴的激活与多种肿瘤相关,如甲状腺癌、乳腺癌[25,26].溶血磷脂酸(Lysophosphatidic acid,LPA)是一种生物活性磷脂,在细胞膜合成过程中产生,是存在于所有真核生物组织和血浆中的强大的细胞外信号分子.细胞外合成LPA有一个主要途径,在该途径中,磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰乙醇胺等前体分子分别通过磷脂酶A1 (PLA1)和磷脂酶A2 (PLA2)作用产生溶血磷脂酰胆碱(LPC)、溶血磷脂酰丝氨酸(LPS)和溶血磷脂酰乙醇胺,然后在自身毒素(ATX)作用下转化为LPA.ATX被认为是ATX-LPA信号轴的守门人,在信号传导中起着至关重要的作用[18],抑制ATX活性可影响ATXLPA信号轴的激活,从而消除LPA对细胞存活和迁移的大部分影响[27].ATX-LPA信号通过至少6个G蛋白偶联受体(LPA1-6)来转导,LPA与受体结合后介导许多生物学活动.在肿瘤细胞中,ATX-LPA信号被放大和控制,以支持自身的生长和转移,这可能是通过增加ATX或LPA受体的表达来实现的.ATX-LPA信号传导可被磷酸脂质磷酸酶(LPPs)终止,所以细胞外LPA的动态平衡主要是由ATX与LPPs来调控.LPA-ATX信号不仅可以刺激肿瘤的进展和转移,还能通过保护癌细胞免受细胞毒性药物和照射所造成的损伤,在形成抗癌药物耐药性中发挥关键作用[28].然而,对于Lpar2及ATX-LPA信号轴在GC发生发展中的分子机制还有待进一步研究.
2.2 Lpar2基因表达水平与GIN及GC预后的相关性Zhang等[29]对51例GC、21例GIN组织及13例正常人胃粘膜组织进行免疫组织化学染色后发现,不同分化程度的GC组织LPA2受体阳性率不同,其中低分化为89.5%,中分化为81.3%、高分化为25%;LGIN的阳性率为25%,HGIN的阳性率为33.3%,正常胃粘膜的阳性率23.1%,各组之间均具有统计学差异;通过实时聚合酶琏反应(PCR)法检测Lpar2 mRNA在GC和GIN组织中的表达水平,结果分别为0.045±0.018和0.021±0.009,差异有显著性;根据年龄、Lauren分型等不同临床特征对51例GC患者进行分组,分别比较各组内LPA2受体阳性率,发现其与GC的浸润深度、Lauren分型、血管浸润、淋巴结转移、临床分期密切相关(P<0.05),且浸润深度深、临床分期晚、存在血管浸润及淋巴结转移的患者LPA2受体阳性率更高.上述研究显示,从正常胃粘膜发展到GIN,最后进展为GC的过程中,LPA2受体的表达阳性率逐步提升,低分化的GC患者受体阳性率更高,提示LPA2受体阳性的GIN患者或许更有可能进展为GC,LPA2受体水平较高的GC患者预后不良.
2.3 Lpar2基因是治疗GC的潜在新靶点 上皮细胞间质化(epithelial-mesenchymal transition,EMT)是上皮细胞向间质细胞转化的过程,E-cadherin为上皮细胞的分子标志物,Vimentin为间叶细胞的分子标志物,间质化的上皮细胞E-cadherin表达降低,Vimentin表达升高,从而具备游走迁移和浸润能力,在肿瘤侵袭转移过程中发挥重要作用.马琳娜等[30]用Lpar2表达载体转染 SGC-7901 GC细胞后,发现随着LPA2的水平增加,E-cadherin的表达逐渐降低,Vimentin的表达逐渐升高,提示 LPA2参与了GC细胞的EMT过程,LPA2水平增加后的GC细胞更加容易转移;Transwell侵袭和迁移实验显示GC细胞的侵袭和迁移能力随着 LPA2水平增高而增强;通过细胞增殖和凋亡实验发现,如上调LPA2受体水平,GC细胞的凋亡能力降低,增殖能力增强(P<0.05).上述研究表明,若能寻找到一种有效的药物抑制Lpar2基因的表达,进而抑制GC细胞的增殖,促进凋亡,或许又是一个GC治疗的潜在新靶点.
3 Hh信号通路与ATX-LPA信号通路之间的相关性
目前尚未见研究报道Hhip基因与Lpar2基因之间存在联系,但两者参与的信号传导通路可能存在交联关系,影响肿瘤的发生发展.有研究发现,Hh信号通路和参与调节增殖、分化、凋亡等多种细胞功能的PI3K/Akt通路相互激活、促进,共同参与GC细胞的EMT过程,加速GC进展和转移[31];另外,Hh信号通路效应蛋白GLI1也可以直接激活多种细胞功能基因的表达,表达产物包括SNAI1蛋白和OPN[8],其中SNAI1作为EMT多种信号通路的关键调控因子,与肿瘤转移密切相关[32];Po等[33]发现在肺癌中GLI1可以通过MAPK/ERK信号途径激活,多种机制诱导触发MAPK/ERK/GLI1级联反应,包括KRAS突变.另有研究报道ATX-LPA信号通路与PI3K/Akt和MAPK/ERK信号通路也存在交联关系,诱导OPN的表达,加速GC细胞迁移[24];LPA2受体可以激活MAPK/ERK信号转导通路的上游因子Ras,调节肿瘤细胞的增殖、分化和存活,在肿瘤的侵袭和转移中发挥重要作用[22];同时LPA2受体也参与GC细胞的EMT过程[30].Hh信号与ATXLPA信号通路之间或许存在更多的交联关系,对GC细胞的增殖、转移、分化和耐药产生影响,有待进一步研究探讨.
4 展望
综上所述,在GC的发生发展过程中,Hhip和Lpar2基因的表达分别发挥着抑制和促进的作用;GIN胃粘膜组织中Hhip基因的表达水平低于正常胃组织但高于GC组织,Lpar2基因的表达水平与之恰为相反;GC患者的预后与Hhip基因表达水平呈正相关,与Lpar2呈负相关.因此,联合检测Hhip和Lpar2的表达水平有望预测GIN的发生发展和GC的预后,Hhip与Lpar2也是GC治疗潜在的新靶点,为临床诊治提供新思路.但LGIN和HGIN胃黏膜组织的Hhip及Lpar2基因表达水平是否均存在差异,以及是否可以此评估LGIN发展为HGIN的风险程度,早期对高风险的LGIN患者进行内镜下治疗,尚需进一步探索.
