急性上消化道出血止血新技术的诊疗进展
2021-10-12李静蕾盛卫勇张进祥
李静蕾,程 平,盛卫勇,张进祥
李静蕾,程平,盛卫勇,张进祥,华中科技大学同济医学院附属协和医院急诊创伤外科 湖北省武汉市 430022
0 引言
急性上消化道出血(acute upper gastrointestinal bleeding,AUGIB)是指屈氏(Treitz)韧带以上的消化道出血,包括食管、胃、十二指肠、胆管和胰管等病变引起的出血[1],亦包括胃空肠吻合术后的空肠上段病变出血.总体发病率为48-160例/10万人,男性和老年人居多[2],死亡率约2%-10%[3].根据出血的病因分为静脉曲张性上消化道出血(variceal upper gastrointestinal bleeding,VUGIB)和非静脉曲张性上消化道出血(non-variceal upper gastrointestinal bleeding,NVUGIB)两类.在大多数国家,NVUGIB的发病率比VUGIB高五倍[4,5].AUGIB的临床表现有呕血、黑便、头晕、心慌、口干、贫血、低血压等症状,严重者伴有休克.近年来,AUGIB的诊断和治疗有了一些新的进展.
1 病因
1.1 消化性溃疡 约占31%-67%(图1),多见于胃或十二指肠溃疡,主要是幽门螺杆菌感染或使用非甾体抗炎药(non-steroidal anti-inflammatory drugs,NSAIDs)所致,是上消化道出血(upper gastrointestinal bleeding,UGIB)最常见的原因[6,7].
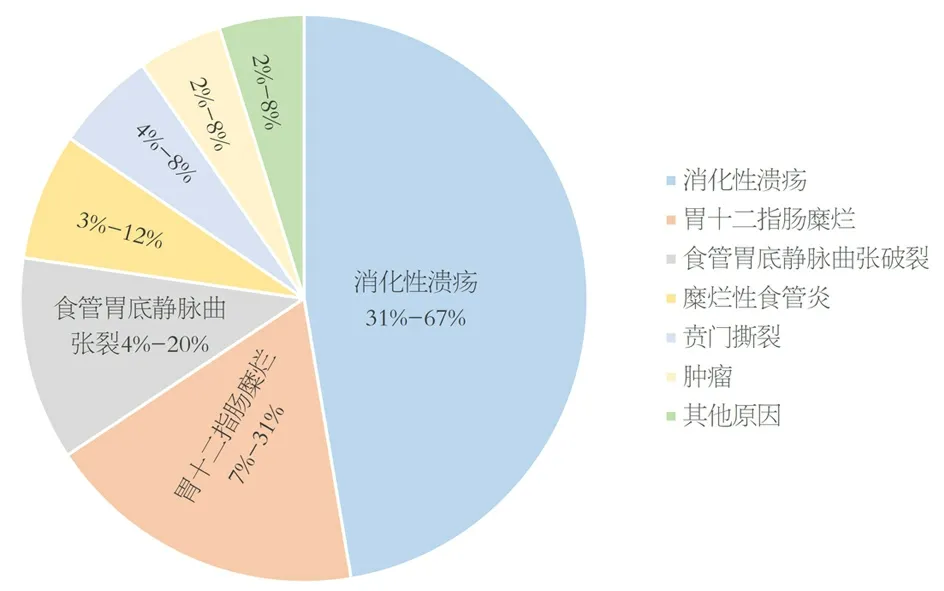
图1 急性上消化道出血的病因.
1.2 胃十二指肠糜烂 约占7%-31%,进一步进展即表现为溃疡[7].
1.3 食管胃底静脉曲张破裂 约占4%-20%,主要由于门静脉高压症引起的食管胃底静脉曲张,是肝硬化最严重的并发症,可导致70%的肝硬化患者出现UGIB[7],是UGIB致死率最高的病因[8].
1.4 糜烂性食管炎 约占3%-12%,主要由胃食管反流引起,当糜烂只局限于胃肠粘膜时,不会引起严重出血[5,6].
1.5 贲门粘膜撕裂 约占4%-8%,是由强烈呕吐引起的贲门撕裂,常见于酒后打嗝后呕吐的病人,通常是纵向的单发撕裂.撕裂通常发生在胃食管交界处的胃侧,可引起严重出血.
1.6 肿瘤 约2%-8%,主要是上消化道肿瘤局部缺血坏死,或侵犯大血管所致.见于胃癌、胃肠间质瘤、平滑肌瘤、淋巴瘤等,一些胃肠外肿瘤的转移也是可引起出血(11%)[9,10].研究显示[1],肿瘤性出血占全部UGIB的5%,79%肿瘤患者的首发症状表现为出血,其中75%在出血时已有转移病灶.
1.7 其他原因 如主动脉肠瘘、动静脉畸形或Dieulafoy病(粘膜内有异常血管)、凝血功能障碍、流行性出血热等[11].
2 诊断
2.1 初步诊断 AUGIB的初步诊断包括临床表现、体格检查和实验室检查.
最常见的临床表现是呕血和黑便.呕血可为暗红色甚至鲜红色伴血块.黑便一般呈深色柏油状,短时间快速的上消化道大出血可表现为鲜红色血便.
进行体格检查前,应首先评估低血容量和贫血的体征.需注意:(1)血流动力学状态:心动过速、脉搏细弱、低血压或直立性低血压、缺氧、末梢湿冷、意识状态的改变;(2)肠鸣音是否活跃,腹部是否有压痛、移动性浊音,慢性肝脏疾病或门静脉高压的体征(肝大、脾大、蜘蛛痣、肝掌、水母状脐周静脉突起等);(3)直肠指诊肛周情况及是否有血便或黑便.
实验室检查主要包括血红蛋白水平,血细胞比容,血小板计数,凝血酶原时间,国际标准化比值(international normalized ratio,INR),尿素,肌酐,电解质,肝功能和交叉配血等[5,7].
动态监测生命体征、血常规、凝血功能和血尿素氮等指标具有判断病情变化的指导意义.
2.2 影像学检查 胸片检查可排除肺炎、肺水肿,腹部超声可明确肝、胆、脾等脏器情况.
CT可全面评估腹部器质性病变及血管情况.如发现肠道的病变,可准确定位,并指导治疗方法的选择,如内窥镜检查,经血管介入手术或外科手术[12].
2.3 内镜检查 内镜检查被认为是诊断UGIB的金标准,内镜检查可以识别出血来源,并可以对活动性出血的病变进行止血治疗,对于定位UGIB的来源,具有92%到98%的高灵敏度和30%到100%的特异性[13].而内镜检查的时机是争论的重点.国际共识小组建议,对于AUGIB的患者,应在就诊后24 h内进行内镜检查[14].在血流动力学不稳定的患者中,在6-24 h内接受内窥镜检查的患者与院内死亡率降低有关[15].而对于有进一步出血或死亡高风险的AUGIB患者,在就诊后6 h内进行内镜检查与6-24 h内检查30天全因死亡率没有显著差异[19].其中,在美国麻醉医师学会(American Society of Anesthesiologists,ASA)评分为1至2的血液动力学稳定的患者中,未发现内镜检查时间与死亡率之间存在关联.在ASA评分为3至5的血液动力学稳定的患者中,入院后12 h至36 h行内镜检查,可降低院内死亡率[16].
3 风险评估
常用的风险评估评分包括格拉斯哥-布拉奇福德分数(glasgow blatchford score,GBS)、Rockall评分,AIMS6和PNED.一项前瞻性国际研究表明GBS在预测干预和内镜治疗需求方面最优,可以准确预测需要住院治疗的患者,评分≤1提示低风险患者接受门诊治疗.PNED和AIMS65评分在预测死亡率方面优于入院Rockall评分和GBS[17].但所有风险评分在预测死亡率方面的受试者工作特征曲线下面积(area under receiver operating characteristic curve,AUROC)均不高于0.80,提示预测这一终点的临床效用有限.最近的一项国际多中心研究显示,ABC(Age,Blood tests,Comorbidities)评分(表1)是基于患者年龄,血液检查和合并症的内镜检查前风险评分,与以前的评分相比,ABC评分在UGIB和下消化道出血(lower gastrointestinal bleeding,LGIB)中均能更好的预测死亡率.在UGIB中,AIMS65预测30 d死亡率的总体AUROC(95%CI)为0.65(0.62-0.69),而ABC评分的AUROC(95%CI)为0.81.在UGIB中,低ABC评分(≤3),中ABC评分(4-7)和高ABC评分(≥8)的患者30 d死亡率分别为1.0%,7.0%和25%.通过ABC评分可以对高或低死亡风险的患者进行早期识别和针对性管理[18].最近的另一项研究使用了梯度推进机器学习(machine learning,ML)模型,并开发了一种算法,该算法在识别需要医院干预(输血或止血干预)或将在30 d内死亡的患者方面优于GBS、Rockall和AIMS65.该模型可提高对低危患者的识别,使其能够安全出院进行门诊管理[19].
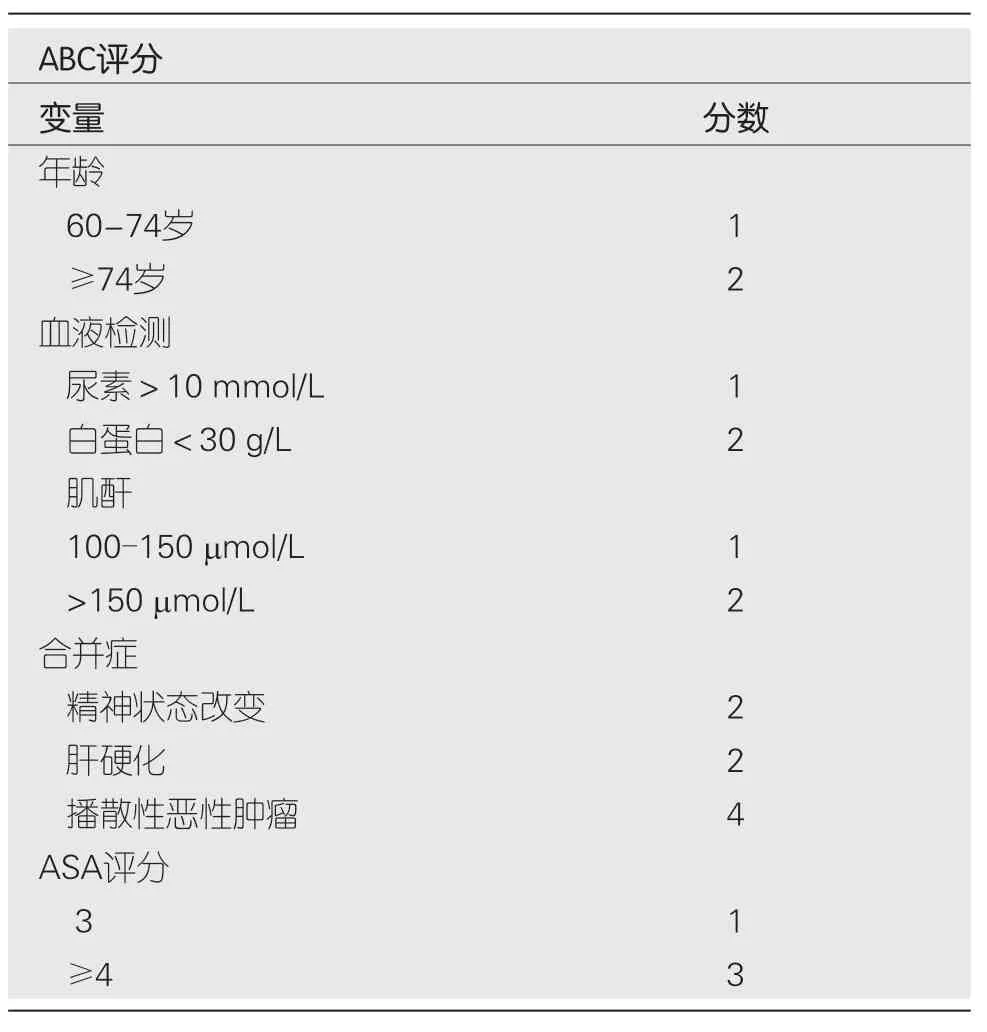
表1 ABC评分
4 治疗
4.1 初步复苏 对于患有AUGIB和血容量减少性休克的患者,必须尽早进行初步复苏,包括静脉输液和血液制品的容量复苏[2].红细胞输注应采用限制性输血,限制性输血的全因死亡风险较低,最新指南建议当血红蛋白水平降至70 g/L或80 g/L以下时,应进行红细胞输注,心血管疾病患者的血红蛋白阈值较高,通常为90 g/L[14,21,22].目前,尚没有随机对照实验(randomized controlled trial,RCT)评估UGIB中的液体复苏,初始复苏静脉输液的选择尚不清楚,在评估血液制品输血的需要时,经常使用晶体或胶体[3].
4.2 药物治疗 药物治疗仍是AUGIB的首选治疗手段.对于病情危重,特别是原因不详、既往病史不详的患者,在生命支持和容量复苏的同时,可以采用“经验性联合用药”:静脉应用生长抑素+质子泵抑制剂(proton pump inhibitor,PPI)[23-25].当高度怀疑静脉曲张性出血时,在此基础上连用血管升压素+抗生素[26,27],明确病因后,再根据情况调整治疗方案.
4.2.1 PPI:PPI通过增加胃内pH值来稳定血凝块,在实验模型中,减少胃酸分泌可促进血小板聚集,并抑制胃蛋白酶诱导的血凝块降解[22].目前,英国国家卫生与医疗保健研究院(National Institute for Health and Care Excellence,NICE)指南不支持AUGIB患者在内窥镜检查之前常规使用PPI[28].但如果没有内窥镜检查和内镜止血药,或者在就诊后的24 h内不进行内镜止血,则建议在内窥镜检查前使用静脉内PPI.对于有生命危险的出血患者,在内窥镜检查之前需要足够的时间进行足够的复苏,静脉内PPI可能具有暂时控制出血的作用[22].
内镜检查后,高危消化性溃疡出血患者(Forrest Ⅰ,Ⅱa和Ⅱb)以8 mg/h的速度静脉推注80 mg PPI,连续推注72 h降低了再出血和死亡率.多项研究表明,内窥镜检查后大多数UGIB患者间歇性静脉注射PPI治疗与连续输注PPI治疗疗效相同,并且间歇性治疗显著降低成本[29].而Kim等人[30]的研究表明静脉输注与口服PPI的14 d内再出血率,手术干预和死亡率没有统计学差异.最近的指南建议考虑间歇性高剂量口服或静脉内PPI(例如,最初80 mg推注后,每天分剂量注射80-160 mg),而不是连续输液[21,31].低危患者不需要大剂量PPI,可常规口服PPI出院,恢复其正常饮食[22].
4.2.2 止凝血治疗:患有心血管或脑血管合并症的急性上消化出血患者,需要长期使用抗血栓药,包括抗血小板药和抗凝药.在接受抗血小板药物治疗的心血管血栓高风险患者中,一旦建立止血机制,应尽快恢复使用抗血小板药物[21].阿司匹林是研究最广泛的用于UGIB患者的抗血栓药物.对156例服用阿司匹林进行二级预防的消化性溃疡出血患者的随机研究表明,内镜治疗后,小剂量(80 mg/d)服用阿司匹林的患者比安慰剂患者的8 wk死亡率低[32].因此,目前的指南建议,一旦止血,继续服用阿司匹林(或对于高风险的内镜病变,在3 d内重新使用药物)[21,31].
4.2.3 血管活性药物和抗生素:血管活性药物如特利加压素、生长抑素或其类似物奥曲肽和伐普肽,可引起内脏动脉血管收缩,用于肝硬化和静脉曲张出血患者.特利加压素,生长抑素和奥曲肽作为内镜治疗急性胃食管静脉曲张破裂出血的佐剂,止血效果和安全性无明显差异[33].当前的指南建议在怀疑有静脉曲张破裂出血后立即开始使用血管活性药物,持续至止血或长达5 d[34].对于正在接受生长抑素(或类似物)治疗的患者,不应同时给予PPI,因为生长抑素与PPI均能抑制胃酸分泌[35].血管活性药物的推荐剂量为每4小时2毫克特利加压素,250 μg生长抑素推注,随后250-500 μg/h推注,奥曲肽和伐普肽50 μg推注,随后50 μg/h,最多持续5 d[34].
Chavez-Tapia等人[36]的Meta分析结果显示,UGIB患者的抗生素预防可降低死亡率,减少再出血和住院时间.目前的指南建议,入院后应给予抗生素最多7d[34,37].
4.3 三腔二囊管 对于静脉曲张性消化道出血,如果出血量大,内镜难以治疗,可放置三腔二囊管作为短期控制出血和过渡到确定性治疗的临时措施[1].其放置时间不宜超过3 d,根据病情8-24 h放气一次,拔管时机应在止血成功后24 h.一般先放气观察24 h,若仍无出血即可拔管.三腔二囊管治疗易发生再出血及一些严重并发症,如食管破裂和吸入性肺炎,需要注意.
4.4 内镜治疗
4.4.1 内镜止血新技术:止血粉喷洒是一种新的内镜止血方法.止血粉是一种无机粉末,当与胃肠道中的水分接触时变得粘连,从而成为止血的机械屏障,该粉末不会附着在不渗血的表面上,因此仅影响活动性出血区域,使用类似手枪的装置将粉末通过导管喷到出血源上[38].止血粉喷洒对于NVUGIB有较高的初始止血率,但具有相对较高的再出血率,表明具有暂时性作用[38,39].目前,止血粉常用于现有方法无法控制的出血的临时抢救治疗[21].
de Nucci等人[40]报道了一种新型止血凝胶PuraStat用于控制常规止血方法失败后不同类型的消化道出血是可行、安全、有效的,它的应用也不妨碍继续内科治疗.PuraStat由完全合成的粘性肽溶液组成,可在中性pH值下形成透明的水凝胶.一旦PuraStat应用于出血区域,它会迅速形成水凝胶屏障以产生止血作用.Branchi等人[41]的研究也表明Purastat是一种有效的止血剂,可以减少内窥镜黏膜下剥离(endoscopic submucosal dissection,ESD)期间出血热疗的需要,改善切除后伤口愈合.
新的内镜技术还有超镜夹(over the scope clip,OTSC)和多普勒探针.OTSC夹子比标准的透镜夹(through-thescope clips,TTSC)夹子大得多,因此在将其应用于较大的纤维化病变或较大的供血血管时可能会成功[3].Chan等人[42]报道了成功使用OTSC治疗9例难治性UGIB.多中心RCT对66例初次止血后复发性溃疡出血的患者进行了研究,发现对于复发性消化性溃疡出血患者,OTSC的内镜治疗优于TTSC的标准治疗,患者进一步出血比例减少[43].Zhong等人[44]的Meta分析表明OTSC是一种技术上可行的方式,并且在止血方面非常有效.
而关于多普勒探针的应用,对148例严重非曲张上消化道严重出血的双中心RCT进行了比较,与标准的视觉引导止血相比,多普勒探针引导的内镜止血显着降低了30 d的再出血率[45].但对该方法的临床实用性还需进一步研究,目前指南不建议使用[31].
4.4.2 NVUGIB的内镜治疗:NVUGIB大部分是由消化性溃疡引起的,而消化性溃疡可分为高危和低危病变,高危病变包括活动性出血(Forrest Ⅰa喷血和1b渗血),无出血可见血管(Forrest Ⅱa),或附着血凝块(ForrestⅡb).低危病变包括溃疡底部有着色血痂(Forrest IIc)或清洁溃疡(Forrest Ⅲ).内镜治疗仅适用于高危病变溃疡.热疗(双极电凝探头,加热探头)和机械疗法(TTSC)都是有效的[22].注射疗法(例如肾上腺素)不作为单一疗法给药,而应与第二种内窥镜疗法(如热疗或机械疗法)联合使用,以确保持续止血.止血粉(如TC-325)可作为临时疗法[46].复发性出血应反复经内镜治疗,对于内镜下止血失败的患者,一种常见的策略是尝试经导管动脉栓塞,如果无法止血,则进行手术[23].
4.4.3 VUGIB的内镜治疗:对于静脉曲张破裂出血,内镜治疗已成为一线治疗.食管静脉曲张破裂出血的最佳内镜治疗方法是内镜下静脉曲张结扎术(endoscopic variceal ligation,EVL),与硬化疗法相比,内镜下静脉曲张结扎术出血少,副作用少.EVL应定期重复进行,以达到完全闭塞[24].胃底静脉曲张(gastric varices,GV)建议采用内镜检查方法注射组织粘合剂的氰基丙烯酸酯粘合剂(CYA)注射[25].在控制GV出血方面,随机试验显示注射组织粘合剂优于EVL,初始止血率更高(87%vs45%),再出血率更低(31%vs45%),持续效果可达3年[26,27].难治性静脉曲张破裂出血应行经颈静脉肝内门-体静脉支架分流术(transjugular intrahepatic portosystemic shunt,TIPS)治疗.对于大量难治性食管静脉曲张破裂出血,首选可移动覆盖金属支架而不是气囊填塞作为临时措施[3].
4.5 介入治疗 急性出血无法控制时应当及早考虑介入治疗.等待介入治疗期间可采用药物止血,持续静脉滴注生长抑素+PPI,可提高介入治疗成功率,降低再出血发生率.介入治疗包括经导管血管造影栓塞(transcatheter angiography embolization,TAE)和TIPS.TIPS主要适用于门静脉高压食管胃底静脉曲张出血保守治疗(药物、内镜治疗等)效果不佳、外科手术后再发静脉曲张破裂出血或终末期肝病等待肝移植术期间静脉曲张破裂出血[36,47].其特点为:能在短期内显著降低门静脉压,与外科门-体分流术相比,TIPS具有创伤小、成功率高、降低门静脉压力效果可靠、可控制分流道直径、能同时行断流术(栓塞静脉曲张)、并发症少等优点.TIPS在肝和门静脉之间形成分流,随后通过将血液转移到体循环中并远离肝窦来降低门脉高压.指南建议急性食管静脉曲张出血行早期 TIPS[37].与药物治疗加长期内镜下结扎相比,早期TIPS(入院72 h内)可显著降低食管静脉曲张高危患者(Child-Pugh C级肝硬化患者或Child-PughB级内窥镜检查持续出血的患者)的治疗失败率和死亡率[48,49].若二级预防的一线治疗(内镜结扎联合非选择性β受体阻滞剂)失败,TIPS放置并使用覆膜支架则是首选[37].在预防再出血方面TIPS比其他任何非分流术更有效.对急诊静脉曲张破裂出血的即刻止血成功率达90%-99%,但远期(≥1年)疗效不确定[1].影响疗效的主要因素是术后分流道狭窄或闭塞[1].但TIPS术后脑病发生率较高,放置覆盖的小管腔支架可降低肝性脑病[50].
TIPS放置中与并发症相关的技术难点之一是穿刺肝静脉的门静脉分支.之前是在荧光透视、用CO2或含碘造影剂显示门静脉系统.而最近的技术改进使图像引导成为可能,如经皮或血管内超声引导、直接经肝穿刺门静脉分支和造影剂注射以及使用锥形束CT,有了更高的成功率和更低的并发症发生率.其中经皮超声引导穿刺是最好和最简单的方法[51].
在胃底静脉曲张出血中,介入治疗可以通过TIPS术与球囊阻塞逆行曲张静脉闭塞术(balloon-occluded retrograde transvenous obliteration,BRTO)两大类来控制胃底静脉曲张破裂出血,初始止血成功率超过90%[52].然而,TIPS通过在门脉和全身循环之间产生分流,有效的肝血流量减少,代谢肝功能恶化的风险增加,并且加重了肝性脑病的发病率[53].通过引流血管内球囊导管的膨胀来阻塞血流,然后在球囊闭塞位点附近注入硬化剂,它比TIPS和分流手术创伤更小,具有高的胃静脉曲张出血闭塞率和低的再出血率,并显示了改善肝性脑病发生率和肝功能.因此,在过去的二十年中,BRTO已成为亚洲地区治疗胃底静脉曲张出血的首选方法[54].
近年来,对BRTO的硬化剂和球囊填塞有了一些改良.硬化剂通常需要几个小时,甚至超过6 h到20 h才能达到完全有效,用氰基丙烯酸酯和明胶海绵等栓塞剂替代传统的硬化剂乙醇胺油酸酯碘帕醇和十四烷基硫酸钠,所需的时间较短,且可消除硬化剂相关并发症[55,56].血管栓塞和线圈替代球囊填塞是安全有效的改良,技术简单、安全,减少手术时间.传统的BRTO术,球囊必须保持膨胀,直到硬化剂完全停止静脉曲张内的血液流动.这可能需要6 h到36 h,并可能导致一夜气球膨胀,从而增加并发症的风险.血管塞和线圈不需要患者整夜不活动,增加了患者的便利性,提高了成本效率[56].
4.6 手术治疗 尽管有以上多种治疗措施,但是仍有约20%的患者出血不能控制,此时应及时进行外科手术干预.外科分流手术在降低再出血率方面非常有效,但可增加肝性脑病风险,且与内镜及药物治疗相比并不改善生存率[1].目前,只有在无法充分处理静脉曲张破裂出血的医疗机构接受治疗的患者中,内窥镜,药物和介入放射疗法(TIPS或BRTO)失败时,才将手术视为抢救性治疗[57].
对于NVUGIB患者,相关指南建议在第二次内镜止血失败的情况下,首先考虑TAE当局部无法进行TAE或TAE失败时,应手术治疗[58].Meta分析结果显示经内镜止血失败后复发性NVUGIB的患者,TAE较外科手术可观察到更高的术后再出血率,而死亡率无显著差异,未来仍需相关的随机研究比较这两种方式[59].
5 结论
综上所述,AUGIB患者的风险评估、内镜止血的新技术、介入治疗方面均取得了重大进展,而用于评估内镜治疗是否充分有效的多普勒内窥镜探头,需要未来的进一步的临床研究评估其价值.此外,AUGIB病因的多样性和病情的紧急性常使其需要不同专业的医师协同诊治,多学科诊治策略的实施将大大提高诊治效率、减少病死率.
