早期肠内营养支持对结肠癌患者术后免疫功能的影响
2021-10-09李莲娜
李莲娜
日照市中心医院静脉药物配置中心,山东日照276800
结肠癌是临床上一种较为多见的消化科疾病,且近年来此病的发病率呈现逐年增长的态势。一旦患有此病,将对患者的生存质量乃至生命安全造成极大威胁,因此需及时采取切实有效的方式加以治疗[1]。通常一般采取手术切除的方式治疗结肠癌,虽然手术可取得一定的效果,但同样会引起一些并发症,如术后营养不良,并影响患者的免疫功能。通常导致患者营养不良的原因有许多,如癌细胞增殖、手术麻醉、吞咽困难等[2-3]。鉴于此,采取有效方式加强对患者的营养支持,是极为有必要的。现今临床上通常采取两种营养支持方式,即肠内营养支持与肠外营养支持。为了解早期肠内营养支持的临床运用价值,该文对该院于2019年4月—2020年3月所接诊的33例结肠癌患者予以早期肠内营养支持,现报道如下。
1 资料与方法
1.1 一般资料
方便选取该院接诊的66例结肠癌患者为研究对象,所有患者均经临床病理学检查,确诊为结肠癌。按随机双盲法,将其分为参照组与研究组,每组33例。参照组中男19例、女14例;年龄35~58岁,平均年龄(43.9±3.9)岁;病程1~4年,平均病程(2.8±0.7)年;疾病位置:14例左半结肠,12例右半结肠,4例乙状结肠,3例横结肠。研究组中男18例、女15例;年龄33~59岁,平均年龄(44.1±3.3)岁;病程1~4年,平均病程(2.9±0.8)年;疾病位置:13例左半结肠,11例右半结肠,5例乙状结肠,4例横结肠。对以上两组患者的临床基础性资料(如性别、年龄、病程、疾病位置等)展开比较,差异无统计学意义(P>0.05),存在可比性。该次研究已征得医院医学伦理委员会的认可。患者及其家属对此项研究知情,并签署参与研究同意书。
纳入标准:通过结直肠镜检查、病理组织检查,确诊为结肠癌;手术前并未接受放化疗治疗;术前14 d内并未接受免疫增强剂、白蛋白等治疗。
排除标准:存在严重心脑肾等脏器疾病者;并发肠梗阻者;重度营养不良者、重度贫血者;存在严重内分泌代谢疾病者,如甲亢、糖尿病等;对肠内营养支持不耐受者。
1.2 方法
对66例结肠癌患者皆实施结肠癌根治一期吻合手术治疗,手术前,对患者予以复方聚乙二醇电解质散,以便做好肠道准备,同时叮嘱患者术前8 h禁止饮食。
参照组予以全肠外营养支持,具体如下:采取深静脉置管的方式,对患者予以肠外营养支持,其中每日输入的总液体量在50 mL/kg,总热量则参照非蛋白质热量进行供给,即25 kcal/(kg·d)。其中,以复方氨基酸注射液作为氮物质的供给;此外,非蛋白质热量的供给可分为两部分,即葡萄糖与结构脂肪乳剂(国药准字J20160046),所占比例分别为60%~70%、30%~40%。术后第7天,患者可进食流质食物。
研究组予以早期肠内营养支持,具体如下:术后8 h,对患者予以250 mL的温盐水,鼻饲;术后第1天,通过肠内营养泵加热的方式,对患者予以500 mL的短肽型肠内营养制剂(百普力,国药准字H20010285),速度控制在25 mL/h。术后第2天,结合患者的实际情况,比如胃肠道耐受情况,将营养制剂的总量增加至1 000 mL,可分成经口进入与胃管泵入两种方式。术后第3天将营养制剂总量增加至1 500 mL、术后第4~6天增加至2 000 mL。在泵入短肽型肠内营养制剂前,需将其加热到37℃。
对上述患者均予以为期7 d的营养支持治疗。
1.3 观察指标
②对两组患者术后排气时间、下床活动时间、住院时间以及术后并发症发生情况等进行观察与对比。②对两组患者术前及术后7 d的各项免疫指标进行观察,主要观察指标有:CD3+、CD4+、CD8+、CD4+/CD8+。
1.4 统计方法
采用SPSS 22.0统计学软件进行数据分析,计量资料的表达方式为(±s),采用t检验,计数资料的表达方式为[n(%)],采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者术后恢复情况对比
研究组患者术后排气时间、下床活动时间、住院时间均比参照组患者短,差异有统计学意义(P<0.05)。见表1。
表1 两组患者术后恢复情况对比[(±s),d]
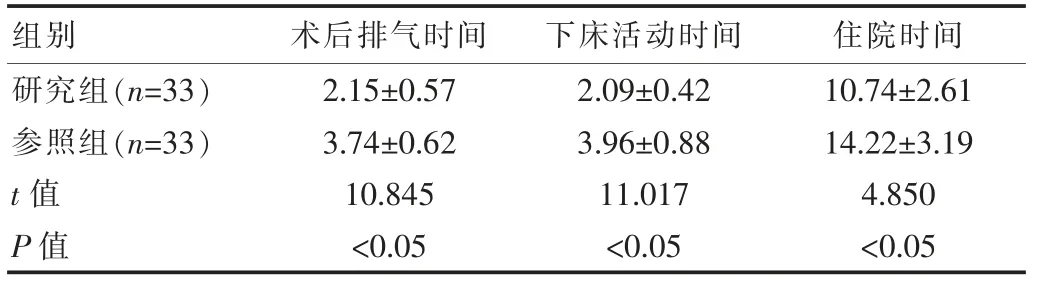
表1 两组患者术后恢复情况对比[(±s),d]
组别术后排气时间下床活动时间 住院时间研究组(n=33)参照组(n=33)t值P值2.15±0.57 3.74±0.62 10.845<0.05 2.09±0.42 3.96±0.88 11.017<0.05 10.74±2.61 14.22±3.19 4.850<0.05
2.2 两组患者手术前后免疫指标变化对比
手术前,两组患者的各项免疫指标(如CD3+、CD4+、CD8+、CD4+/CD8+)对比,差异无统计学意义(P>0.05);手术后,两组患者的各项免疫指标均优于该组手术前,且研究组患者手术后各项免疫指标均优于参照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者手术前后免疫指标变化对比[(±s),%]

表2 两组患者手术前后免疫指标变化对比[(±s),%]
注:*与参照组相比,P<0.05;#与该组手术前相比,P<0.05
组别时间CD3+CD4+研究组(n=33)参照组(n=33)手术前手术后手术前手术后58.42±3.51(64.81±3.49)#*58.24±3.62(59.47±3.09)#41.21±4.27(53.19±4.49)#*41.22±4.19(45.28±3.88)#CD8+ CD4+/CD8+35.27±2.97(23.89±2.58)#*35.11±2.88(31.17±3.02)#1.35±0.34(1.59±0.28)#*1.35±0.33(1.40±0.27)#
2.3 两组患者术后并发症发生情况对比
研究组术后并发症发生率为6.1%低于参照组的24.2%,差异有统计学意义(χ2=4.243,P<0.05)。见表3。

表3 两组患者术后并发症发生率对比[n(%)]
3 讨论
结肠癌是一种较为多见的恶性肿瘤,通常患有此病的患者,往往都存在程度不等的免疫功能抑制以及营养不良,而这种情况不但会影响患者疾病的治疗效果,还可能引起癌症复发,最终影响其预后效果[5-7]。鉴于此,临床上一般会对患者予以营养支持治疗,而最为常见的方式为肠外营养支持。然而,经临床实践得知:肠外营养支持与人体的生理特征不付,长时间采取该种方式治疗将造成肠黏膜萎缩,细菌移位,继而诱发肠源性感染。有报道指出:长时间予以肠外营养支持,将影响机体细胞的免疫功能,具体体现在肠道相关淋巴组织数量明显下降,CD4+/CD8+减少,NK细胞 活性降低[8-10]。相较于肠外营养支持,肠内营养支持与人体生理特征相符,其不但有助于肠黏膜结构及其功能不受影响,确保肠黏膜屏障功能的有效性,避免肠黏膜由于受损、感染、缺血、营养不良等引起屏障功能障碍,继而造成肠道菌群移位,最终降低肠源性感染的出现。另外,该种方式能对胃肠激素、免疫球蛋白等的分泌起到刺激作用,以在一定程度提升患者术后肠黏膜的循环[11]。而早期实施肠内营养支持,不但能对术后T淋巴细胞免疫的抑制情况加以调节,加速其免疫功能的快速恢复;同时,还能在一定程度优化人体内脏的血流灌注,加速肠黏膜血运的及早恢复,从而为确保肠道免疫功能的完整性起到积极的作用。在该次研究中,研究组手术后的CD3+、CD4+、CD8+、CD4+/CD8+等指标均优于该组手术前及参照组手术后,以CD3+为例,(64.81±3.49)%vs(59.47±3.09)%。在肖华等[12]人的研究中,实施早期肠内营养支持的45例患者,其术后7 d的CD3+、CD4+、CD4+/CD8+等均优于实施全肠外营养支持的另外45例患者,以CD3+为例,(48.2±5.2)% vs(43.4±4.8)%。这表明研究组所用治疗方式在保证患者术后早期免疫功能方面,可起到积极作用。
除此之外,研究组患者的术后排气时间、下床活动时间、住院时间均比参照组短,同时,其术后并发症发生率显著低于参照组,即6.1% vs 24.2%。这就表明研究组所用治疗方式在加快结肠癌患者的术后早期恢复,预防肠外营养失衡,避免术后并发症的发生等各方面,均可起到积极作用。而出现该种情况的原因可能是:在术后的若干小时内,小肠能快速恢复,肠内营养支持与小肠的吸收特征相符,能加速其营养物质的快速吸收及利用,提升机体营养,确保肠道屏障功能,预防肠内细胞发生移位。肠内营养支持一则能有效预防术后切口感染的发生,能经由提升机体免疫力而减少其他部位感染的出现;二则能对肠道蠕动起到刺激作用,加速肠道功能的早日恢复,从而有助于切口的快速愈合。
综上所述,对直肠癌手术患者予以早期肠内营养支持,可取得令人满意的临床效果,不但能强化患者的免疫功能,同时还可降低或避免并发症的发生,是一种值得在临床上大力推广的治疗方式。
