丹参注射液与临床常用输液配伍的稳定性研究
2021-10-09陈虹郭昌贵合雄赖芸韩惟芳孙荣飞戴宇婷
陈虹,郭昌贵,合雄,赖芸,韩惟芳,孙荣飞,戴宇婷
1.云南省昭通市中医医院,云南昭通657000;2.云南省昭通市食品药品检验所,云南昭通657000
丹参注射液具有活血化瘀、通脉养心功效,主要用于治疗冠心病心绞痛[1-2]、脑损伤[3-4]的治疗,对肝损伤[5]、糖尿病[6]等也有一定的作用,是临床上应用较广泛的中药注射液之一。用法用量为肌内注射,2~4 mL/次,1~2次/d;静脉注射,4 mL/次,用50%葡萄糖注射液20 mL稀释后使用,1~2次/d;静脉滴注,10~20 mL/次,用5%葡萄糖注射液100~500 mL稀释后使用,1次/d。随着丹参注射液在临床的广泛应用,不良反应也随之增加,有文章提到药品不良反应的发生可能与药品使用不得当有关,其中就包括溶媒的选用[7]。因此该研究将考察丹参注射液与临床常用输液配伍后的稳定性,分别从时间、温度及光照对配伍液的外观性状、pH、不溶性微粒及对有效成分(丹参素钠、原儿茶醛)含量的影响来探讨丹参注射液的合理搭配与应用,旨在为临床安全、合理使用丹参注射液提供科学依据和用药指导。现报道如下。
1 材料与方法
1.1 仪器
高效液相色谱仪(Agilent 1200型,安捷伦),电子天平(MS105 DU,瑞士梅特勒),超声波清洗机(UC-7100S型,美瑞泰克),真空泵(AP-9925,天津奥特赛恩斯),雷磁pH计(PHS-3B型,上海精科),数显鼓风干燥箱(GZX-9246MBE型,上海博迅),冷藏展示柜(LG4-1000M3,广州穗凌电器),微粒分析仪(GWF-8JA,天津天河医疗仪器),医用净化工作台(YJ-1450DA,苏州净化设备厂)。
1.2 试药
丹参注射液(四川升和药业,19021051,10 mL/支),丹参素钠对照品(中国食品药品检定研究院,110855-201614,20 mg/支,含量以98.1%计),原儿茶醛对照品(中国食品药品检定研究院,110810-201608,20 mg/支,含量以99.3%计),5%GS(昆明南疆制药,CD190205F,500 mL/瓶;AD190127C1,250 mL/瓶),0.9%NS(昆明南疆制药,AD190208L2,250 mL/瓶),10%GS(昆 明 南 疆 制 药,CD190203D,500 mL/瓶),5%GNS(昆 明 南 疆 制 药,CD190407D,500 mL/瓶),转化糖注射液(四川美大康佳乐药业,18091232,250 mL/袋),果糖注射液(江苏正大丰海能,1711181,250 mL/瓶),乙腈(MERCK,JA070530,4 L/瓶),娃哈哈纯净水,其余试剂均为分析纯。
1.3 方法
1.3.1 色谱条件 色谱柱:Agilent Eclipse Plus C-18色谱柱;流动相:乙腈-水-甲酸(12∶87∶1);流速:1.0 mL/min;柱温:30℃;检测波长:280 nm;进样量:10 μl。
1.3.2 系统适用性试验 在上述色谱条件下,注入丹参素钠、原儿茶醛的混合对照品溶液10 μl,记录色谱图1,丹参素钠、原儿茶醛对照品的保留时间分别为4.094、8.101 min,理论塔板数按原儿茶醛峰计算应不低于3 000。

图1 对照品色谱图
1.3.3 对照品溶液的制备 精密称取丹参素钠、原儿茶醛对照品适量(41.59 mg,15.84 mg),分别置于50 mL容量瓶中,加流动相溶解稀释至刻度,分别制得丹参素钠对照品溶液(815.995 8 μg/mL)、原儿茶醛对照品溶液(314.582 4 μg/mL)。
1.3.4 供试品溶液的制备 精密量取丹参注射液5 mL,置于25 mL容量瓶中,加流动相稀释并定容至刻度,用0.45 μm微孔滤膜过滤即得供试品溶液。
1.3.5 方法学验证①专属性试验。分别取空白对照溶剂、对照品溶液及供试品溶液各10 μL,按照“2.1.1”项下色谱条件检测,结果供试品溶液在相应对照品溶液出峰处未见其他峰干扰,专属性良好,结果见图2、图3、图4。

图2 专属性空白对照色谱图

图3 专属性对照品色谱图A为丹参素钠B为原儿茶醛
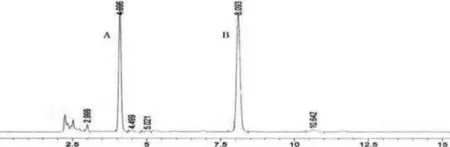
图4 专属性供试品色谱图A丹参素钠B原儿茶醛
②标准曲线的制备。分别精密量取丹参素钠和原儿茶醛对照品溶液0.5、1、2、3、4、5 mL置于10 mL量瓶中,加流动相至刻度,摇匀,得系列质量浓度的混合对照品溶液(丹参素钠40.80、81.60、163.20、244.80、326.40、408.00 μg/mL、原儿茶醛15.73、31.46、62.92、94.38、125.84、157.30 μg/mL)。按“1.2.1”项下色谱条件,测定峰面积,以峰面积为纵坐标,质量浓度为横坐标,绘制标准曲线,得回归方程丹参素钠y=7.0792x-17.68(r=0.999 5),原儿茶醛y=34.24x+54.786(r=0.999 6)。结果表明,丹参素钠、原儿茶醛分别在质量浓度范围40.80~408.00 μg/mL、15.73~157.30 μg/mL内,质量浓度与峰面积线性关系良好。
③精密度试验。取“1.2.3”项下的混合对照品溶液10 μl,连续进样6次,记录各色谱峰的峰面积,计算丹参素钠、原儿茶醛峰面积的RSD分别为0.079%、0.156%,结果表明仪器精密度良好。
④重复性试验。取丹参注射液6支,各精密量取5 mL置于25 mL容量瓶中,加流动相稀释定容至刻度,0.45 μm微孔滤膜过滤后,注入高效液相色谱仪测定并计算各成分含量,结果丹参素钠、原儿茶醛的平均含量分别为975.96、277.45 μg/mL,RSD分别为0.723%、0.754%,结果表明该色谱条件下的含量测定方法重复性良好。
⑤回收率试验。精密量取已知含量的丹参注射液2.5 mL置于25 mL容量瓶中,分别加入丹参素钠对照品溶液3 mL和原儿茶醛对照品溶液2.2 mL,加流动相定容至刻度,平行制备6份。按“1.2.1”项下色谱条件测定峰面积并计算丹参素钠、原儿茶醛的平均回收率,分别为92.64%、89.60%,RSD分别为1.520%、1.470%。
1.4 成品输液配伍稳定性考察
模拟临床用药,参照说明书推荐溶媒和剂量,由同一操作人员在100级水平层流台内,取丹参注射液加入5%GS中配成供临床使用的最高浓度(20 mL→100 mL)和最低浓度(10 mL→500 mL)成品输液,依次标记为样1、样2。另分别取丹参注射液20 mL溶于非说明书推荐的溶媒(0.9%NS、10%GS、5%GNS、果糖注射液、转化糖注射液)250 mL中,配成常规浓度的成品输液,依次标记为样3、样4、样5、样6和样7。每份成品输液分为6组,每组5份,分别编号并标记为A1~A5,B1~B5,C1~C5,D1~D5,E1~E5,F1~F5。其中A、B、C组采取遮光措施,D、E、F组则在光照条件下,分别将A、D组置于常温(10~30℃),B、E组置于高温(35~37℃),C、F组置于低温(4~8℃),于0、1、2、4、6、8 h观察各组成品输液外观性状,测定pH值及有效成分含量,于0、0.5、1、2、5、8 h进行不溶性微粒检测,并以随行考察条件下相应的输液作空白对照。
2 结果
2.1 外观与pH
分别取各组不同条件下的成品输液适量,于0、1、2、4、6、8 h观察上述成品输液的澄明度、颜色及有无可见异物,并测定pH。结果显示除5%GS高浓度配伍液的外观呈棕色外,其余溶媒的成品输液外观呈浅棕色,溶液澄清,无可见异物。空白溶媒pH值:5%GS(250 mL)4.28、5%GS(500 mL)4.53、0.9%NS 5.76、10%GS 3.73、5%GNS 4.12、转化糖注射液4.12、果糖注射液3.66。所有组别成品输液8 h内pH的RSD≤1%,说明时间、温度及光照对丹参成品输液pH的影响无明显差别,具体pH变化范围,见表1。

表1 丹参注射液与不同溶媒配伍后在不同条件下pH的变化范围
2.2 不溶性微粒检查
分别取各组不同考察条件下的成品输液适量,于0、0.5、1、2、5、8 h时,按中国药典2015年版四部规定的不溶性微粒检测法中的光阻法测定每毫升成品输液中≥10 μm和≥25 μm的不溶性微粒数,药典规定标示装量为100 mL或100 mL以上的静脉用注射液除另有规定外,每1 mL中含10 μm及10 μm以上的微粒数不得过25粒,含25 μm及25 μm以上的微粒数不得过3粒。结果显示0 h时样1~样7中≥10 μm的微粒数分别为55.4、14.7、30.3、15.0、12.2、17.8、48.9;≥25 μm的不溶性微粒数分别为3.0、0.5、2.2、1.0、1.9、1.5、5.3。丹参注射液与5%GS的高浓度配伍液及与0.9%NS、转化糖注射液的配伍液8 h内的不溶性微粒均超标;与5%GS配伍的低浓度配伍液低温光照2 h时不溶性微粒超标;与果糖的配伍液8 h内的不溶性微粒均符合规定;与10%GS配伍的成品输液常温光照8 h的不溶性微粒超标;与5%GNS配伍的成品输液,高温光照下2 h后不溶性微粒超标,低温条件下无论避光与否,0.5 h后不溶性微粒均超标。虽然光照、温度在不同溶媒中对成品输液的影响无规律性,但实验结果表明在高温、低温条件下存放的成品输液不溶性微粒更容易超出药典规定。见表2。

表2 丹参注射液与不同溶媒配伍后8 h内不溶性微粒的变化(个/mL)
2.3 丹参素钠与原儿茶醛在成品输液中的含量变化
取“1.3”项下各组成品输液于0、1、2、4、6、8 h按“1.2.1”项下色谱条件进样,测定丹参素钠、原儿茶醛在各组成品输液中的峰面积,分别以0 h的含量为100%换算其他时间点的含量。
结果表明:丹参注射液与6种溶媒配伍后8 h内各条件下的丹参素钠含量变化均较小,与5%GS配成的高浓度配伍液中原儿茶醛在常温和高温条件下含量下降较大,特别在高温光照条件下8 h时原儿茶醛的含量下降了13.95%;低浓度丹参5%GS成品输液及与其他溶媒配成的成品输液8 h内丹参素钠、原儿茶醛的含量变化均在2%以内。由此可推断丹参注射液与5%GS的配伍液放置8 h,药物浓度较高时,温度和光照可能会对有效成分含量产生一定影响,而药物浓度较低时则无明显影响,样1、样2结果,见表3。
3 讨论
丹参注射液的说明书推荐溶媒为5%GS,有研究分析近年来国内医药期刊公开发表的文献,总结发现丹参注射液可选10%GS、0.9%NS、5%GS做溶媒[8]。也有文献称丹参注射液合理配伍的条件为25℃、剂量20 mL与100 mL 0.9%NS配伍放置2 h,此条件下配伍液稳定性较好,该实验中对丹参注射液与溶媒配伍后分别放置于4℃、25℃、35℃条件下4 h内的有效成分含量进行考察,发现4 h时6个样品的丹参素钠标示百分含量之和分别为598.43、594.49和588.26(P<0.01),原儿茶醛含量分别为594.00、596.04和586.87(P<0.05),结果表明:导致丹参素钠、原儿茶醛含量降低的是35℃以上温度,25℃以下温度对其几乎无影响[9]。
该研究中丹参注射液20 mL与5%GS 100 mL配成高浓度的成品输液后,不溶性微粒数超药典标准,而且在高温光照条件下(36℃)放置时,高温光照组8 h原儿茶醛含量下降最大约14%,实验表明有效成分原儿茶醛的含量受高温光照、常温光照及低温光照的影响由强至弱,而与其他溶媒的常规浓度、低浓度成品输液中的原儿茶醛含量最大下降不超过3%,较稳定,丹参素钠含量几乎无变化。由此可看出,高温光照对丹参5%GS高浓度成品输液有效成分含量有影响,推断高温和药物浓度是影响丹参注射液中原儿茶醛含量的因素。对此,有研究对相关文献进行分析后建议在不影响疗效的情况下,使用丹参注射液应尽量选用0.048%(丹参药材:g/mL)及以下的稀释浓度,以免药物浓度过大,发生不良反应的风险增加[10]。
该研究中丹参注射液20 mL与250 mL 0.9%NS、转化糖注射液配伍后不溶性微粒超过药典标准;丹参注射液20 mL与250 mL果糖注射液配伍后外观和pH无明显变化、不溶性微粒在药典规定范围内、主要成分含量与0 h比较无明显变化,配伍较稳定。但有作者观察到10 mL丹参注射液加入250 mL果糖注射液中,外观、pH、不溶性微粒变化较小,而配伍2 h后紫外最大吸收波长变化显著,稳定性变差[11]。因此配伍时,溶媒选择应慎重。最后,丹参注射液与5%GS配伍的低浓度成品输液不溶性微粒在药典范围内,而高浓度成品输液的不溶性微粒超标,说明不溶性微粒可能与丹参注射液的用量或药物浓度有关。文中的实验结果与相关研究有相通之处,即药物与溶媒配伍的不同浓度对不溶性微粒的变化有一定影响,药物配伍不当也会导致输液中不溶性微粒的增加[12-14]。
综上所述,在临床实际应用丹参注射液时,不可随意更改说明书推荐的溶媒或剂量,调配好的成品输液应尽量避免放置在高温条件下,并应注意遮光或避免日光直射,同时还应注意避免因成品输液药物浓度过高、放置时间过长而导致成品输液中的有效成分降低而无法达到预期疗效或导致药物不良反应的发生。另外,成品输液质量中不溶性微粒是质量评估的重要指标,不溶性微粒与调配环节中的输液配伍、输液操作、配置环境有关,因此建议有条件的医院将中药注射剂等药物在静配中心集中调配后下送到临床科室,以期输液质量能够得到提升,保证患者用药安全。
