神经导航技术在颅脑肿瘤手术中的应用
2021-10-09骆承章蒋敏杰吴小明蒋宽蒋建刚
骆承章,蒋敏杰,吴小明,蒋宽,蒋建刚
宜兴市人民医院神经外科,江苏宜兴214200
颅脑肿瘤通常由于其生长部位、生长方式、肿瘤质地、血供以及其与神经纤维束之间的毗邻关系等复杂的解剖结构,而造成手术切除难度极大,手术风险极高,部分患者在术后会遗留神经功能缺损。目前几乎所有的神经外科医生都提倡在脑肿瘤手术中应当做到在尽可能保留患者神经功能的前提下最大范围切除肿瘤[1],因此必须要对病灶的位置、边界及其周围正常组织结构定位准确,另外也应避免术中肿瘤切除时对正常脑组织(尤其是运动传导束)的损伤。尽管显微外科技术的进步极大的满足了神经外科手术微侵袭发展方向的需要,然而肉眼下观察肿瘤边界具有局限性,且不能识别神经传导束的位置与走行,因此常规显微手术往往难以兼顾最大范围切除病灶与尽可能保留神经功能。该研究回顾性分析了宜兴市人民医院2016年1月—2020年8月收治并行手术治疗的65例脑肿瘤患者的临床资料,现报道如下。
1 资料与方法
1.1 一般资料
方便选取该院收治并手术的65例脑肿瘤患者临床资料作为研究对象。其中男性患者21例,女性患者44例;年龄25~75岁,平均年龄(58.91±11.37)岁。根据手术方式不同分为两组:分别为观察组(导航辅助)19例,对照组(无导航辅助)46例,比较两组之间一般资料,包括年龄、性别、肿瘤大小、深度以及与功能区毗邻关系等情况,差异无统计学意义(P>0.05),具有可比性。见表1、表2。
表1 观察组与对照组一般资料比较(±s)

表1 观察组与对照组一般资料比较(±s)
项目观察组对照组t值 P值年龄(岁)肿瘤大小(cm)肿瘤深度(cm)58.84±14.21 3.61±1.50 4.27±1.85 58.93±10.16 3.78±1.54 4.37±1.73 0.030 0.431 0.210 0.976 0.669 0.834

表2 观察组与对照组一般资料比较
1.2 方法
1.2.1 观察组 采用美敦力S7神经导航系统辅助下行脑肿瘤切除手术。患者术前除常规行CT扫描及MR平扫+增强扫描外,另做T1增强导航序列,必要时加做弥散张量成像(DTI)序列,层厚为1.5 mm,扫描范围从头顶向下直至包括鼻尖,术前将磁共振导航序列的原始数据(DICOM格式)拷贝并导入S7导航系统,随后完成术前初步规划。手术当日,患者全麻成功后,根据开颅部位摆放好体位,使用Mayfield三钉头架固定患者头部,安装万向臂及参考架,调整万向臂、参考架及红外线光学摄像仪至合适位置,然后利用手术患者本人影像数据在导航系统融合成的图像与其头面部体表特征匹配进行注册。注册成功后使用头面部特殊解剖标志(如内眦、外眦、鼻尖、耳屏等)来验证导航精度。术中在导航辅助下规划皮肤切口、骨窗范围、肿瘤位置、边界、颅内重要结构的毗邻关系等,在减少正常脑组织结构损伤的同时尽可能在显微镜下全切肿瘤。
1.2.2 对照组 常规使用显微镜行肿瘤切除手术。术前同样需取得完整的影像学资料,根据颅内重要结构的体表定位以及与颅内占位相对位置情况来判断肿瘤位置,并设计皮肤切口,在显微镜下判断肿瘤与正常脑组织分界,手术医生完全依据自身手术技巧及临床经验确定切除范围。
1.3 观察指标
手术当天或隔天查头颅CT,术后1个月内常规复查头颅MR平扫+增强,判断两组肿瘤是否全切,记录手术时间、术后住院时间、术后致残率、颅内感染发生率,术后定期随访并记录术前/术后3个月Karnofsky功能状态(KPS)评分以评价手术疗效。
1.4 统计方法
采用SPSS 20.0统计学软件对数据进行分析。符合正态分布的计量资料用(±s)表示,两组数据差异比较使用t检验。不符合正态分布的计量资料用中位数表示,两组数据间比较采用非参数秩和检验。计数资料用频数和率(%)表示,两组间差异比较采用χ2检验或者fisher精确检验法。P<0.05为差异有统计学意义。
2 结果
该研究中,观察组肿瘤全切除15例(78.9%),次全切除及部分切除共4例(21.1%);对照组肿瘤全切除24例(52.2%),次全切除及部分切除共22例(47.8%)。两组全切除率数据比较,差异有统计学意义(P<0.05),观察组肿瘤全切除率明显高于对照组。此外,观察组术后住院天数为(18.79±3.32)d,而对照组为(23.02±8.48)d,观察组术后住院天数明显少于对照组,差异有统计学意义(P<0.05)。另外,观察组和对照组在手术时间、手术致残率以及术后感染发生率之间比较差异无统计学意义(P>0.05),见表3。
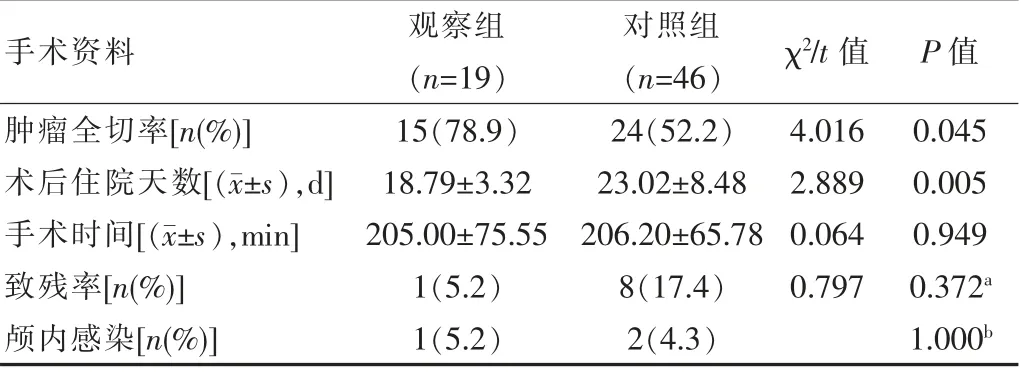
表3 观察组和对照组术后资料比较
该研究中,观察组和对照组术前、术后3个月KPS评分不符合正态分布,采用非参数秩和检验,两组的术前KPS评分相比较,差异无统计学意义(P>0.05);观察组术后KPS评分显著高于对照组,差异有统计学意义(P<0.05),见表4。

表4 观察组和对照组术前、术后KPS评分比较M(P25,P75)
3 讨论
中枢神经系统解剖结构及功能错综复杂,脑皮层以及关键白质束局部的微小损伤即有可能带来难以逆转的神经功能缺失。由于不同个体之间颅内结构存在一定的解剖学差异,加之脑肿瘤的膨胀、浸润等生长方式常会引起周围正常组织结构移位,依据常用颅内解剖标志的体表投影来定位功能区、肿瘤以及两者之间位置关系往往并不准确。另外,手术过程中时常也难以仅通过肉眼观察来辨认肿瘤组织边界,且根据经验来判定功能区范围或者传导束位置通常也不可靠,这就导致术者在常规手术方式下切除肿瘤时往往过于保守,难以做到肿瘤全切而影响患者的总体预后。
神经导航技术目前已广泛应用于脑功能区病灶、颅底肿瘤、脑血管病变、癫痫等手术中[2]。其优势在于术前即能获取肿瘤在颅内的具体位置以及立体结构图像,方便术者设计手术入路,避免不必要的组织暴露,而术中又能够直接显示肿瘤与正常脑组织分界,并实时反应肿瘤切除程度[3]。其在边界欠清肿瘤手术中的作用更加明显,不仅能够增加肿瘤全切机率[4],还可以减少术中脑组织损伤。此外,多模态神经导航技术也日趋成熟,利用弥散张量成像(DTI)序列重建并融合其他磁共振导航序列,准确显示病灶及其周围正常脑组织中白质纤维束[5]、功能区、血管等结构的三维立体关系[6],有助于术前定位脑功能区[7],同时术中实时了解手术切除深度及切除范围,以保护肿瘤邻近的传导束和功能区,提高肿瘤的全切率及手术的安全性[8]。
在该次研究中,神经导航联合显微镜手术组的肿瘤全切除率为78.9%,要显著高于传统显微镜组52.2%的肿瘤全切率(P<0.05),这一结果与古嘉宇等[9]的研究结果[导航组肿瘤全切率91.3%,显著高于非导航组的肿瘤全切率73.6%(P<0.05)]基本一致,提示神经导航系统能够帮助外科医生精确的寻找到肿瘤位置[10],更重要的是,术者在手术过程中也可以通过持续导航来实时跟踪术者的切除范围。由此可见,神经导航引导下的脑肿瘤切除手术可以获得更高的肿瘤全切除率[11],且利用术中持续导航可以最大范围切除肿瘤组织[12]。此外,该次研究中,导航组患者术后KPS评分显著优于非导航组患者(P<0.05),这一结果与罗强等[13]的研究结果[术后观察组KPS评分(83.2l±6.217)分和对照组(76.49±4.638)分,较术前均明显提高,而且观察组明显高于对照组(P<0.05)]基本一致,提示神经导航引导手术过程中不仅能够解除颅内占位病变对脑组织功能的影响,而且导航组通过使用多模态神经导航技术辅助肿瘤切除,能够避免或尽可能减少对周围正常脑组织结构(尤其是运动和感觉传到束、语言功能区等[14])的损伤,也因此能够降低脑肿瘤切除手术对患者术后生活质量的影响。
尽管目前神经导航技术表现出卓越的临床效果,但漂移现象仍然是临床上无法忽视的问题,其发生多认为与手术过程中各种原因引起的脑组织相对位移有关,如脑脊液流失,肿瘤切除,囊液大量释放,脱水剂的使用,重力作用、颅内压力变化等[15]。该研究通过在术中导航前避免过度释放脑脊液,减少对正常脑组织及肿瘤的牵拉,避免使用脱水药物等方式尽可能降低漂移对导航精度的影响,术后结果显示导航组肿瘤全切率高于传统手术组。此外,随着神经导航结合其他技术手段的广泛应用,如术中磁共振[16-17],术中超声[18-19],电生理技术[20],术中唤醒[3]以及黄荧光染色技术[21-23]等,导航精度也得到了很大的提升。
综上所述,神经导航系统尽管不能完全取代外科医生的临床经验及专业知识,但其所展现的安全性、准确性及实用性却能成为神经外科医生(尤其是年轻医生)手术技能的极大补充,值得临床继续推广使用。
