米诺环素通过Wnt/β-Catenin通路对大鼠牙髓干细胞成骨分化的影响
2021-10-09杜帅侠姚秀翠
杜帅侠,姚秀翠,段 珂,王 静
牙周病是一种常见的口腔疾病,会引起成人失牙,临床上表现为牙龈出血、炎症、牙槽骨吸收及牙齿松动移位等,严重影响患者正常生活。近年来,越来越多的学者展开了基于干细胞的骨组织工程相关研究,使骨再生成为可能。牙髓干细胞(dental pulp stem cells, DPSCs)是一种间充质干细胞,来源丰富、易于取材并且使用无伦理争议,是骨组织工程的重要种子细胞[1-2]。Wnt/β-连环蛋白(Wnt/β-Catenin)信号通路是促进组织损伤修复和再生的重要通路之一,在DPSCs成骨分化和牙齿生长发育过程中起着重要的调控作用[3-4]。Wnt/β-Catenin信号通路激活后,会抑制糖原合成酶激酶-3β(glycogen synthase kinase-3β, GSK-3β)的磷酸激酶活性,拮抗β-Catenin的降解,使其大量聚集并进入细胞核激活下游靶基因,发挥生物学效应[5-6]。Mao等[7]研究表明,可通过调控GSK-3β/β-Catenin信号通路,在正畸过程中促进牙齿移动部位骨形成,该通路可作为潜在的临床牙科治疗靶点。米诺环素(minocycline, MINO)是一种广谱抗菌的四环素类抗生素,近年来研究者们发现它除了具有抗菌作用,还有抑制骨吸收、促进新骨形成的作用[8],但其作用机制尚未明确。据此,本研究拟采用不同剂量的米诺环素干预体外培养的大鼠牙髓干细胞(RDPSCs),观察并检测RDPSCs成骨分化各项指标以及Wnt/β-Catenin通路的变化,探讨米诺环素对RDPSCs成骨分化的作用及机制,以期为RDPSCs应用于牙周病治疗的临床研究提供一定科学指导。
1 材料与方法
1.1 主要试剂与仪器
RDPSCs购自上海ATCC细胞库;米诺环素购自默克化工技术(上海)有限公司;DMEM培养基和细胞培养板购自赛默飞世尔科技(中国)有限公司;二甲基亚砜(dimethyl sulfoxide, DMSO)和0.2%胰蛋白酶溶液购自武汉普诺赛生命科技有限公司;碱性磷酸酶(alkaline phosphatase, ALP)染色试剂盒、蛋白质免疫印迹(Western blot, WB)二抗购自上海碧云天生物技术公司;骨钙素试剂盒购自上海酶联生物科技有限公司;茜素红、蛋白提取试剂盒和蛋白浓度测定试剂盒购自北京索莱宝科技有限公司;RNA提取试剂盒购自南京诺唯赞生物科技股份有限公司;反转录试剂盒购自北京百奥莱博科技有限公司;实时荧光定量PCR检测试剂盒购自北京鼎国昌盛生物技术有限责任公司;ALP检测试剂盒、β-Catenin抗体、GSK-3β抗体和Runx2抗体购自艾博抗(上海)贸易有限公司。
生物安全柜购自赛默飞世尔科技(中国)有限公司;CO2培养箱购自美国Forma公司;台式高速冷冻离心机购自德国Eppendorf公司;Facscalibur流式细胞仪购自美国BD公司;垂直板电泳槽、蛋白转膜仪、凝胶成像系统、酶标仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 实验分组 将RDPSCs复苏培养24 h后随机分为5组,每组6个平行对照,A组:对照组(不加米诺环素);B组:0.1 mg/L米诺环素组;C组:1.0 mg/L米诺环素组;D组:10.0 mg/L米诺环素组;E组:100.0 mg/L米诺环素组。各组均加入成骨分化诱导液(每100 mL 10% FBS DMEM培养基中含10 mmol/L β-甘油磷酸钠、0.2 mmol/L抗坏血酸和100 nmol/L地塞米松)。
1.2.2 CCK-8法检测细胞增殖率 将RDPSCs细胞以1×104个/mL的密度接种于96孔板中,细胞贴壁后按照1.2.1中的分组进行处理。分别在细胞培养1、7、14 d时,加入10 μL的CCK-8溶液,培养箱中孵育1 h,使用酶标仪检测每孔450 nm处OD值。细胞增殖率=(实验组-空白组)÷ (对照组-空白组)×100%。当培养至7 d时,细胞增殖率最接近50%,选取7 d作为后续实验培养时间点。
1.2.3 测定细胞碱性磷酸酶(ALP)活性和骨钙蛋白(OCN)含量 将RDPSCs细胞配制为2×105个/mL密度的单细胞悬液,2 mL/孔接种于6孔板中培养至贴壁,按照1.2.1中的分组进行处理。培养箱中培养7 d,每3 d换液1次。弃去培养基后用胰蛋白酶消化细胞,终止并4 ℃、1 500 r/min离心10 min,无菌PBS洗涤细胞2次,收集细胞加入细胞裂解液,随后按照ALP检测试剂盒或骨钙素试剂盒说明书操作,于405 nm或450 nm处测OD值,计算ALP或OCN水平。
1.2.4 细胞ALP染色 取对数生长期的RDPSCs细胞,以5×104个/mL的密度接种于24孔板中,待细胞贴壁后,按照1.2.1中的分组进行处理,37 ℃、5% CO2条件下培养7 d,每3 d更换1次培养基。弃去培养基并用磷酸盐缓冲液(phosphate buffered saline, PBS)洗涤细胞3次,甲醛固定细胞后再次PBS洗涤,加入200 μL/孔的ALP染液,室温避光显色20 min,弃去染液后用PBS洗涤,晾干后于显微镜下观察结果并记录。
1.2.5 茜素红S染色检测细胞钙盐沉积量 将RDPSCs细胞以5×104个/mL的密度接种于24孔板中,培养至贴壁后按照1.2.1中的分组进行处理。37 ℃、5% CO2条件下培养7 d,每3 d更换1次培养基。弃去培养基,PBS洗涤细胞,固定细胞后进行茜素红S染色,PBS洗涤,显微镜下观察并拍照,随后用20%醋酸溶解,检测每孔405 nm处OD值。
1.2.6 qRT-PCR检测ALP和OCN mRNA表达情况 根据RNA提取试剂盒说明书提取各组细胞中的总RNA,以其为模板反转录成cDNA后进行qRT-PCR检测ALP和OCN mRNA表达情况,引物序列如表1所示。

表1 引物序列
1.2.7 WB检测GSK-3β、β-Catenin和Runx2蛋白表达水平 在6孔板中接种2 mL密度为2×105个/mL的RDPSCs细胞,待贴壁后按照1.2.1中的分组进行处理。培养7 d后弃去培养基,加入胰蛋白酶消化细胞,PBS终止后低温1 500 r/min离心10 min,洗涤2次后收集细胞,加入细胞裂解液,按照试剂盒说明书提取细胞总蛋白并根据BCA试剂盒测定蛋白总浓度。后取50 μg进行SDS-PAGE电泳,电泳结束取出凝胶,使用电转仪将蛋白转至PVDF膜,用5%脱脂奶室温封闭1 h,加入稀释(1∶1 000)的对应一抗,4 ℃孵育过夜,弃去一抗溶液并洗涤PVDF膜,加入稀释(1∶2 000)的二抗溶液,室温摇床1 h,洗膜3次,ECL显色并用凝胶成像系统拍照。
1.3 统计学方法
各组实验数据以平均数±标准差表示,采用SPSS 20.0软件对数据进行统计学分析,多组间比较采用单因素方差分析,两组间比较采用SNK-q检验。F表示整个拟合方程的显著性,F越大表示越显著,拟合程度也就越好;P反映对照组与实验组差异大小,以P<0.05表示差异有统计学意义。
2 结 果
2.1 RDPSCs细胞形态学观察
如图1所示:细胞形态以纤维状为主,排列紧密且具有典型的旋涡状特点,符合RDPSCs特点。
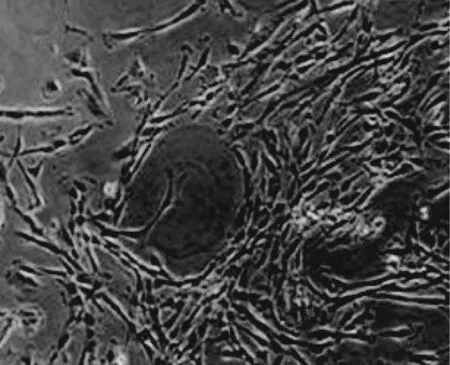
图1 RDPSCs细胞形态学光镜下观察( ×200)
2.2 米诺环素对RDPSCs细胞增殖率的影响
结果显示,与对照组相比,米诺环素各组细胞增殖率显著升高(P<0.05),14 d时,10.0 mg/L组相比0.1 mg/L组、100 mg/L组相均比1.0 mg/L组有所下降,如表2、图2所示。
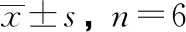
表2 米诺环素对RDPSCs细胞增殖率的影响
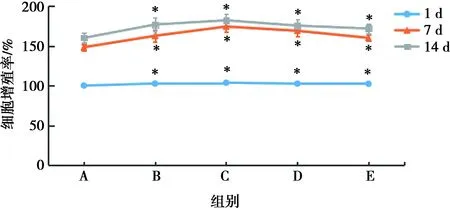
*:与A组相比,P<0.05
2.3 米诺环素对RDPSCs细胞ALP活性和OCN含量的影响
由结果可知,与对照组相比,0.1、1.0 mg/L米诺环素组ALP活性和OCN含量显著升高(P<0.05),10.0、100.0 mg/L米诺环素组ALP活性和OCN含量显著降低(P<0.05),如表3,图3、4所示。

*:与A组比较,P<0.05
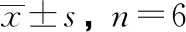
表3 米诺环素对RDPSCs细胞ALP活性和OCN含量的影响
2.4 米诺环素对RDPSCs细胞钙盐沉积的影响
结果显示,与对照组相比,0.1、1.0 mg/L米诺环素组细胞钙盐沉积量明显上升(P<0.05),10.0、100.0 mg/L米诺环素组细胞钙盐沉积量明显下降(P<0.05),如表4,图5、6所示。

比例尺:200 μm
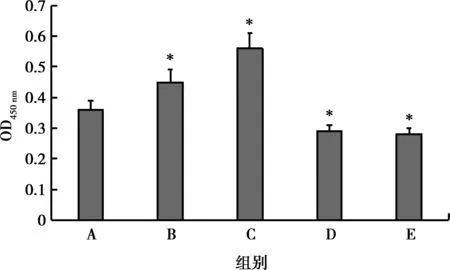
*:与A组比较,P<0.05

比例尺:500 μm
表4 米诺环素对RDPSCs细胞钙盐沉积的影响
2.5 米诺环素对RDPSCs细胞ALP和OCN mRNA表达的影响
由结果可知,与对照组相比,0.1、1.0 mg/L米诺环素组ALP和OCN mRNA表达水平显著升高(P<0.05),10.0、100.0 mg/L米诺环素组ALP和OCN表达显著降低(P<0.05),如表5、图7所示。
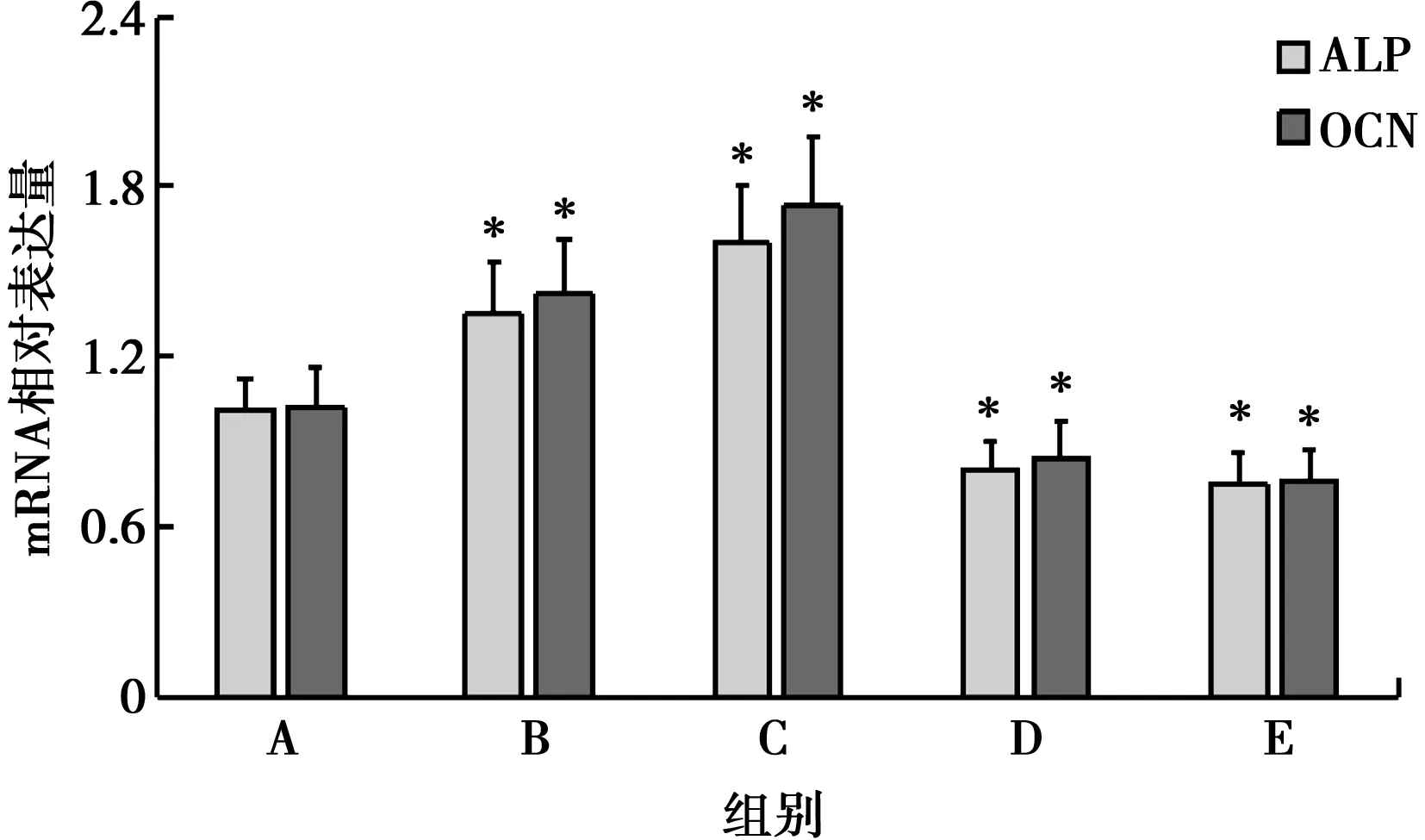
*:与A组相比,P<0.05

表5 米诺环素对RDPSCs细胞ALP和OCN mRNA表达的影响
2.6 米诺环素对RDPSCs细胞GSK-3β、β-Catenin和Runx2蛋白表达的影响
由结果可知,与对照组相比,0.1、1.0 mg/L米诺环素组GSK-3β蛋白表达量显著降低,β-Catenin和Runx2蛋白表达量显著升高(P<0.05),10.0、100.0 mg/L米诺环素组GSK-3β蛋白表达量显著升高,β-Catenin和Runx2蛋白表达量显著降低(P<0.05),如表6,图8、9所示。

*:与A组相比,P<0.05
表6 米诺环素对RDPSCs细胞GSK-3β、β-Catenin和Runx2蛋白表达的影响
3 讨 论
牙周病可导致牙槽骨的病理性吸收,造成成人失牙。DPSCs增殖活性高,具有多向分化潜力,目前关于它的组织工程应用研究主要集中在修复受损牙本质、成骨分化和成神经细胞分化等方面[9-13], 为临床口腔疾病的治疗带来希望。米诺环素是一种半合成的四环素类药物,研究表明它能够有效抑制牙周致病菌繁殖,消除细菌感染,抑制破骨细胞活性并减少骨吸收,还可以促进牙周组织再生、新骨形成[14]。
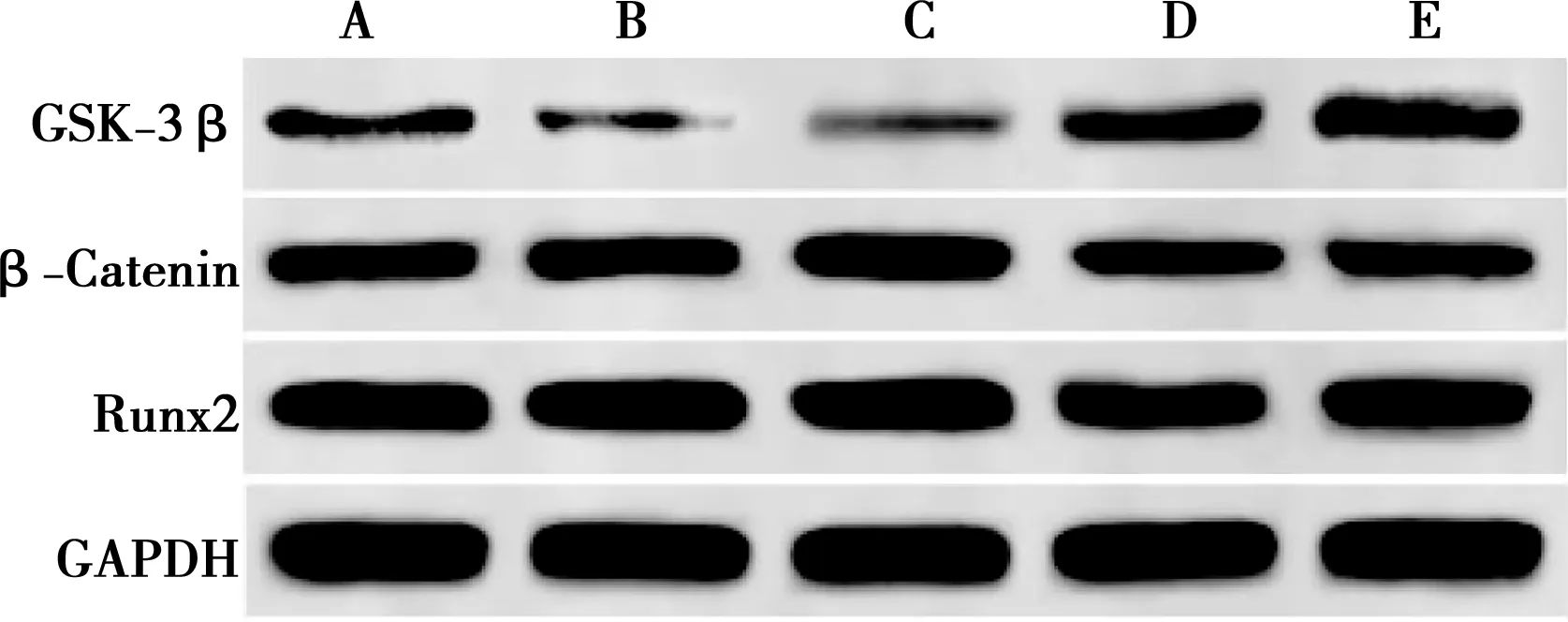
图9 米诺环素对RDPSCs细胞GSK-3β、β-Catenin和Runx2蛋白表达的影响
Tabatabaei等[15]发现,DPSCs可在体外被诱导分化为成骨细胞,表达典型的成骨细胞标志物ALP和OCN,产生矿化基质。有研究发现,米诺环素作用于成骨细胞后,可促进细胞ALP和OCN表达,促进细胞增殖、成骨分化和矿化[16]。米诺环素还可促进损伤脊髓处骨髓间充质干细胞的募集,并且促进其体外增殖[17]。本研究结果显示,与对照组相比,0.1、1.0 mg/L米诺环素组牙髓干细胞的增殖率、骨形成指标ALP和OCN含量、细胞钙盐沉积量均显著升高,10.0、100.0 mg/L米诺环素组细胞增殖率较对照组显著升高,骨形成指标ALP和OCN含量及二者表达水平、细胞钙盐沉积量均显著降低,提示低浓度的米诺环素对牙髓干细胞成骨分化起促进作用,高浓度则起抑制作用,提示临床用药时应注意把握剂量。
Wnt/β-Catenin信号通路参与调节多个生物过程,当通路未激活时,细胞质中的β-Catenin、GSK-3β和轴抑制蛋白(axis inhibitor, Axin)、腺瘤样息肉蛋白(adenoatous polyposis coli, APC)结合形成四聚体,使得GSK-3β能够持续磷酸化β-Catenin,磷酸化的β-Catenin在蛋白酶的作用下发生降解,Wnt信号通路就此被抑制;当Wnt信号通路激活时,会产生传导信号抑制GSK-3β、Axin和APC的活性,四聚体发生解离从而释放β-Catenin,使得细胞质中不断积累β-Catenin,随后未降解的β-Catenin进入细胞核,与转录因子结合,启动Wnt信号通路下游靶基因Runt相关转录因子2(recombinant Runt related transcription factor 2, Runx2)[18-19]。Luo等[20]研究报道,激活Wnt/β-Catenin通路可抑制骨髓干细胞成脂分化,促进其成骨分化。Jiang等[21]研究发现,在体外培养的人牙周膜干细胞中加入雌激素,可激活Wnt/β-Catenin信号通路从而促进细胞的成骨分化。本研究结果显示,与不加米诺环素的对照组相比,0.1、1.0 mg/L米诺环素组牙髓干细胞β-Catenin和Runx2蛋白水平显著升高,GSK-3β蛋白水平显著降低,而10.0、100.0 mg/L米诺环素组牙髓干细胞β-Catenin和Runx2蛋白水平显著降低,GSK-3β蛋白水平显著升高,表明低浓度的米诺环素可激活Wnt/β-Catenin通路,高浓度则可抑制Wnt/β-Catenin通路活化,与上述不同浓度米诺环素对RDPSCs成骨分化的影响一致。
综上所述,米诺环素可通过调控Wnt/β-Catenin信号通路影响RDPSCs成骨分化,低浓度米诺环素促进RDPSCs成骨分化,高浓度米诺环素则抑制RDPSCs成骨分化。本研究仅初步探讨了米诺环素对RDPSCs成骨分化以及Wnt/β-Catenin信号通路的影响,RDPSCs的成骨分化还涉及Wnt信号通路与许多其他通路的共同协作,明确其中机制还需更深一步的研究。
