蛋氨酸在KCl溶液中的解离常数与活度系数
2021-10-04陈志荣童云袁慎峰尹红
陈志荣,童云,袁慎峰,尹红
(浙江大学化学工程与生物工程学院,浙江杭州 310027)
引言
蛋氨酸是动物体必需氨基酸,不能在动物体内合成,只能从外界环境中获取[1]。蛋氨酸还是另一种含硫蛋白质氨基酸半胱氨酸的前体。它不仅参与动物体内蛋白质、胱氨酸、肾上腺素、胆碱和肌酸的合成,还是重要的甲基供体,参与一系列氨基酸代谢相关反应,对维持动物体正常生理活动有重要意义[2-3],因此蛋氨酸广泛用于饲料[4-5]、医药[6-7]和日用品[8]等行业。甲硫醇与丙烯醛加成后经Strecker反应可得到蛋氨酸[9-10]。国内外大部分生产厂商采用海因法生产蛋氨酸[11-12]。海因水解需要的碱常为NaOH、KOH、Ca(OH)2、K2CO3等,水解后采用H2SO4、HCl、CO2将水解得到的蛋氨酸盐酸化后得到蛋氨酸。研究蛋氨酸在NaCl、KCl、Na2SO4等溶液中的性质对指导蛋氨酸生产具有重要意义。同时,研究蛋氨酸与电解质之间的相互作用也可为生理溶液研究提供参考。
迄今为止,研究者对蛋氨酸的热力学性质进行了一定研究。Niu 等[13]对蛋氨酸的标准燃烧焓、比热容进行了研究;Sharma 等[14]研究了5、25 和45℃下0.25~6.0 mol/kg 的NaCl 水溶液中蛋氨酸的解离常数;Lytkin 等[15]研究了蛋氨酸在KOH 水溶液中的溶解焓;Soto-Campos 等[16]提供了25℃下NaCl 水溶液中蛋氨酸的活度系数。目前对KCl 水溶液中的蛋氨酸性质的研究较少,尚未有针对蛋氨酸在KCl 水溶液中解离常数和活度系数的报道。因此本文研究KCl 水溶液中蛋氨酸的解离常数与活度系数,以期丰富电解质水溶液中蛋氨酸的热力学性质数据,同时为KOH 溶液水解海因法生产蛋氨酸提供参考。
1 实验材料和方法
1.1 理论基础
1.1.1 解离常数 蛋氨酸的解离过程[14]可以写作:

分步解离可由式(2)和式(3)表示,式(1)中蛋氨酸的不同形式用H2B+、HB和B-表示:

解离平衡常数的测定方法主要有电导法[17]、电位滴定法[18-19]和高效液相色谱法[20-21]等。本文研究体系涉及电解质溶液,且蛋氨酸为两性离子的特点选择改变pH 法[22]测定解离常数,即保证蛋氨酸总浓度不变,滴加酸或碱改变pH,进而通过计算得到解离常数。这种方法的实验装置易得,操作简单,但为达到较高的准确性需要足量的实验数据作为支撑,测量耗时较长。
改变pH法具体理论基础如下:
在碱性条件下,pH 大于等电点时,cH2B+很小,可以忽略不计,则由质量守恒可得:

由电荷守恒可得:
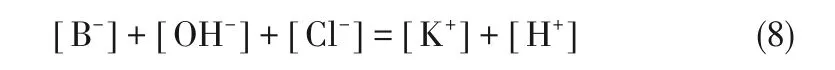
此时

实验测得pH、蛋氨酸和KCl 浓度后就可通过回归求得解离常数。
在酸性条件下,pH 小于等电点时,cB-很小,可以忽略不计,则由质量守恒可得:
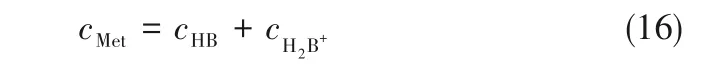
由电荷守恒可得:
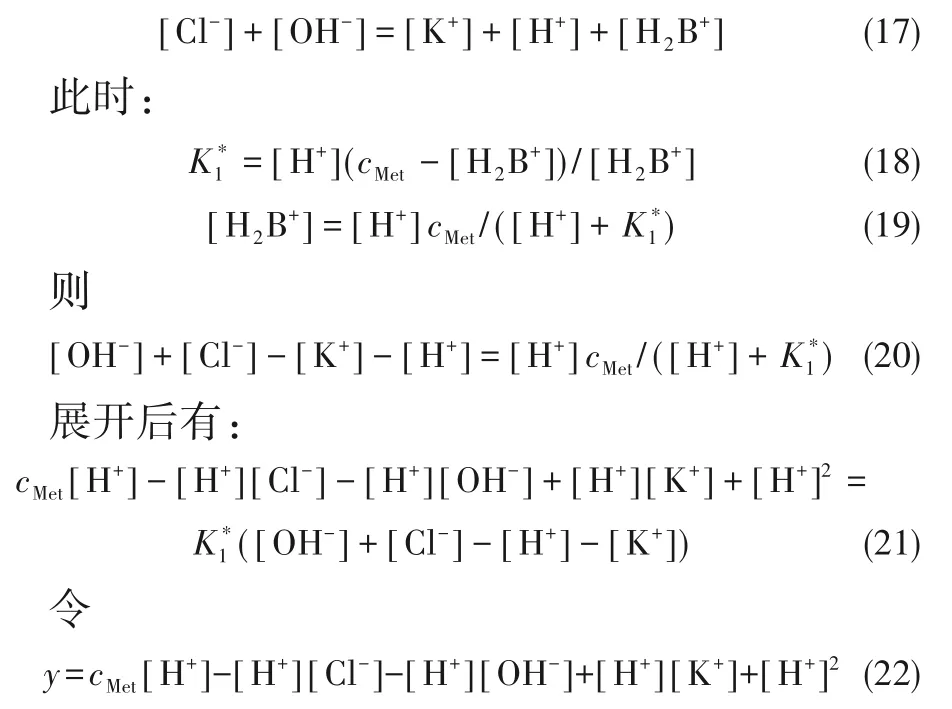
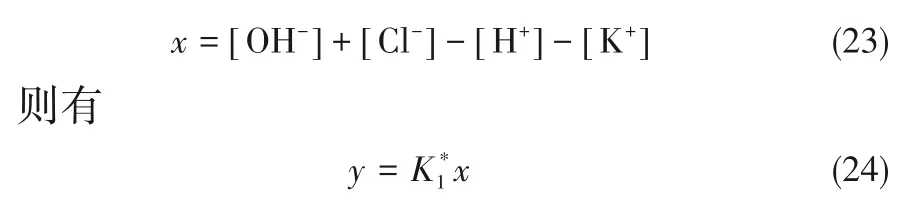
实验测得pH、蛋氨酸和KCl 浓度已知时就可通过回归求得解离常数。
1.1.2 活度系数 活度系数可运用电动势法、通过测量阴阳离子选择电极之间的电势差得到[23]。运用参比电极构建电池(1):

其中,ISE 表示离子电极;DJ 表示参比电极;ms为电解质质量浓度。当1∶1型电解质质量浓度为ms时,该电池的能斯特方程可以写作:
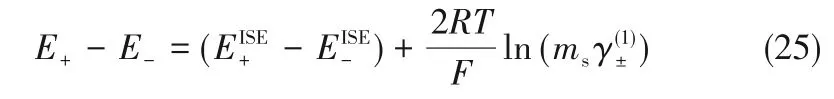
式中,E+和E-代表离子选择电极的电势值;和代表与离子选择电极自身相关的值,它们之差为标准电动势;表示平均离子活度系数;R是气体常数;T为热力学温度;F代表法拉第常数;下角标表示电池的正负极;上角标(1)表示电池中只包含水和电解质。只有当参比电极相同时,式(25)才成立。它可以写成更加通用的形式:

当向电池(1)中加入氨基酸时,由于氨基酸与溶液中离子的作用,电势会随之改变,这是因为氨基酸分子和溶液中离子的相互作用造成了电解质平均离子活度系数的改变。新电池(2)可以写作:
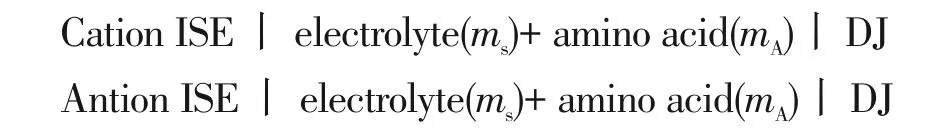
可以得到不同的电解质质量浓度下、氨基酸质量浓度为mA的溶液中有:
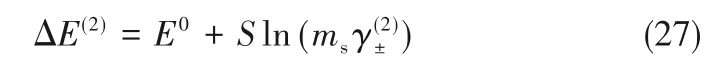
式中,上角标(2)表示溶液中含有氨基酸。假设电池(1)和(2)使用的离子选择电极和参比电极相同即S和E0值相同,由式(26)、式(27)可得:
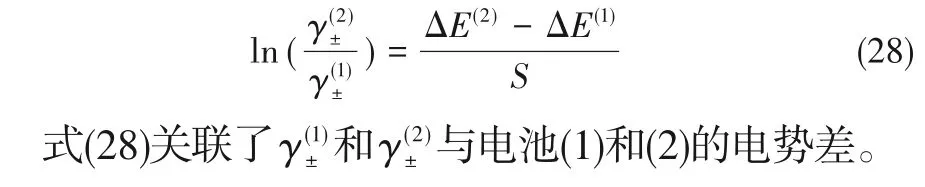
1.2 材料
DL-蛋氨酸(上海笛柏生物科技有限公司,>99%);KCl(国药Sinopharm,GR,>99.8%),KCl 使用前于110℃干燥48 h;KOH(麦克林,GR,>95%);盐酸(国药Sinopharm);去离子水。
1.3 实验仪器
微量滴定管(天津玻璃仪器厂,A 级);pH 计(上海雷磁,PHSJ-4F,±0.1 mV);pH 电极(上海雷磁,E-301-D);钾离子选择电极(上海雷磁,PK-1-01);氯离子选择电极(上海雷磁,PCL-1-01);参比电极(上海雷磁,217-01);恒温水浴(予 华DFY-5/40,±0.1℃)。
活度系数实验装置如图1所示,参比电极、钾离子电极与氯离子电极同时插在待测溶液中,通过切换pH计插口实现不同离子电极的数据测量。
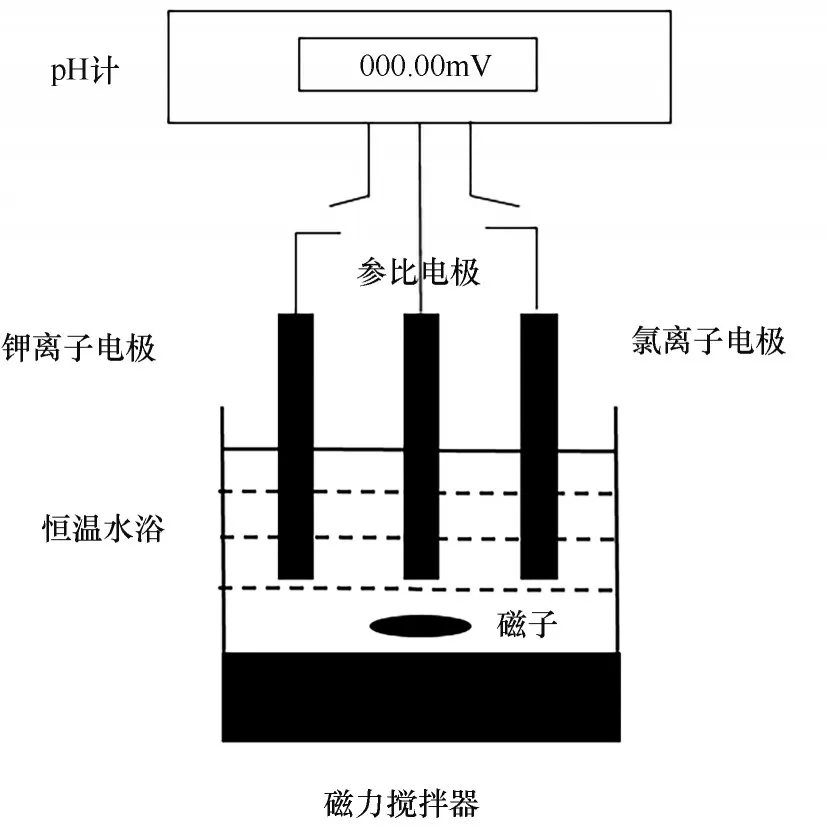
图1 活度系数测量装置Fig.1 Activity coefficient measuring system
1.4 实验方法
溶液配制均以质量浓度计算。实验溶液均盛装于夹套烧杯中,采用磁力搅拌消除浓度梯度,采用超级恒温水浴控温(温度波动范围为±0.1℃)。
1.4.1 解离常数 蛋氨酸溶液浓度为(5~10)×10-3mol/L,盐酸浓度约为10-2mol/L,KOH 浓度约为10-2mol/L。实验温度为25、30 和35℃,KCl 浓度范围为0.25~4.0 mol/L。盐酸和KOH溶液在每次实验前均需标定。实验前用标准缓冲溶液标定pH计及电极,每个实验条件下的实验重复三次,体积读数误差为±0.02 cm3,pH读数误差为±0.001。
配制一定浓度的KCl和蛋氨酸溶液于夹套烧杯中,外接恒温水浴控制温度,开启磁力搅拌,当温度达到设定温度并稳定10 min 后用微量滴定管缓慢滴加盐酸或KOH 溶液,待pH 计示数稳定、变化小于0.001时记录pH读数和滴加酸碱的体积。
1.4.2 活度系数 蛋氨酸溶液浓度为0.025~0.200 mol/L,KCl 浓度为0.25~4.0 mol/L。实验温度为25℃。每个实验条件下的实验重复三次,电势读数误差为±0.1 mV。
测量正负离子选择电极相对于参比电极的电势可求得电势差。为避免参比电极自身结构的干扰,在测量阴极和阳极电势时采用同一参比电极,且几乎同时完成电势值测量。预实验中由于蛋氨酸堆密度较小,加入溶液中时会漂在溶液表面且黏附在杯壁上,未进入溶液部分会造成误差,因此本实验采用蛋氨酸浓度固定、向其中加入KCl 的方法进行。具体实验过程为:测量电池(1)的电势,确定电极的S和E0值。配制一定浓度的蛋氨酸溶液,分次加入KCl 固体,待pH 计示数稳定、变化小于0.1 mV时记录电势示数。
2 实验结果与讨论
2.1 解离常数
蛋氨酸在KCl 溶液中的解离常数如表1 所示,其中质量浓度一栏数据为实验测得数据,根据KCl溶液的相关性质和质量浓度数据计算得到体积浓度一栏数据[25]。从表1 中结果可以看出,温度相同时和均随离子强度增大而增大,解离程度降低;离子强度相同时,和均随温度升高而减小,解离程度升高。
解离常数与离子强度关系如图2所示。
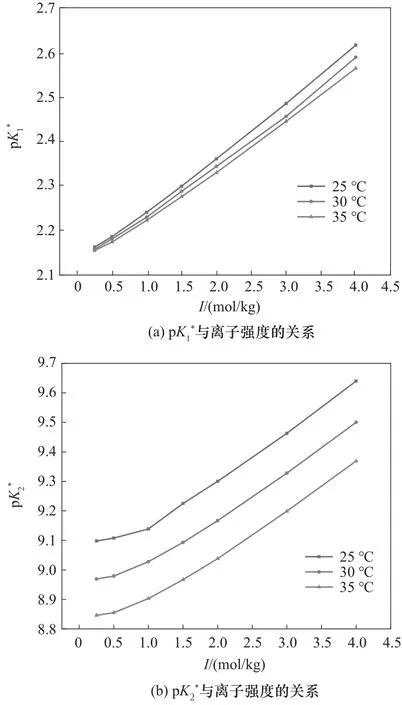
图2 KCl溶液中蛋氨酸解离常数与离子强度的关系Fig.2 (molar scale)for methionine in KCl solutions as a function of ionic strength
表1 蛋氨酸在KCl水溶液中的解离常数Table 1 (±S.D.)for methionine in KCl solutions at different temperatures
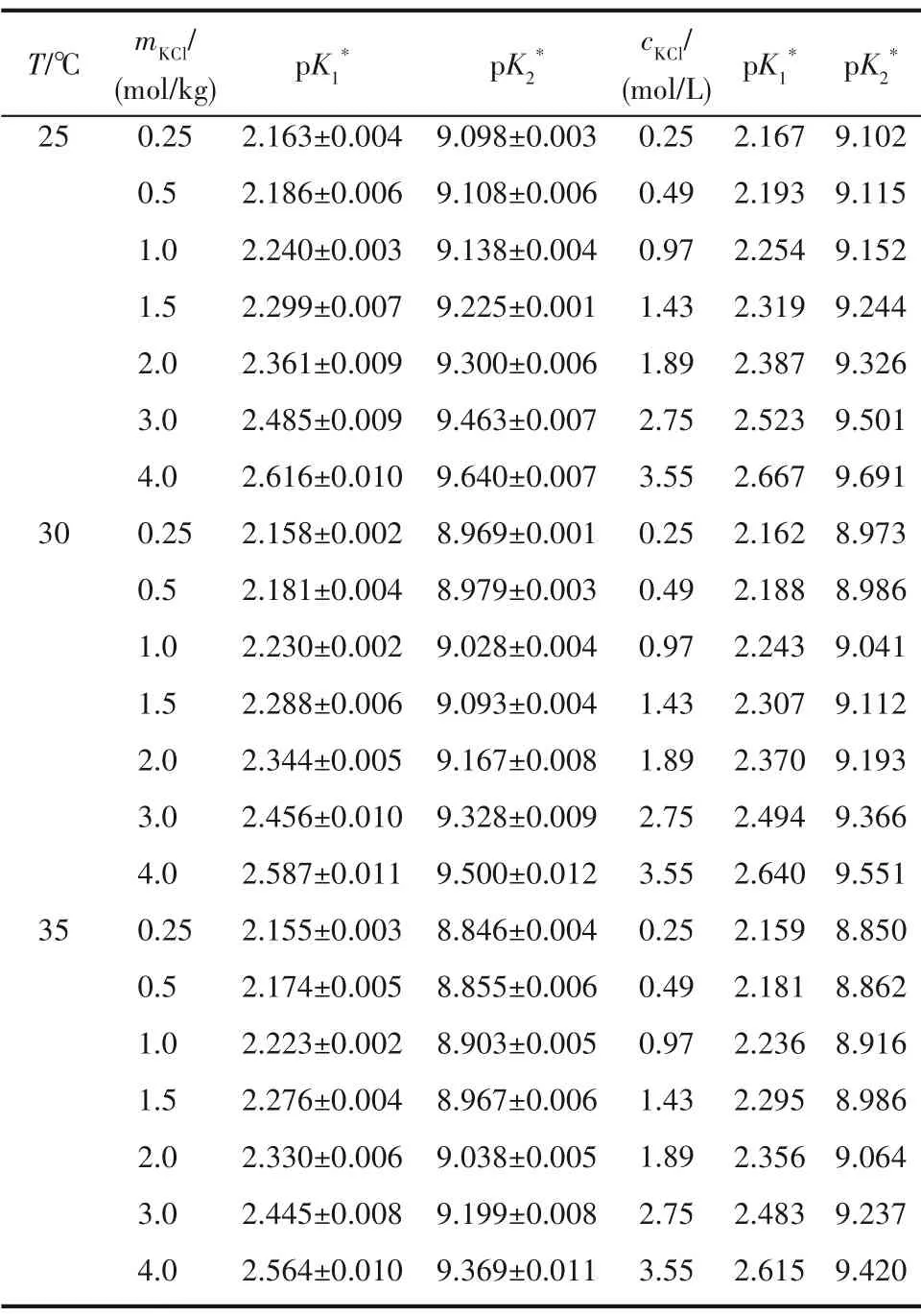
表1 蛋氨酸在KCl水溶液中的解离常数Table 1 (±S.D.)for methionine in KCl solutions at different temperatures

表2 蛋氨酸在不同离子强度下的质子化焓Table 2 Enthalpy of dissolution at different ionic strength
将25℃下蛋氨酸在NaCl 溶液和KNO3溶液中的解离常数文献报道值[14]与本文实验值进行对比,结果如图3 所示。可以发现,蛋氨酸在三种盐溶液中的解离常数随离子强度的变化一致。三种盐溶液中的数值较接近;NaCl 溶液和KCl 溶液中的较相近,二者与KNO3溶液中的解离常数相差较大。离子强度相同时,蛋氨酸在KNO3、NaCl 和KCl 溶液中解离常数依次减小,这可能与溶液电解质离子有关。离子水化即离子与水化合、周围形成一定水分子层。离子水化作用越强,离子水合半径越大,与蛋氨酸相互作用强度越低,蛋氨酸越大。K+、Na+、Cl-和的离子水合半径分别为0.331、0.358、0.332 和0.335 nm[26]。阳离子(K+)相同时,因为水合离子半径大于Cl-水合离子半径,所以蛋氨酸在KNO3溶液中的较大;阴离子(Cl-)相同时,因为Na+水合离子半径大于K+水合离子半径,所以蛋氨酸在NaCl 溶液中的较大。与阳离子相比,阴离子对pK1*影响更大。

图3 蛋氨酸在25℃下的KCl、NaCl和KNO3水溶液中解离常数的对比Fig.3 Comparison of (molar scale)for methionine in KCl,NaCl and KNO3 solutions(T=25℃)
2.2 活度系数
电池(1)的实验测定结果与文献[24]中KCl 的值与ln(ms)计算值如表3所示,根据表中数据可以拟合得到电池(1)的E0=238.2 mV、S=52.72,后者接近298.15 K 的理论值51.28,拟合R2=1.000,说明钾离子选择电极和氯离子选择电极对具有较好的能斯特效应,可以用于后续测量。

表3 电池(1)的电势值Table 3 Values of electrochemical cell(1)
将电池(2)电动势测定值与E0和S值代入式(28)可得到KCl 在蛋氨酸水溶液中的活度系数,结果列于表4。
表4 中的活度系数之比可通过式(29)与KCl 和蛋氨酸浓度关联:

蛋氨酸活度系数可用式(30)与KCl 平均活度系数关联:
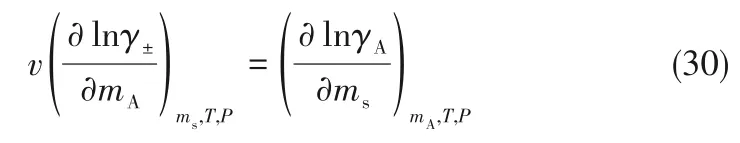
对于KCl,v=2。联立式(29)与式(30),相同蛋氨酸浓度下蛋氨酸在KCl 溶液中的活度系数与纯水溶液中的活度系数的比值可用式(31)表示:
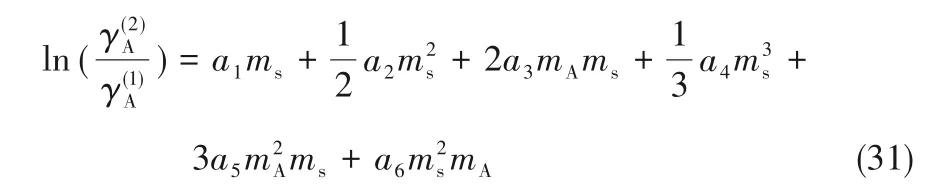
利用最小二乘法可由表4 中的数据求得式(29)中各参数值如表5所示,标准误差为6.5×10-4。
表4 KCl在KCl-蛋氨酸水溶液和KCl溶液中的平均活度系数与的比值Table 4 Ratio of mean ionic activity coefficient of KCl in methionine aqueous solution to that in water at different molalities of KCl and methionine
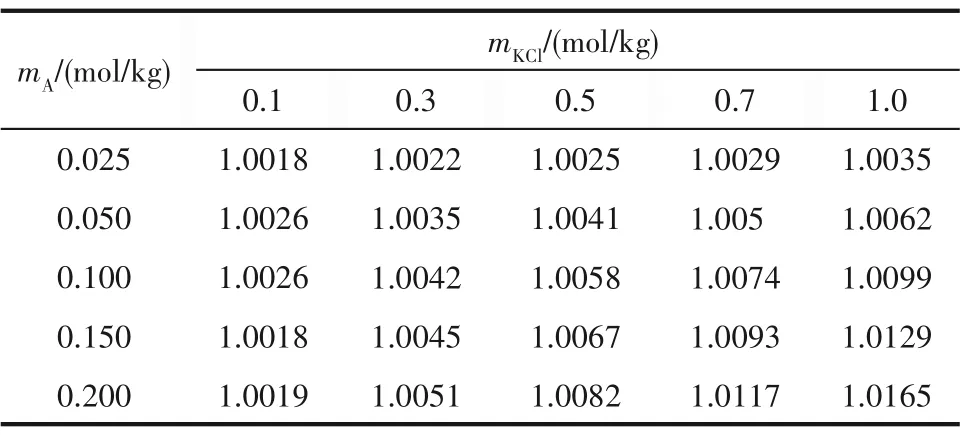
表4 KCl在KCl-蛋氨酸水溶液和KCl溶液中的平均活度系数与的比值Table 4 Ratio of mean ionic activity coefficient of KCl in methionine aqueous solution to that in water at different molalities of KCl and methionine
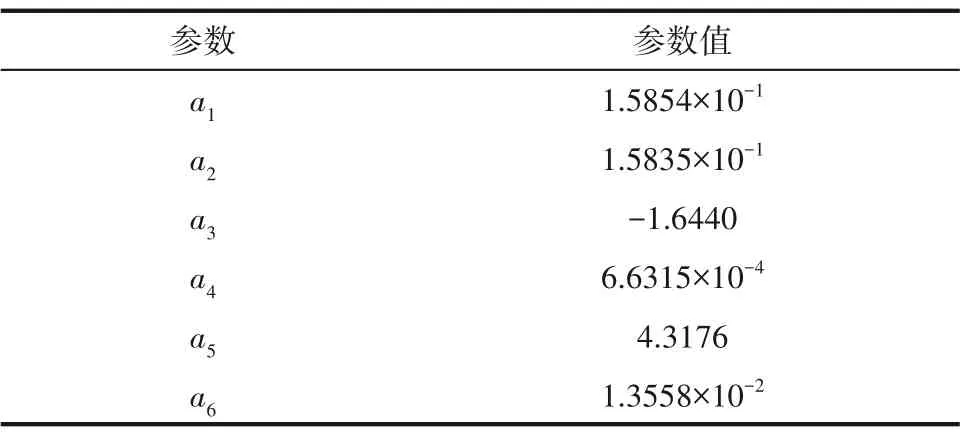
表5 式(29)参数值Table 5 Coefficients of Eq.(29)
表6 蛋氨酸在KCl-蛋氨酸水溶液与蛋氨酸水溶液中活度系数和的比值Table 6 Ratio of mean ionic activity coefficients of methionine in the presence of KCl aqueous solution to that in water at different molalities of KCl and methionine
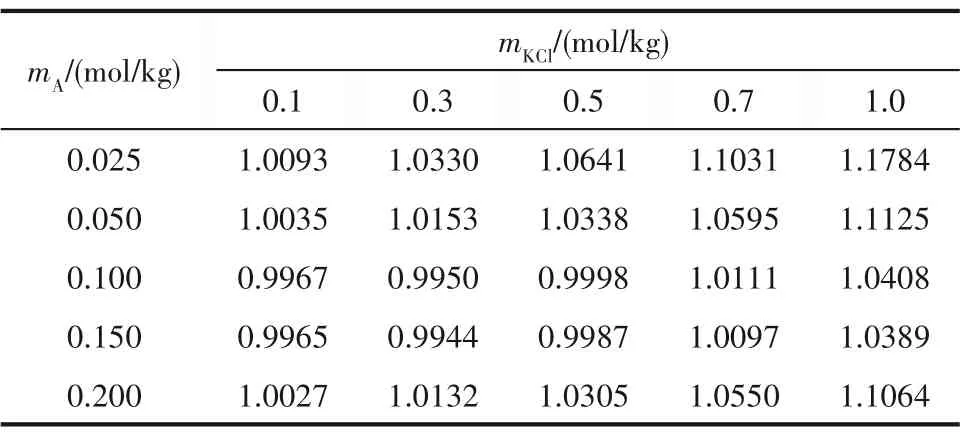
表6 蛋氨酸在KCl-蛋氨酸水溶液与蛋氨酸水溶液中活度系数和的比值Table 6 Ratio of mean ionic activity coefficients of methionine in the presence of KCl aqueous solution to that in water at different molalities of KCl and methionine
从图4 可以看到,蛋氨酸浓度为0.100 和0.150 mol/kg 时,比值接近,都随KCl 浓度先略微下降,在KCl 浓度为0.3 mol/kg 时达到最小值,后持续增加。其余蛋氨酸浓度下的均随KCl浓度增加而增加。
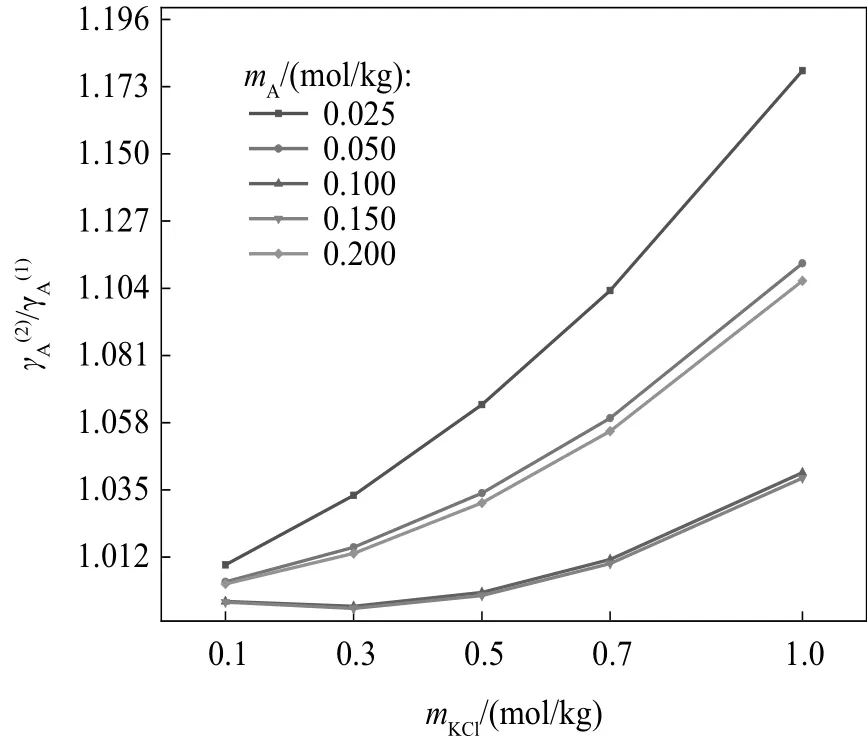
图4 蛋氨酸浓度对/的影响Fig.4 Effect of methionine molality on /
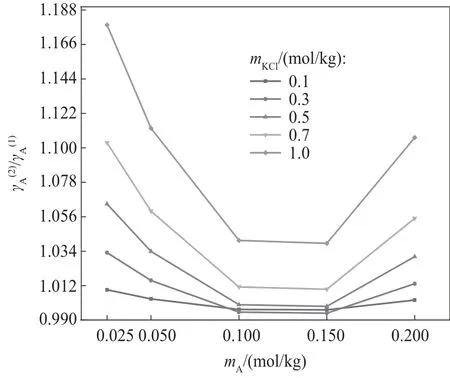
图5 KCl浓度对/的影响Fig.5 Effect of KCl molality on /
蛋氨酸浓度和KCl对蛋氨酸活度系数的影响可能是离子-偶极作用、偶极-偶极作用和离子对复合体共同作用的结果。蛋氨酸的氨基和羧基具有大偶极矩[27],这种大偶极矩使得蛋氨酸分子之间和蛋氨酸与其他偶极分子(水分子)之间的偶极-偶极作用增大。带电荷的氨基和羧基也会在蛋氨酸分子周围形成静电场,与溶液中其余带电荷的离子发生离子-偶极作用。如解离常数部分所述,存在于水溶液中的KCl 周围会有一定的水分子层,这会影响水分子的结构,进而影响水分子和蛋氨酸之间的偶极-偶极作用。
蛋氨酸分子还会和溶液中离子形成离子对复合体(物理键)[16,28-29]。离子对复合体的形成中和了蛋氨酸氨基和羧基上的电荷,降低了蛋氨酸分子之间的偶极作用和蛋氨酸分子与离子之间的离子-偶极作用。同时,离子-偶极作用减小使得主要集中于离子、水分子和氨基酸的非极性烃链之间的相互作用更加明显[30]。
2.3 拟合
描述物质活度系数和解离常数之间联系的模型大多基于德拜-休克尔理论(Debye-Huckel Theory),由此衍生的经典的德拜-休克尔模型(DH 模型)解释了静电作用和远程相互作用对物质热力学性质的影响。但对于高浓度溶液需要考虑非静电作用和近距离相互作用的影响,因此一些研究者通过添加DH 模型参数展开研究,如Pitzer模型[31]。DH模型形式较为简单,而Pitzer 模型涉及参数相对较多,形式也较为复杂。下面采用以上两种模型对前文得到的解离常数和活度系数进行拟合研究。
2.3.1 DH 模型 经典的DH 模型在25℃下可用式(32)表示[32]:

解离常数数值和离子强度代入式(32)后得到的Ai和-lg数值列于表7。

表7 DH模型参数Table 7 Parameters of DH model
将表7无限稀释溶液中蛋氨酸解离常数与蛋氨酸在25℃纯水中的解离常数pK1=2.28 和pK2=9.21[33]对比后发现它们的数值相差较大。这可能是因为本文KCl 最低浓度为0.25 mol/kg,距离无限稀释溶液条件较远,文献[32]报道解离常数在低浓度范围中的变化可能很大,可能在较小范围内随电解质浓度增大先减小后增大,故该模型可能无法准确预测无限稀释溶液中的情况,所涉及的参数可靠性不佳。
2.3.2 Pitzer 模型 蛋氨酸在水中的解离平衡常数Ki与本实验测得的在KCl溶液中的解离平衡常数K *i之间的关系可用下式表示:
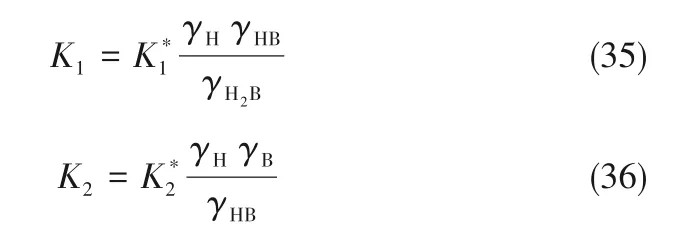
其中,γi是组分i的活度系数。利用实验测得和粒子相互作用模型,可以求得Ki和H2B+与HB 的活度系数。Pitzer 模型可用于研究溶液中离子强度和温度对各物质相互作用的影响[34],对电解质溶液中物质活度系数的计算较准确。
在低蛋氨酸浓度下,H+、H2B+、HB、B-在KCl水溶液中的活度系数可用Pitzer 方程按照Millero 和Pierrot的形式[35]表述:

AΦ可由文献[36]计算得到,U和N由下列公式[37]给出:

对于KCl,等量质量浓度D和离子强度I的值均等于其摩尔质量浓度值[35]。1-1和1-2型电解质MX(M=K或H)的第二维里系数和第三维里系数可用下式表示:

γHB的值对于确定γH2B和γB的值非常关键,也可以在全浓度和全温度范围内把它赋值为1.0。因为γHB的值在盐溶液中为一定值[16],所以可用式(44)求得。25℃下HB 在KCl溶液中的γHB值已在本文活度系数部分测得,利用该数据和式(44)拟合得到λHB-K=0.0422,ξHB-K-Cl=0.0399。
将式(37)~式(39)代入式(47)与式(48),可以得到:
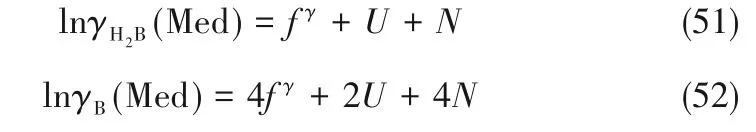
将式(44)和式(45)代入式(49)和式(50)得:

其中,m为KCl 的质量浓度,F1指代与离子相关的量:
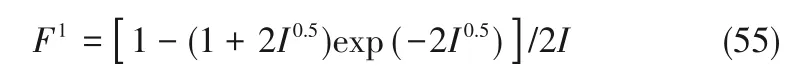
和Ci是K+和Cl-与蛋氨酸各形式之间的Pitzer参数。
Yi的值可以由式(49)和式(50)计算得到,将其代入式(53)和式(54)后拟合得到Pitzer模型参数值列于表8。
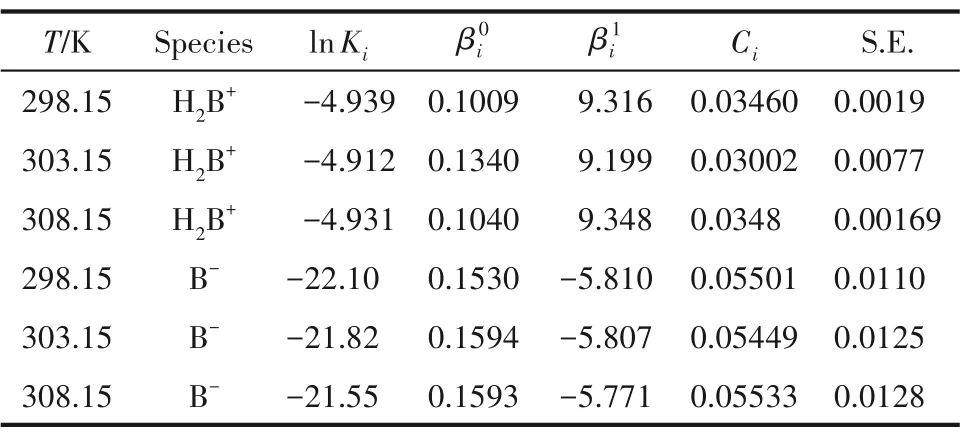
表8 不同温度下KCl水溶液中蛋氨酸各形式的Pitzer模型参数Table 8 Pitzer coefficients for methionine species in KCl media at different temperatures
Ki和Pizer 模型参数只与温度相关,根据表8 可给出实验温度范围内的表达式:

为方便计算,25、30 和35℃的lnγHB均取25℃下的值。
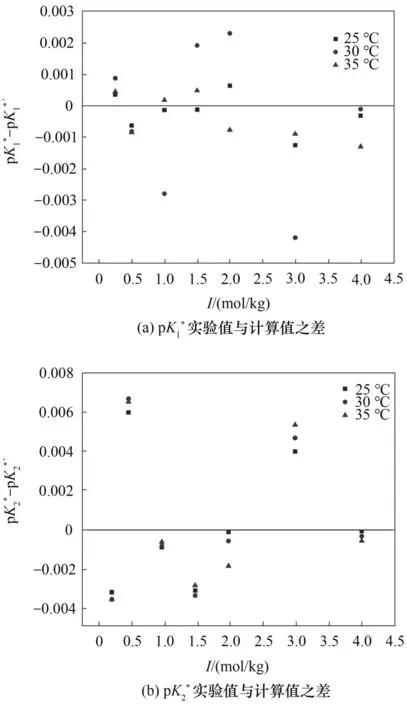
图6 实验值与计算值之差Fig.6 Deviations between the measured and calculated
3 结论
本文对蛋氨酸在KCl水溶液中的解离常数和活度系数进行了研究,得出如下主要结论:
(1)在25、30、35℃下的KCl浓度为0.25~4.0 mol/kg的水溶液中,当KCl浓度固定时蛋氨酸的解离常数随温度升高而降低,解离为吸热过程,且质子化焓变随离子强度增加而增加。
(2)25℃下蛋氨酸在KCl、NaCl和KNO3水溶液中的解离常数随离子强度的变化规律一致。三种盐溶液中蛋氨酸较接近;NaCl 溶液和KCl 溶液中蛋氨酸较接近,二者与KNO3溶液中蛋氨酸解离常数相差较大,说明电解质离子的种类对蛋氨酸解离常数有一定影响,这可能与离子水化作用有关。
(3) 25℃的KCl 水溶液中,KCl 浓度固定时蛋氨酸活度系数随自身浓度增大先减小后增大。
(4)用DH 模型对本文KCl水溶液中蛋氨酸解离常数进行拟合得到相关参数,计算无限稀释溶液下的解离常数,与文献值相差较大,可能是实验范围与无限稀释溶液环境存在差异所致。
(5)用Pitzer 模型对本文KCl 水溶液中蛋氨酸解离常数和活度系数拟合,得到Pitzer 模型参数后计算,计算值与实验结果较为吻合。
符号说明
Ai——Debye-Huckel模型参数
ai——活度系数相关参数
BHCl,BKCl——分别为HCl、KCl的第二维里系数
CHCl,CKCl——分别为HCl、KCl的第三维里系数
Ci——Pitzer模型参数
ci——物质i体积浓度,mol/L
D——等量质量浓度,mol/kg
E+——阳离子选择电极电势,mV
E-——阴离子选择电极电势,mV
——阳离子选择电极参数,mV
——阴离子选择电极参数,mV
E0——标准电动势,mV
ΔE——电势之差,mV
fγ——Debye-Huckel模型参数
H——焓,kJ/mol
Ki——解离平衡常数
——一定离子强度下实验测得的解离平衡常数
——无限稀释溶液的解离常数
mi——物质i质量浓度,mol/kg
P——压力,Pa
R——通用气体常数
S——电极斜率
T——热力学温度,K
z*——Debye-Huckel模型参数
——Pitzer模型参数
,——分别是蛋氨酸在纯水溶液中和KCl溶液中的活度系数
γH,γB,γHB,γH2B——分别是H+、B-、HB和H2B+的活度系数
,——分别是KCl 在纯水溶液中和蛋氨酸溶液中的活度系数
ε——相互作用参数
ΘHK,ΨHKCl——分别是Pitzer 模型中H+与K+,H+与KCl相关的参数
λHB-K,λHB-Cl——分别是Pitzer 模型中与HB 和K+、HB和Cl-相关的影响因子
