微生物修复Cr(Ⅵ)污染作用机制及研究进展
2021-10-04彭蕾姜岩夏如馨
彭蕾,姜岩,夏如馨
(重庆工商大学废油资源化技术与装备教育部工程研究中心,重庆 400067)
引言
铬由于其良好的耐腐蚀性和硬度,被广泛应用于染料生产、皮革鞣制、合金制造等现代工业,但处理技术的不完善以及其他人为因素等使得铬以不同的形态和形式进入到环境系统中,由于重金属累积效应,危害了生态环境[1]。铬的毒性强烈依赖于氧化状态,环境中铬的氧化态包括Cr(Ⅱ~Ⅵ),但主要以Cr(Ⅲ)和Cr(Ⅵ)的形式稳定存在[2]。Cr(Ⅵ)是一种毒性极高的物质,有较好的流动性和溶解性,易于通过生物膜进入细胞内,并在胞内还原代谢过程中,导致一系列遗传损伤,对人体和动物造成“三致”作用,也会影响植物对养分的吸收和光合作用[3]。Cr(Ⅲ)的毒性仅为Cr(Ⅵ)的1/100,相对难溶,不易被吸收,也不易生物积累,且是人体代谢所必需的微量元素[4]。目前,将Cr(Ⅵ)转化为Cr(Ⅲ)是最为常见的铬污染处理方式。
利用微生物还原Cr(Ⅵ)来修复铬污染场地,具有经济、安全、环保、可持续且无残留等优势,具有良好的应用潜质[5]。当前的研究热点追根溯源聚焦在各种生物应激机制上。普遍认为,生物解毒Cr(Ⅵ)的机制主要体现在两个方面:其一,生物吸附和转化等去除机制;其二,铬离子的吸收、外排和抗氧化应激反应等的抗性机制。其中,生物吸附技术已在含铬工业废水处置中得以应用;而转基因技术的发展也为生物修复铬污染提供了可能的解决方案。通过探索微生物去除Cr(Ⅵ)的作用机制可以为开发铬污染治理新技术提供理论指导。本文针对铬污染的微生物治理技术,论述了细胞在铬污染环境下的各种解毒和转化机制,以及共存离子胁迫对微生物去除Cr(Ⅵ)的影响,展望了含铬复合污染场地治理技术的发展前景。
1 微生物去除Cr(Ⅵ)的作用机制
1.1 细胞膜吸附及转化
1.1.1 细胞膜吸附机制 细菌和真菌等与Cr(Ⅵ)接触于细胞表面时,利用其表面多糖、脂类及蛋白质等提供结合位点,通过羟基、羧基等官能团依靠理化作用将Cr(Ⅵ)吸附于细胞表面,部分被吸附的Cr(Ⅵ)还将进一步被转化为Cr(Ⅲ),从而减少环境中的铬污染和降低铬毒性(图1)[6]。吸附作用较为单一,但不同的研究体系所呈现出的作用机制有所差别,主要包括细胞膜表面官能团的化学结合力、静电吸引力,以及细胞表面阳离子引起的静电吸引效应。在Sphingopyxis macrogoltabida中,羟基、酰胺Ⅰ带、羧基、磷酸基等官能团都发生了波数的变化,推测参与了Cr(Ⅵ)的生物吸附过程,而且,Zeta 电位分析发现了细胞等电点的移动,佐证了化学结合力参与了细胞表面吸附[7];利用傅里叶变换红外吸收光谱图(FTIR)还发现了官能团的静电吸引作用,在常见真菌Aspergillus flavus的细胞膜表面官能团存在三种可能吸附途径:C≡C 中π 键与Cr(Ⅵ)相互作用形成Cr(Ⅵ)-π 配合物;蛋白的—NH2、—OH 提供孤电子与Cr(Ⅵ)结合形成配合物;酰胺Ⅲ带的COO-通过静电引力与Cr(Ⅵ)结合[8]。这两个代表性研究均采用FTIR 法证实了细胞膜上的官能团对于Cr(Ⅵ)吸附的重要作用。此外,由于Cr(Ⅵ)在环境中多以等铬酸根形态存在,因此细胞表面阳离子的特性也不容忽视。在酸性环境中,Penicillium griseofulvum细胞内的氨基发生解离,继而诱导正电荷聚集于细胞表面形成了带正电荷的细胞壁,通过静电作用直接将带负电荷的铬酸根离子吸附于细胞表面[9]。这个作用的关键控制就在于利用特定的细胞生存环境来诱导细胞生理特性的应激变化,事实上,在利用生物法修复各类污染场地技术中,核心问题就是如何调控细胞产生特有的作用机制,发挥预期的功效以去除污染物。生物处理技术总体来讲作用条件温和,功能多样化,多数情况下也具备一定的抗环境因子波动能力,因此具有良好的应用潜力。
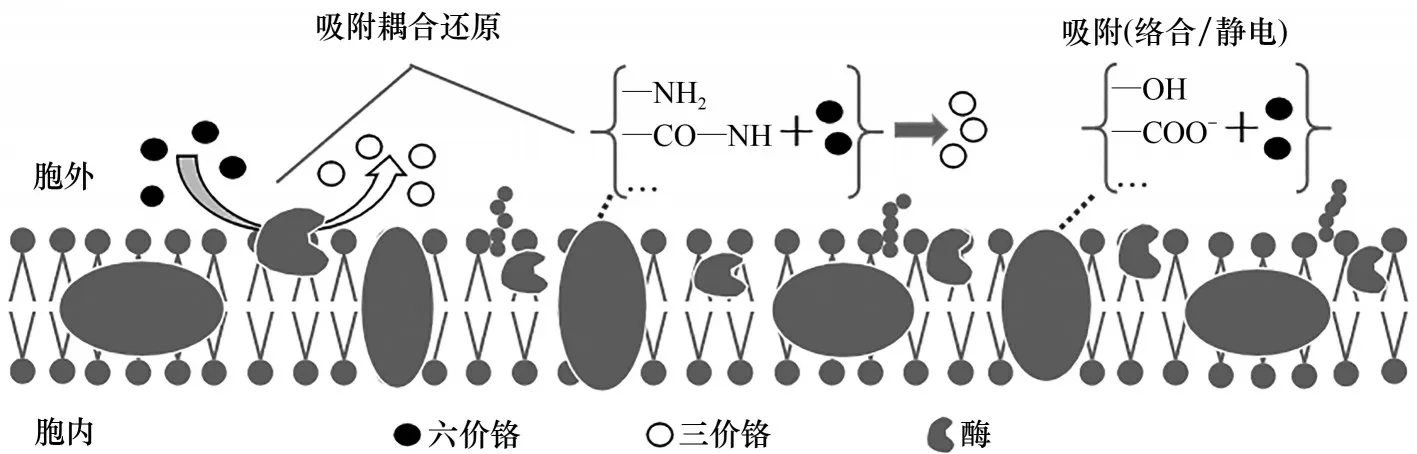
图1 细胞表面Cr(Ⅵ)吸附Fig.1 Cr(Ⅵ)adsorption on cell surface
在各种Cr(Ⅵ)的去除机制中,国内外对于生物吸附作用的理论和技术研究得最多,距离形成稳定的应用也最近。表1总结了以真菌、细菌、微藻等作为生物吸附剂去除Cr(Ⅵ)的代表性研究。因微生物种类不同、处理条件不同,吸附特性存在较大差别。微藻类一如既往地表现出对重金属吸附的高活力,Cr(Ⅵ)的吸附量达到了90 mg/g 以上。并且,从传统观点来看,死藻类仍具备很强的吸附特性,赋予了该技术发展潜力;但藻类虽然吸附容量大,却也存在吸附后的处理问题,而且藻类的过渡繁殖也会给水体带来消极影响。因此,藻类吸附重金属技术发展至今难于规模化应用。相比之下,真菌和细菌可以实现包括胞内、外,以及细胞膜上等的一系列转化,产生二次污染的风险小,若能解决对多因子复杂污染环境的适应性问题,将展现出广阔的应用前景。

表1 用于Cr(Ⅵ)吸附的生物吸附剂Table 1 Biological absorbent for Cr(Ⅵ)adsorption
1.1.2 细胞膜Cr(Ⅵ)转化机制 细胞表面Cr(Ⅵ)转化存在于部分微生物中,如图1所示,前述微生物在吸附Cr(Ⅵ)的同时可能还伴随着生物转化作用发生,吸附Cr(Ⅵ)的同时直接起到解毒作用。Banerjee等[16]细化研究了Bacillussp.TCL 的不同部位还原Cr(Ⅵ)的情况,发现其最大还原活性来源于膜结合蛋白的介导和胞外多糖的络合作用。这一研究结果并不多见,一般细胞转化Cr(Ⅵ)的活动主要发生在细胞内,而本研究则发现胞内的转化作用较微弱。当前,对于结合蛋白的深入研究罕见报道,普遍的处理方式是将这种蛋白统称为膜结合还原酶,具体的酶系及转化机制尚有待研究。铬的细胞表面吸附-还原作用还可以在官能团的介导下完成。最近,在Tan 等[17]对另一株Bacillussp.CRB-B1 的研究中证实,Cr(Ⅵ)的膜转化行为既有膜结合还原酶介导的作用,也有—NH2、—COO、—OH 等膜表面官能团的参与,不过具体的还原机制未做报道。这是迄今为止发现的两种膜转化Cr(Ⅵ)机制,鉴于这些官能团均存在于基础的膜结构中,由此推断,细胞膜的吸附与转化作用很可能并行存在,只是碍于认知水平的限制尚未达成普遍共识。不过,对于细胞膜吸附、转化重金属作用普遍推测存在着络合、静电吸附、电子转移等作用。
此外,Cr(Ⅵ)转化产物及去向问题因对生物去除Cr(Ⅵ)技术的可行性和安全性至关重要,因而成为近期的研究重点。Zeng等[18]利用扫描电镜(SEM)、透射电镜(TEM) 和能谱仪(EDS) 等证实了O.oncorhynchiW4 转化Cr(Ⅵ)的主要部位也在细胞膜上,占到了总去除率的82.9%,而这部分Cr(Ⅵ)转化产物则以Cr(OH)3和Cr(Ⅲ)-有机物复合物的形式黏附于细胞表面和释放到环境中。可见,生物转化Cr(Ⅵ)可以有效削弱铬酸盐污染物的环境毒性,有力支撑了生物法去除Cr(Ⅵ)的可行性。
1.2 细胞吸收、转化及抗性机制
1.2.1 细胞吸收机制 Cr(Ⅵ)不仅可以被吸附于细胞表面,也可以通过特有机制穿过细胞膜,进一步被细胞内的还原物质转化为Cr(Ⅲ),从而降低毒性。这种特有机制的产生主要是因为Cr(Ⅵ)多以形态存在,空间构象近似于的正四面体结构,可通过的跨膜转运途径进入胞内[19]。当前的研究认为,硫酸盐转运机制可能与编码硫酸盐转运蛋白和参与硫代谢的相关酶基因有关,Cr(Ⅵ)的胁迫下强烈诱导了相关转运蛋白的显著表达。其中,报道较多的铬酸盐转运机制是通过硫酸ABC 转运体进入胞内,该转运体的蛋白组成包括Sbp(周质硫酸盐结合蛋白)和CysP(硫代硫酸盐结合蛋白)、CysT 和CysW(两种膜内转运蛋白)、CysA(膜相关ATP 结合蛋白)[5,20-21]。此外,硫酸盐转运体的表达通常受到相关硫代谢基因的调控,这种基因调控手段往往存在着双向作用。在Pseudomonas putidaF1、Cupriavidus metalliduransCH34 和Arthrobactersp.FB24 等细菌中就发现了在Cr(Ⅵ)诱导下相关硫代谢基因的显著上调,使铬酸盐通过硫酸ABC 转运体进入胞内[22-24]。然而,由于Cr(Ⅵ)的转运占用了硫酸盐通道,会影响硫酸盐的吸收,导致细胞内硫元素降低,造成硫酸盐和铬酸盐之间形成的底物竞争关系强烈而复杂,使得硫酸盐转运机制在运行时也会给细胞代谢带来问题。近期发现,在Shewanella oneidensis的细胞中与硫酸同化和硫代谢过程相关的下调蛋白在长期的铬胁迫下显著富集,这种应激机制被视作为保护细胞免受铬酸盐损伤的抵制策略[25]。因此,细胞吸收Cr(Ⅵ)可以减小环境毒害,但这种作用是一种主动规避行为还是被动诱导行为难以评估。由此可见,微生物不仅可以通过细胞膜上的转运体吸收铬酸盐,还可以通过调节相关转运基因的表达来减少对Cr(Ⅵ)的吸收。这一双向机制指出利用生物技术消除Cr(Ⅵ)环境污染的关键控制在于使细胞具备持续而稳定的吸附和吸收等固定作用,或是胞内、胞外等转化作用,这将赋予该技术实际应用潜质。对此,生物技术的优势显现出来,功能型菌种在特定环境中可以实现稳定代谢,持续地保障其种群的数量和功能优势。
当前,硫酸盐通道跨膜转运Cr(Ⅵ)的吸收机制已得到广泛认可。不过,在Escherichia coli细胞内也曾发现了钼酸盐结合蛋白ModA,可作为遗传编码的工具紧密结合铬酸盐去除Cr(Ⅵ)[26]。此外,一种发生在酵母细胞内的转运机制也值得关注。Saccharomyces cerevisiae细胞在肌动蛋白介导的内吞作用下吸收Cr(Ⅵ),但该过程可能伴随着质膜铬转运体的泛素依赖性内吞失活,从而限制Cr的积累和毒性[27]。这同样也是一种双向机制,与常见的硫酸盐转运体的铬酸盐转运途径不同,只是这种吸收与抗性机制在后续研究中鲜有报道。
1.2.2 细胞内Cr(Ⅵ)转化及抗性机制 将Cr(Ⅵ)转化为Cr(Ⅲ)是微生物修复铬污染环境最为重要的去除机制。Cr(Ⅵ)经还原后通常形成Cr(Ⅲ)析出物,如Cr2O3、Cr(OH)3等,但也有形成可溶性终产物的报道,包括Cr(Ⅲ)-EPS、Cr(III)-NAD+、Cr(Ⅲ)-有机物等复合物[28-29]。表2 总结了具有Cr(Ⅵ)还原能力的菌株,其中,芽孢杆菌等细菌因形成芽孢,抵抗外界不良环境的能力强,在转化机制研究中被较多发现。当前,六价铬的转化研究多以中温好氧微生物为主,且在近中性环境中菌株生长代谢及对Cr(Ⅵ)的转化作用较为适宜,但菌株耐受及还原六价铬浓度的能力范围差异较大,多集中在200 mg/L范围内。当然,个别研究成果有利用嗜热菌成功实现了对Cr(Ⅵ)的转化。此外,无论细菌还是真菌普遍具有较高的Cr(Ⅵ)转化能力,并且转化作用可以发生在细胞内外,但生物转化Cr(Ⅵ)最主要的途径还是在细胞内。
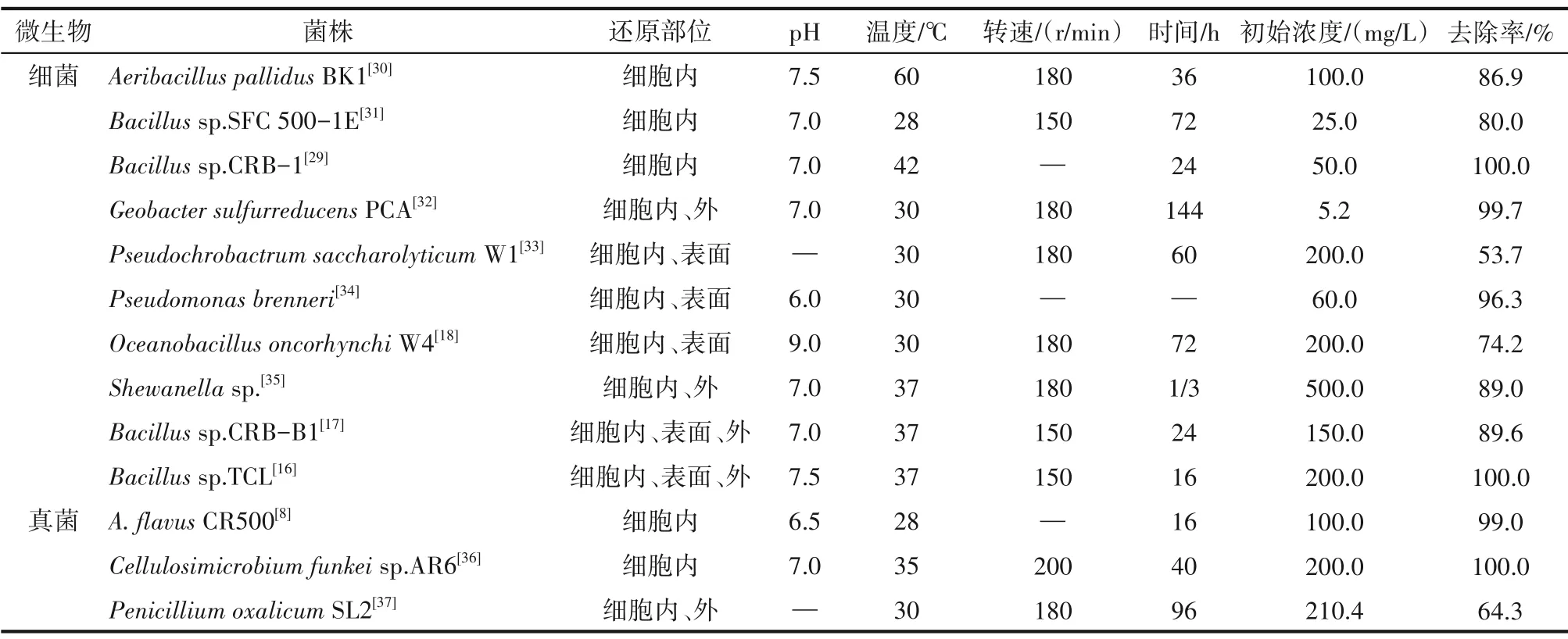
表2 具有Cr(Ⅵ)转化能力的微生物Table 2 Microorganisms with Cr(Ⅵ)transformation ability
细胞内活性物质丰富,依靠细胞质中的YieF、NemA、依赖NAD(P)H 酶等可溶性还原酶,以及抗坏血酸、半胱氨酸、谷胱甘肽等铬酸还原剂将Cr(Ⅵ)转化为Cr(Ⅲ)(图2)[36]。Cr(Ⅵ)在胞内依靠这些复杂的途径转化过程中,通常会伴随着活性氧(ROS)的生成,而ROS 会对细胞DNA 造成碱基修饰、单/双链断裂等一系列损伤[21]。例如,E.coli胞内的ChrR、NemA、YieF 等蛋白在还原Cr(Ⅵ)时,会产生一种寿命短、反应性高,具有毒性的中间体Cr(Ⅴ),虽然胞内铬酸盐还原酶可将其进一步转化为Cr(Ⅲ),但Cr(Ⅴ)有时仍会短暂积累,导致重新氧化为Cr(Ⅵ)[38-40]。这一过程不是单纯地影响Cr(Ⅵ)转化效率的问题,重要的在于它可以通过类似于Fenton 反应的形式产生ROS 而损伤细胞。当然,并非所有胞内还原酶的作用都会产生Cr(Ⅴ)的中间体,E.coli胞内的NfsA蛋白和Bacillus subtilis胞内的ChfN蛋白则是利用连续两次电子还原过程直接形成Cr(Ⅲ),避免了Cr(Ⅴ)的反应历程,极大减小了ROS 的产生[41]。无论怎样,不必过度担忧ROS 对生物去除Cr(Ⅵ)技术的开发。这是因为部分微生物可利用特殊的DNA 修复机制如SOS 修复酶(RecA、RecG、RuvB)对这种损伤进行即时修复,从而保证细胞维持其生理生化特性;此外,谷胱甘肽酶(GSH)、超氧化物歧化酶(SOD)、过氧化物酶(POD)等诱导性酶促抗氧化剂也会在减轻氧化应激反应而抵抗铬盐毒性方面发挥积极作用[42-43]。这些作用协同高毒性铬盐的转化作用形成了微生物在铬盐胁迫环境下的胞内抗性机制,生物转化与抗性机制密不可分,成为生物去除Cr(Ⅵ)作用的根本保障。
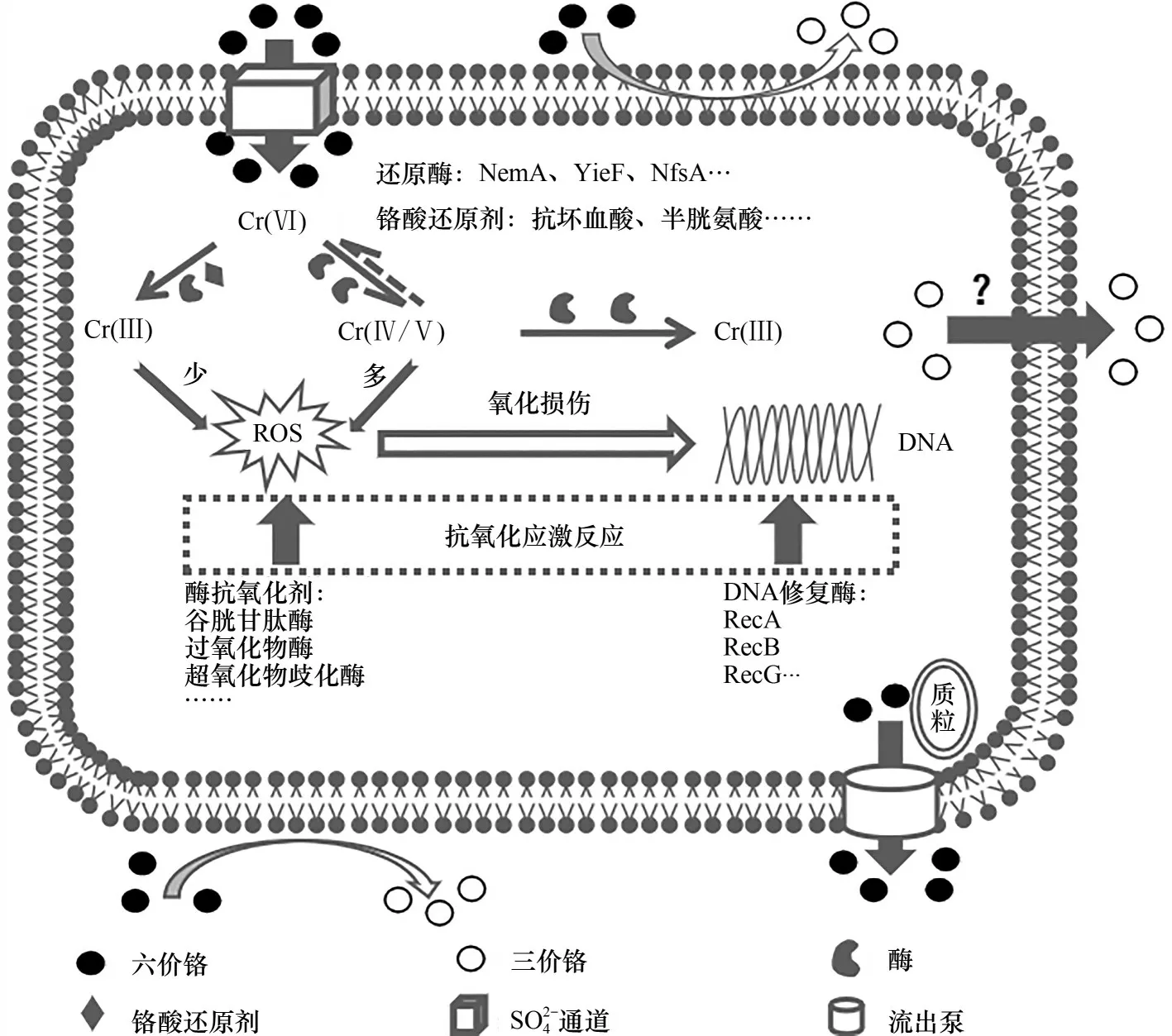
图2 Cr(Ⅵ)转化协同抗性机制[36]Fig.2 Cr(Ⅵ)transformation synergistic resistance mechanism[36]
细胞吸收Cr(Ⅵ)的同时,也存在着未经转化的直接外排机制,成为细胞自身调节和平衡铬酸盐毒性的最直接的抗性机制。细胞内累积的Cr(Ⅵ)诱导Chr 操纵子并激活由ChrA 编码的铬酸盐外排泵,利用质子动力将铬酸盐从细胞质中排出,从而削弱Cr(Ⅵ)毒性的积累[5,19]。这种ChrA 蛋白的外排抗性系统在Arthrobactersp.、Bacillussp.、Lysinibacillus sphaericus等细胞中均有发现[31,44-45],并 且,ChrB、ChrC、ChrF 等同源物也被发现具有外排Cr(Ⅵ)的能力[46-48]。不过,也存在特殊情况,在丝状真菌Neurospora crassa中,CHR-1蛋白起到了铬酸盐转运体的作用,使细胞更倾向于积累Cr(Ⅵ)[49]。至于这种作用究竟是真菌细胞所特有还是CHR-1 蛋白的特性,亦或只是一个特例,尚有待研究。此外,胞内形成的Cr(Ⅲ)产物很可能也存在外排作用,但相关研究极少。Ontañon 等[31]发现经铬酸盐还原酶作用形成的Cr(Ⅲ)产物有32%存在于细胞外环境中,证实了Bacillussp.SFC 500-1E 的细胞内存在Cr(Ⅲ)的外排通道,但这部分Cr(Ⅲ)是否也存在着部分细胞裂解释放的可能性也值得思考。
1.3 细胞分泌酶及产物对Cr(Ⅵ)的转化效应
细胞外Cr(Ⅵ)的转化明显不同于前述的两大类转化机制,主要依靠在特定培养条件下细胞分泌并外排的还原酶和代谢产物进行还原(图3)。现有报道中,细胞外还原酶包括黄素还原酶、硝酸还原酶、黄素蛋白和铁蛋白还原酶,但对具体还原机制的认知明显不足。当前,主要是通过检测酶活力和Cr(Ⅵ)的浓度来评价胞外酶的转化作用[33]。此外,胞外代谢产物的还原作用也是一种重要的Cr(Ⅵ)转化途径。这种转化作用一般发生于存在铁还原菌和硫酸盐还原菌的环境中,它们通过厌氧代谢形成的Fe(Ⅱ)和H2S 等产物间接还原Cr(Ⅵ)[50]。不过,最近Long等[51]也发现,P.oxalicumSL2可利用其产生的草酸作为还原剂还原Cr(Ⅵ)并最终形成草酸铬的配合物。酸性代谢产物的作用不仅体现在间接还原机制上,由于Cr(Ⅵ)的还原是环境pH 升高的质子消耗过程,酸性产物的产生则会提供更多的质子与细胞表面官能团发生配位作用,使其带上较强的正电荷,从而加强对Cr(Ⅵ)的吸附作用。因此,酸性代谢产物可能伴随着还原和吸附两个作用的交织,以此去除Cr(Ⅵ)[52]。胞外Cr(Ⅵ)的转化还具备一个特点,即不需要消耗能量,因而有利于反应进行。
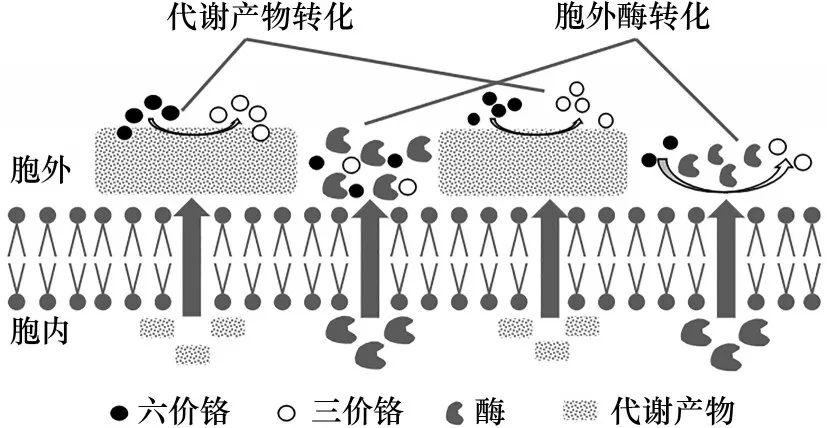
图3 细胞外Cr(Ⅵ)转化Fig.3 Extracellular Cr(Ⅵ)transformation
2 共存离子胁迫对Cr(Ⅵ)去除的影响
铬污染环境中往往存在其他金属、无机盐、石油类等污染物共存现象,对胁迫因子的研究存在明显不足,主要的研究集中在金属离子和氧阴离子胁迫两个方面。表3 总结了当前对离子胁迫下去除Cr(Ⅵ)的研究成果,可以看出离子胁迫作用很复杂,存在抑制和促进等截然相反的影响。
2.1 金属离子胁迫对Cr(Ⅵ)去除的影响
铬污染水体和土壤中经常存在Ni(Ⅱ)、Zn(Ⅱ)、Cu(Ⅱ)等金属离子,对于细胞代谢和Cr(Ⅵ)去除产生三种不同的影响(表3)。①抑制作用。P.brenneri在Fe(Ⅱ)、Mn(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ)和Mg(Ⅱ)分别与Cr(Ⅵ)形成双金属胁迫下,细胞生长情况和Cr(Ⅵ)转化效率都明显受到抑制[34];同样,在Cu(Ⅱ)、Zn(Ⅱ)、Ni(Ⅱ)的存在下,C.daeguensis对Cr(Ⅵ)的去除率分别下降了3.57%、16.36%、31.48%[53]。可见,在不同金属离子胁迫下,Cr(Ⅵ)的转化特性将受到不同的抑制,而这种差别是由微生物对于特定金属离子的耐受性和应激性不同而导致的。②无明显影响。在Banerjee 等[16]的研究中则发现,Cd(Ⅱ)、Cu(Ⅱ)、Ni(Ⅱ)和Pb(Ⅱ)等分别与Cr(Ⅵ)共胁迫Bacillussp.TCL 时,细胞代谢未受到明显影响,仍能在24 h 内有效去除200 mg/L 的Cr(Ⅵ)。③促进作用。当前,对于生物吸附和转化Cr(Ⅵ)的促进作用已获得一定的规律性认知,即Cu(Ⅱ)存在时往往可以产生促进作用。这方面的研究已经得到多方的研究证实。Sarangi等[54]从污染土壤中分离出Bacillussp.、Leucobactersp.和Exiguobac terium三株菌,它们的铬酸盐还原酶活性均受到Hg(Ⅱ)和Fe(Ⅲ)的抑制,但Cu(Ⅱ)却可以提高酶活力,特别是对Leucobacter转化Cr(Ⅵ)产生了显著的促进作用;在对Enterococcus gallinarum和Enterobactersp.两株菌的研究中,也证实了Cu(Ⅱ)的这种促进作用[55]。此外,Ca(Ⅱ)也被发现了一定的正面效应。在Volland 等[56]的研究中发现,外源性Ca(Ⅱ)可以抑制Cd、Cr、Pb 等重金属对细胞的毒性,继而提高了细胞的耐受性。共存金属离子对生物去除Cr(Ⅵ)的影响非常复杂,存在抑制与促进等多方面作用。这种差异取决于金属离子和菌株的类型,不同的金属离子或者同一金属对于不同菌株转化Cr(Ⅵ)的影响不同。在多数情况下,金属离子对铬还原菌产生抑制作用;而促进作用就当前的研究现状来看,主要体现在Cu(Ⅱ)上,这是因为Cu(Ⅱ)是过氧化氢酶、超氧化物歧化酶等抗氧化酶的重要组成部分,也是细胞氧化呼吸系统中电子传输过程不可或缺的一部分,因此Cu(Ⅱ)的存在加强了细胞对Cr(Ⅵ)的耐受性和电子传递效率,从而提高了Cr(Ⅵ)的还原能力[57]。Cu(Ⅱ)乃至Ca(Ⅱ)的促进作用对于生物修复Cr(Ⅵ)污染场地具有实际意义,有机会与营养助剂等工艺的实施统筹考虑,处理得体将不会产生额外的成本投入。
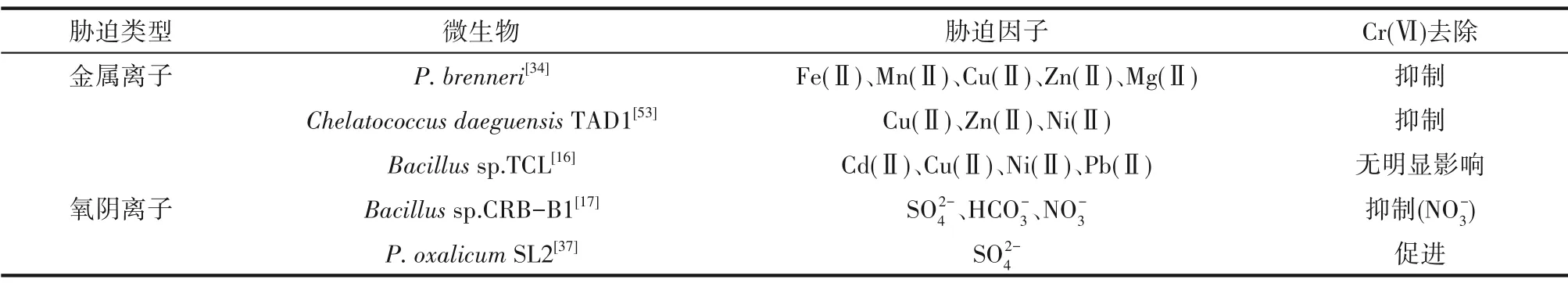
表3 其他污染因子的胁迫对细胞去除Cr(Ⅵ)的影响Table 3 Effects of removal of Cr(Ⅵ)by cells under other pollution factors stress
2.2 氧阴离子胁迫对Cr(Ⅵ)去除的影响
2.3 Cr(Ⅵ)与胁迫因子共去除研究现状
共存离子胁迫研究尚处于探索阶段,将Cr(Ⅵ)及其他共存污染因子一并作为目标污染物进行共去除是生物修复技术追求的最佳策略。现已发现能够与Cr(Ⅵ)实现共去除的离子包括其他重金属和硝酸根两类。①与其他重金属离子共去除。目前已发现部分菌株具有同时去除Cr(Ⅵ)及其他重金属的能力。Wang 等[60]发现以柠檬酸盐为助剂时,Shewanella loihicaPV-4 可在27 d 内同时去除71.3%的V(Ⅴ)和91.2%的Cr(Ⅵ)(初始浓度分别为50.6 和52.2 mg/L);在二者的竞争性抑制中,V(Ⅴ)的还原作用逐渐受到抑制,而Cr(Ⅵ)的底物竞争优势逐渐显现,增强了生物转化作用。更为直接的研究结果还在Stenotrophomonassp.、Achromobactersp.、Bacillus firmus以及Aspergillus lentulus等菌株中得以证实,这些菌株均可在去除Cr(Ⅵ)的同时分别吸附Zn(Ⅱ)[61]、还 原Mn(Ⅱ)[62]、氧 化As(Ⅲ)[63],以及吸附Cu(Ⅱ)和Pb(Ⅱ)[64]。在这些重金属与Cr(Ⅵ)形成的复合污染体系中,普遍由还原作用主导了Cr(Ⅵ)的去除。②与硝酸根离子共去除。发现这一现象的几个研究均集中在近几年[58-59,65]。除上述在氧阴离子中的论述以外,An 等[66]的研究也颇具代表性,在Pseudomonas aeruginosa的细胞膜表面,氨基、酰胺、羟基和羧基等在还原10 mg/L 的Cr(Ⅵ)中起到重要作用,并且还伴随着98% 的-N(初始浓度500 mg/L)的去除。无论如何,Cr(Ⅵ)与共存因子的共去除具有可行性,这对于生物修复污染场地技术的理论研究与应用发展具有重要意义。
除了离子与Cr(Ⅵ)的共去除以外,有机物与Cr(Ⅵ)的共去除得到了更广泛的关注。表4 中概况了部分代表性研究成果。可以看出,即便是难降解氯苯和氯酚类污染物的存在,依然可与Cr(Ⅵ)一起实现有效的共去除[68]。有机物与Cr(Ⅵ)的共去除机制在Huang 等[69]的研究中得到一定阐释,是由萘降解形成的中间产物邻苯二酚和邻苯二甲酸促进了Cr(Ⅵ)向Cr(Ⅲ)的还原。当然,有机毒性对细胞的胁迫作用很可能抑制Cr(Ⅵ)的转化,即便如此,只要细胞能够利用有机物作为碳源实现自身代谢,同时又伴随着Cr(Ⅵ)的生物吸附、吸收、转化,将对生物修复污染场地技术的开发产生重要影响,因这种机制的存在适合于多种类型的实际污染场地情况。
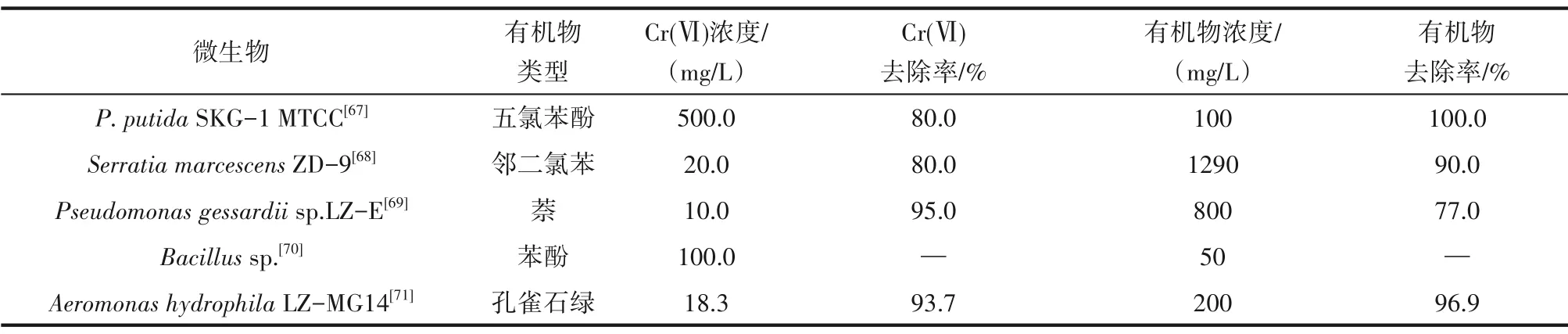
表4 典型共去除含Cr(Ⅵ)复合有机污染物的微生物Table 4 Typical microorganisms of co-removal of Cr(Ⅵ)combined organic pollutants
在现阶段,随着我国整体工业布局的推进,遗留的企业旧址中经常伴随着石油类污染物与Cr(Ⅵ)等重金属的复合污染问题[72-73]。以往在面对油料等有机污染问题时,重金属的影响很少受到关注。课题组就曾发现在某Cr(Ⅵ)污染土壤中含有数千mg/L的石油类污染物,并从中分离出一株Lysinibacillus fusiformis,初步研究发现,该菌株具备二者的共去除能力,尤其是在有机助剂促进下,二者的去除效果显著提升(图4)。当然,当前所用助剂成本高,亟待探索高效、低成本助剂。
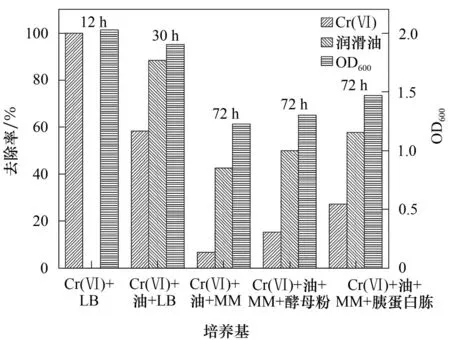
图4 不同培养条件对Lysinibacillus fusiformis共去除的影响(MM无机盐培养基、Cr(Ⅵ)50 mg/L、润滑油500 mg/L、酵母浸粉0.5%、胰蛋白胨1%)Fig.4 Effects of different culture conditions on the co-removal of Lysinibacillus fusiformis
当前的研究证实了共去除Cr(Ⅵ)与石油烃菌种的存在,且其消除Cr(Ⅵ)的特性与环境中可利用的底物密切相关。在实际Cr(Ⅵ)污染场地中,不仅存在着Cr(Ⅵ)与石油烃等的复合污染,也存在着有机质含量少相对简单的污染场地,因此,生物修复Cr(Ⅵ)污染场地技术的开发可能更加受到下游端的影响,即环境中必须含有足够的满足微生物代谢同时又能产生各种消除机制的底物。当然,生物除油转化Cr(Ⅵ)技术尚有很长的路要走,在承载该技术的手段、技术稳定性、修复成本的控制等方面都成为关键问题。
3 结语
微生物解毒Cr(Ⅵ)的作用机制可以分为去除机制和抗性机制两大类。去除机制主要基于转化和吸附两大理论体系,这两种机制经常交织在一起,存在于细胞内、外,及细胞膜上,会因微生物不同而有差异,主要的转化作用多发生在细胞内,是微生物最主要的Cr(Ⅵ)解毒机制,吸附作用则将环境中的Cr(Ⅵ)固定于细胞表面,部分Cr(Ⅵ)被官能团等作用转化,从而降低其生物毒性;抗性机制主要体现在外排和抗氧化应激反应上,一般从酶学和基因表达等层面得以体现;细胞吸收作用既与生物去除Cr(Ⅵ)有关,也是一种生物抗性机制,主要起到胞内转化Cr(Ⅵ)的承接作用,从而直接降低铬毒性,减小对人体和动、植物的危害。重金属、有机污染物、石油类污染物等多因子胁迫下的Cr(Ⅵ)修复研究更贴近污染场地实际情况。当前的研究主要聚焦在金属离子和氧阴离子方面,金属离子的胁迫作用更多地体现在有毒抑制上,但也存在Cu(Ⅱ)的促进作用;而氧阴离子的胁迫作用则更为复杂,现有认知不多,是否成为规律性的影响有待更多的探索。总之,复合污染生物修复研究尚处于起步阶段,生物作用于Cr(Ⅵ)的解毒机制,以及调控石油烃代谢协同转化Cr(Ⅵ)的细胞应激机制等诸多问题尚有待揭示。未来研究重点一方面要坚持代谢调控等理论研究;另一方面应落脚到与工程实践相结合的工艺优化与升级,解决环境因素等的技术瓶颈问题。现有理论认知可以证实生物法去除Cr(Ⅵ)的可行性,该技术应用和推广的难点不在于生物解毒的核心问题,而是在于生物修复污染场地技术本身的发展。多年来,生物修复技术始终处于研究众多,但鲜有应用的现状。只有解决以成本控制为前提的承载核心技术的工艺问题,才能推动Cr(Ⅵ)污染修复乃至整个生物修复技术向工程应用化的发展。因此,生物解毒机制等核心技术与修复工艺的并行发展才是生物修复污染场地技术的突破口。
