骨架蛋白对肉持水性的影响及机制研究进展
2021-09-29孙良格张新笑徐为民王道营李鹏鹏
孙良格,张新笑,卞 欢,邹 烨,,徐为民,,王道营,, ,李鹏鹏,,
(1.江苏大学食品与生物工程学院,江苏镇江 212013;
2.江苏省农业科学院农产品加工所,江苏南京 210014)
骨架蛋白是肌肉细胞的重要结构成分,是肌纤维网络结构中维持空间构型、承受外力以及保持内部结构有序性的一类蛋白质。骨架蛋白对肉类品质的影响一直是许多学者研究观察和分析的主题,骨架蛋白的降解影响宰后肉品的质量,包括嫩度、持水性等方面[1]。肉的持水性(Water-holding capacity,WHC),是指肌肉保持原有水分的能力。持水性不仅影响肉的嫩度、风味等感官品质,还直接影响肉类屠宰加工企业的经济效益[2]。
汁液流失(Drip loss)经常被用来衡量肉的持水性。从1860年开始,肉品科学家开始研究肌肉汁液流失的机理,致力于研究影响肌肉持水能力的因素[2]。1995年Huff-Lonergan等[3]人提出汁液流失可能与蛋白质降解有关,骨架蛋白包括膜结合蛋白踝蛋白(Talin)、肌营养不良蛋白(Dystrophin)等联结肌原纤维和细胞外基质蛋白,对维持细胞结构和细胞与细胞间的粘附起关键作用,因此,骨架蛋白的降解影响宰后肉品的汁液流失[4]。例如,细胞膜骨架蛋白跨膜蛋白整合素(Integrin)的降解有助于汁液流失通道的形成,增加汁液流失[5];黏着斑蛋白(Vinculin)的缓慢降解和Talin的快速降解影响猪肉宰后成熟过程中肉的汁液流失的增加[6]。钱书意等[7]研究表明宰后冻结肉的骨架蛋白结构出现改变,会使骨架蛋白之间聚集,蛋白质溶解度降低。蛋白的疏水作用增强和水合力下降导致肉品持水性降低。
宰后肉品的汁液损失在0.1%~10%之间,在分割和贮藏过程的损失率可达2%~10%,给肉类屠宰加工行业造成数亿元经济损失[8]。如何降低汁液损失率仍然是肉类研究学者们共同努力的目标。开展宰后肉品持水性与骨架蛋白关系研究,不仅能够提高肉品质量、减少经济损失,而且有助于揭示宰后肉品汁液流失形成机理。Puolanne等[9]认为肉的持水机理仍需进一步研究,其中骨架蛋白对持水性的影响需要结合pH、离子的种类和强度及蛋白质结构性质等进一步研究阐明。本文将对近年来研究发现的骨架蛋白的结构功能、骨架蛋白对持水性的影响及影响骨架蛋白降解的因素进行综述。
1 骨架蛋白概述
细胞骨架在狭义上包括微丝、微管和中间纤维,它们由多种蛋白质以不同方式组装而成。微丝是由肌动蛋白构成;微管是由α和β管蛋白和少量微管结合蛋白的聚合作用而形成的管状纤维;中间纤维是由α-螺旋杆状、长状蛋白装配而成。骨骼肌细胞骨架可被分为3种:肌小节内骨架、肌小节外骨架和肌细胞膜骨架。伴肌动蛋白(Nebulin)排在肌原纤维上的肌节内,这种蛋白是肌小节内的主要骨架蛋白;肌小节外骨架蛋白主要包含肌间线蛋白(Desmin)、巢蛋白(Nestin)、联丝蛋白(Synemin)和核纤层蛋白(Lamins),它们位于肌原纤维周围,连接Z盘、核膜和肌细胞膜之间;肌细胞膜骨架蛋白包括Vincullin、血影蛋白(Sepectrin)、Dystrophin、Integrins等跨膜的和与膜相连的蛋白[5]。表1总结了肌肉中的主要骨架蛋白的分子量、所处肌肉位置以及与之结合的相关蛋白。骨架蛋白的功能主要包括以下几点:①负责信息交流,骨架蛋白能够在肌原纤维与胞外基质两者之间建立联系,使细胞形成一个系统复杂的信息交流中心[10];②调节和稳定肌肉收缩,骨架蛋白具有维持细胞结构并对肌肉收缩起到调节和稳定的作用[11];③连接肌节,细丝状的骨架蛋白与细丝、粗丝平行排列,位于肌原纤维的空隙,起到连接肌节的作用[11];④调节细肌丝的长度,部分骨架蛋白可以作为一个分子尺调节细肌丝的长度以及细肌丝的排列,比如Desmin[12]。
2 骨架蛋白与肉持水性的关系
2.1 肌营养不良蛋白(Dystrophin)对肉持水性的影响
Dystrophin是一种胞内杆状蛋白,定位于肌膜的内表面,由3685个氨基酸组成的分子量为427 kDa的细胞骨架蛋白,占肌肉骨架蛋白比例超过5%以上[13]。Dystrophin具有四大功能域,分别包括N端区、棒状区、半胱氨酸富集区、C端区。它的N终端和部分中间杆域与细胞骨架丝状肌动蛋白(F-actin)相互作用,而C端区域与多个蛋白质组装DAPC(Dystrophin-associated protein complex)跨越骨骼和心脏肌肉的肌纤维膜[13]。Dystrophin主要功能是连接肌细胞中的肌动蛋白与细胞外基质,使得肌肉形成紧密的肌肉束,在收缩过程中保护肌膜对抗机械压力。DAPC的完整性对于收缩肌纤维承受由肌膜产生的机械应力以及防止其脆弱的肌膜因收缩引起的损伤至关重要。此外,Dystrophin必须与糖蛋白结合成DAGC(Dystrophin-associated glycoprotein complex)才能发挥稳定细胞膜的作用,有实例发现Dystrophin的缺乏使得DAGC复合体形成失败,从而不能稳定细胞膜,最终导致肌细胞坏死[14]。
Dystrophin位于膜和肌动蛋白之间,它的破坏会导致Z线、M线、中间丝状体断裂,进而会造成肌纤维之间以及肌纤维与肌膜之间发生解离,引起肉品质构劣化[15]。Taylor等[16]研究报道在牛肉储存过程中发现宰后7 d肌肉中的Dystrophin绝大部分发生降解。Wojtysia等[17]以阉割公鸡与未阉割公鸡为原材料研究发现,发现宰后48 h后两组公鸡的肌肉纤维中Dystrophin的降解都增加,未阉割鸡胸肉中未受损的Dystrophin的含量均高于阉割鸡胸肉。可见,畜禽的生理状态对Dystrophin降解情况也有影响。贾胜男[1]研究发现,以草鱼背部肌肉组织为实验材料,第1 d未发现肌肉中Dystrophin的降解,这表明Dystrophin在动物死后前期以完整的形式存在于肌肉中。随后发现该蛋白的降解逐日加强,在7 d达到降解率达到60%,第21 d时Dystrophin降解率达71.14%,滴水损失率与Dystrophin的含量呈显著负相关,Dystrophin的降解最终导致细胞功能的丧失和肌原纤维结构的削弱,使得持水性受到影响。生理学中研究发现,Dystrophin基因变异引起杜氏或贝克尔肌营养不良症,Dystrophin的缺失会造成肌肉坏死。在肌肉转变成可食用肉的过程中会对肉制品的外观、营养、质地等方面带来极坏的影响[18]。

表 1 肌肉中的骨架蛋白Table 1 Cytoskeletal proteins in muscle
2.2 网蛋白(Plectin)对肉持水性的影响
Plectin是血溶素家族的高分子量多功能细胞骨架蛋白,广泛分布于动物的多种组织细胞中,如肌肉、皮肤、心脏及脑等。迄今为止,已经发现了16种网蛋白的亚型,其中1d、1f、1b和1四种亚型在肌肉细胞中表达量较高。Plectin存在于中间纤维和微丝的质膜附着部位,如平滑肌的致密斑块、心肌的夹层盘等位置[19]。Plectin位于骨骼肌的Z盘,骨骼肌中Plectin的分布呈纤维依赖性。通过旋转跟踪电子显微镜发现Plectin结构为哑弹状,Plectin的中心位置是200 μm长的棒状结构域,两侧是两个大的球状结构域[20]。在功能上,作为一种重要的细胞骨架蛋白,Plectin交联细胞骨架的三种主要成分:微管、中间纤丝和肌动蛋白微丝,在稳定细胞结构和维持细胞功能完整性方面具有重要作用[20]。
Tian等[20]研究表明,猪宰后早期成熟过程中猪肉Plectin迅速减少并在宰后3 d消失,但是宰后0 h就能检测到已经被降解为240和20 kDa的Plectin片段快速积累,并证实Plectin与Desmin一起在重要的肌细胞部位有规律的存在,正如图1所示。这些结果表明,Plectin在宰后肉品成熟过程中发生了迅速而显著的降解。进一步研究通过比较加入caspase抑制剂与calpain抑制剂,发现calpain抑制剂能明显抑制Plectin的降解。在生理上,由Plectin的基因突变导致的Plectin缺乏表现为肌营养不良等症状,进而影响着宰后肉品的质量[21]。Plectin的降解会破坏复杂的蛋白支架网络(图1),破坏细胞结构,影响汁液流失通道的形成,最终影响肉品的持水性,因此,研究死后衰老过程中Plectin降解对肌肉结构变化和肉质的影响是很有必要的。
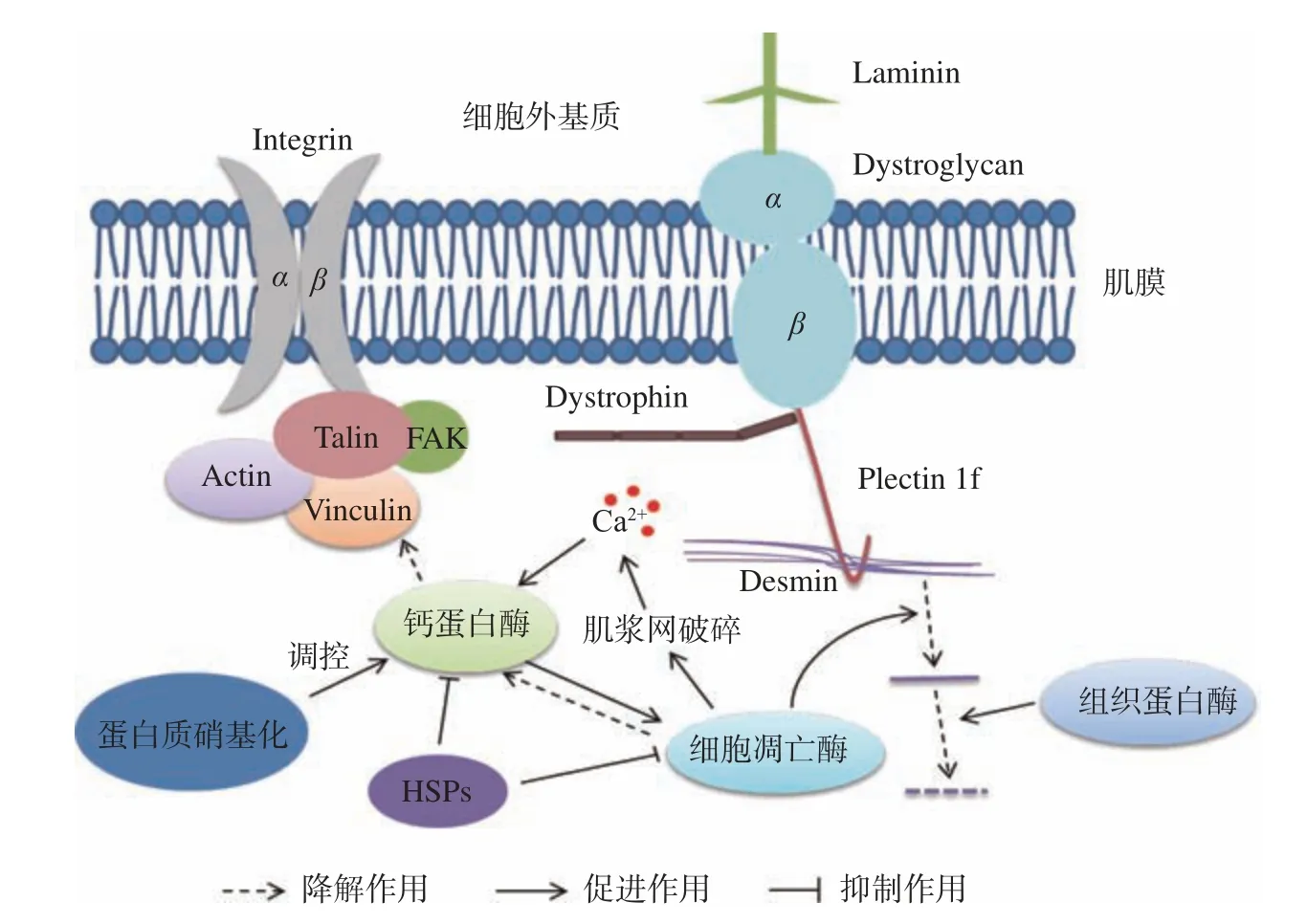
图 1 骨架蛋白位置及降解机制Fig.1 Cytoskeleton proteins location and degradation mechanism
2.3 踝蛋白(Talin)对肉持水性的影响
Talin作为一个大分子量蛋白,位于细胞膜的内表面,由2541个氨基酸组成,长度约为60 nm,大小270 kDa[22]。Talin由50 kDa N端头部区域和220 kDa两性分子螺旋束组成的细长棒体组成。Talin头部包含一个FERM结构域,含有FERM结构域的蛋白质在许多生物学过程中都是必不可少的,包括细胞粘附、运动、增殖和分化[23]。含有FERM结构域的Talin在细胞粘附受体整合素家族的激活中起关键作用,并且为β-Intergrin亚基和肌动蛋白细胞骨架之间提供直接联系。Talin作为粘着斑成分介于肌动蛋白和Intergrin之间,而Vinculin是与黏着斑有关的主要细胞骨架蛋白,Vinculin在胞内过表达可使黏着斑更加稳定[24−25]。
先前Kristensen等[6]对Talin的研究表明,Talin发生快速降解,骨骼肌膜结构被破坏,随后肌纤维收缩时产生的交联及肌原纤维之间的交联断裂,挤压细胞内水分的力被消除,使肌肉的持水能力提高。发生此结果的原因可能是骨架蛋白质的降解使肌细胞横向膨胀。Melody等[26]研究发现,Talin宰第1 d开始降解,Kristensen等[6]研究发现,宰后第4 d Talin降解达到了68%。Tomisaka等[27]研究了宰后肌肉系水力的变化,发现Talin在宰后第4 d降解为最初的25%。Huff-Lonergan等[28]研究发现Talin的降解能减少肌肉的汁液流失率。而杨汝男等[29]测定了RFN(Reddish,Firm,Non-exudative)与PSE(Pale,Soft,Exudative)肉样中Talin的降解量,发现宰后各时间点Talin的含量与汁液流失率呈不显著正相关(P>0.05),Talin的降解对持水性无影响。目前,宰后肉品Talin降解与汁液流的关系仍存在较大争议[30],Talin对肌肉持水性影响还有待进一步研究确认。
2.4 肌间线蛋白(Desmin)对肉持水性的影响
Desmin是中间纤维的重要基础结构,它的亚基分子量为55 kDa,围绕Z盘分布并延伸到Z盘内部,是位于Z线以及Z线和肌细胞膜之间的骨架蛋白,由两端的N端和C端以及中间螺旋杆状结构(αlelical rod)组成[31]。Desmin通过Z线将单个肌原纤维连接在一起,使得收缩运动机械整合在一起,同时连接线粒体、细胞核和肌膜,主要为限制肌节在肌肉收缩时过分拉伸。此外,Desmin帮助邻近肌原纤维正确定位和排列,在成熟的肌细胞中连接每条肌原纤维并将其与细胞膜联结,发挥着固定肌原纤维的作用,进而维持整个骨骼肌细胞的有序性和完整性[26]。
Desmin的重要功能决定了其可能对宰后肉品的持水性起重要作用。Desmin在4 ℃环境中能够迅速发生降解,使肌原纤维间的横桥交联断裂,导致肌原纤维有序结构被破坏,从而提高持水性。张冬怡等[32]人发现Desmin降解程度、钙蛋白酶自溶程度及汁液流失率呈正相关。此外还发现,PSE肉中Desmin开始发生降解的时间先于RFN肉,说明PSE肉中Desmin的降解导致的肌原纤维的结构破坏快于RFN肉,PSE肉对肉品持水性影响更大。有研究发现Desmin宰后第1 d未发生降解,到了第4 d才发生轻微降解,到第10 d降解了70%。在7 d后,由于骨架蛋白质的降解使得肌细胞横向膨胀导致持水性增加[3]。郑伟的研究中发现宰后猪肉样品1~7 h的Desmin完整度与汁液流失均无显著相关性,这与其他人研究结果不一致[33]。王颖等[34]研究发现,Desmin的含量在高极限pH后2 d内显著持续下降,在中极限pH组中明显下降至宰后5 d,而在低极限pH组中宰后7 d内一直持续显著下降。由此可见,Desmin在高极限pH的情况下降解速度更快。由上述所知,Desmin降解程度与肉品温度、pH、蛋白酶等因素共同作用影响着肉品的持水性。
2.5 整合素(Intergrin)对肉持水性的影响
Intergrin是一类异二聚跨膜蛋白,是由内而外和由外而内的信号通路介导细胞与细胞外环境之间的信息传递者[5]。如图1所示,Intergrin位于肌膜上,穿过膜内外与其他骨架蛋白结合发生作用。Intergrin分子是由两个子单元称为α(120~185 kDa)和β(90~110 kDa),迄今为止,超过24种不同的α和β链的组合已被识别,导致细胞外蛋白识别的高特异性[35]。β链主要负责细胞膜与细胞体的结合,而α链则更多地参与了与基质的相互作用。Intergrin的主要功能是细胞与基质的粘附和细胞间的接触,Intergrin作为一种膜受体,通过传递细胞环境的结构和组成信息,参与信号转导和细胞对微环境信号的反应[36]。Intergrin与细胞骨架有许多信号通路,如MAPK信号通路、RHO介导的信号通路、整合素-肌动蛋白间信号通路等[37]。研究发现,在由胞内向胞外传导信号的过程中,Talin在调节Intergrin胞外结构域结合配体亲和力上起着关键的作用。Talin与Intergrin亚基的胞质结构域结合,形成长C端杆结构域,与肌动蛋白细胞骨架形成多重连接。Talin头域通过与细胞质尾部结合激活整合素β-integrin和酸性膜磷脂。磷脂酰肌醇4,5-二磷酸(PIP2)可增强Talin在质膜上的附着,从而诱导Talin构象改变,暴露Intergrin结合位点[38]。
有个形成滴水通道的假说:在屠宰后的最初几个小时内,胴体进入僵直状态,肌肉纤维收缩,水从各个肌原纤维之间被挤出,肌肉纤维表面的钙蛋白酶被激活,Intergrin被降解,细胞膜脱离纤维,形成滴水通道,然后,水会填补这些空隙,并很容易以水滴的形式流失[39]。然而,如果calpain介导的Intergrin降解发生在开始变硬之后,那么从纤维中挤出的水分就会被排出到周围的结缔组织中。由于结缔组织本身具有固有的锁水能力,液体更好地保留在组织中,最终滴水损失减少[40]。李华健等[41]研究表明宰后3、9、24 h肉品的汁液流失率与Intergrin的表达水平呈显著负相关。随着宰后猪肉中pH的降低,Intergrin的降解会增加汁液流失。由于Intergrin是跨膜蛋白,如图1所示,Intergrin的降解会造成膜和黏附结构被破坏,肌细胞/膜的相互作用减弱,形成汁液通道,增加汁液流失。Zhang等[42]报道,宰后24 h Intergrin的完整性与宰后24及120 h的滴水损失呈显著负相关,相关系数分别是−0.3022和−0.2864。Intergrin的降解,尤其是Intergrin的β亚基的降解,削弱了细胞膜与细胞的黏附作用,导致水分更容易从细胞膜与细胞的缝隙中流失。在肌肉组织中,从细胞骨架到细胞外基质的连续连接是由两个特定的蛋白质家族组成的,它们分别是肌营养不良蛋白/肌营养不良聚糖复合物和Intergrin。细胞膜通过两种主要类型的粘附复合物附着在细胞体上,这两种粘附复合物是含Intergrin的局灶性粘附和蛋白的营养不良蛋白/营养不良聚糖合物。Intergrin是负责细胞膜粘附在细胞骨架上的主要成分之一[5]。从以上研究可知,Intergrin的特殊位置对肉品的汁液流失影响较大,在形成汁液流失通道中有着重要的作用。
3 影响骨架蛋白降解的因素
3.1 钙蛋白酶系统(calpain)
钙蛋白酶启动骨架蛋白的降解,在肉质调控方面发挥着重要作用,图1就显示着钙蛋白的降解作用。钙蛋白酶主要位于肌肉纤维Z盘附近和肌质网膜上,calpain蛋白分解系统至少包括4种成分。其中:微摩尔浓度的钙离子可激活μ-calpain,也称为calpain-1;calpain-2是只有毫摩尔浓度的钙离子可激活,也称m-calpain;calpain-3是骨骼肌中特有的酶,存在于带皮的纤维和骨骼肌肌浆中,可被钙离子激活;calpastatin,它是μ-calpain和m-calpain的抑制蛋白,是钙激活蛋白酶的抑制因子,对调控calpain的活性有重要作用。屠宰后,肌肉肌浆内钙离子浓度升高,钙蛋白酶发生自溶,μ-calpain和m-calpain都由80 kDa大亚基分别变成了76和78 kDa亚基,2种钙蛋白酶的28 kDa的亚基降解为18 kDa的亚基。钙蛋白酶自溶后则发挥活性,启动了肌肉蛋白质的降解。因此,调控钙离子浓度对钙蛋白酶的激活有重要的意义[43]。钙蛋白破坏肌肉超微结构、Z线弱化并消失,促进肌原纤维小片化,改善肌肉嫩度和持水性。Bee[44]等报道,高pH更容易激活μ-钙蛋白酶的自溶,生成更多的76 kDa亚基,启动细胞蛋白质降解。钙蛋白酶自溶后,降解蛋白质,但钙蛋白酶的活性位点含有组氨酸和半胱氨酸残基,很容易受到自由基的攻击而失活或活性降低[45]。
3.2 组织蛋白酶(lysosomal cathepsins)
组织蛋白酶是参与细胞内蛋白质分解代谢以及其他各种生理和病理过程的溶酶体肽酶[46]。组织蛋白酶存在于溶酶体中,溶酶体被破坏后释放出组织蛋白酶参与蛋白的水解过程。与钙蛋白酶相比,组织蛋白酶在宰后胴体pH下降后中发挥着重要的作用[47]。丰永红等[48]研究发现,畜禽在宰后成熟过程中,组织蛋白酶的活性基本呈现先升高后下降的趋势,组织蛋白酶B、L活性远高于组织蛋白酶H活性。组织蛋白酶L活性较组织蛋白酶B活性更高,蛋白水解作用更大。Baron等[49]实验发现,钙蛋白酶会先破坏Desmin的结构,组织蛋白酶会将产物降解为更小的肽类。颜龙杰等[50]研究凡纳滨对虾组织蛋白酶L对肌肉蛋白降解过程中发现,分子量大于60 kDa的蛋白均出现降解,其中肌球蛋白重链最先发生降解,并在180 min之内基本降解完全。可见组织蛋白酶在宰后成熟中降解肌原纤维发挥着重要的作用。研究表明,在应激过程中pH下降,可能促进溶酶体、线粒体和肌原纤维的膜通透性解体,使得组织蛋白酶快速释放到肌原纤维中,促进肌肉降解[51]。这就解释了组织蛋白酶存在于溶酶体中不能与肌原纤维快速接触却能够被其降解的原因。
3.3 细胞凋亡酶(caspase)
细胞凋亡酶是半胱氨酸蛋白酶,目前已经发现了14种,主要在细胞凋亡过程中发挥作用。宰后肌肉细胞主要是以凋亡的方式死亡且细胞凋亡酶3、6和7等参与细胞蛋白质的降解,也参与宰后肉品成熟过程。有实验证明,细胞凋亡酶3、7和9在宰后0和32 h的活性变化比率与肉的嫩度显著相关[52],而前文提到嫩度与肉品的持水性有相关性,从而细胞凋亡酶对持水性有一定的影响作用。将细胞凋亡酶3与肌原纤维蛋白进行体外孵育发现,肌钙蛋白和Desmin等会出现降解。自然成熟条件下,加入caspase-3的专一性抑制剂可以抑制Desmin、伴肌动蛋白等的降解。随着宰后时间的延长,caspase-3逐渐失活,并且活性变化与剪切力变化之间相关性不显著[53]。贾青等[54]在牦牛肉中加入caspase-3抑制剂(Ac-DEVD-CHO)观察肌原纤维降解,实验发现宰后12 h后caspase-3抑制剂对牦牛肌原纤维降解抑制效果显著。宰后120 h后肌原纤维出现不同程度降解,caspase-3抑制剂几乎无抑制效果。而Tian等[20]人的研究发现,加入caspase-3抑制剂(Ac-DEVDCHO)处理组和对照组肉品相比,未见完整Plectin和降解Plectin的显著差异,可以推测完整Plectin及其降解产物可能不是死后猪肉中caspase-3的底物。对于加入calpain抑制剂(MDL-28170)的处理组,含有抑制剂中有明显高强度的完整的Plectin,而对照组中几乎消失,说明Plectin的降解主要是由calpain降解的。由上所知,细胞凋亡酶能够加速肌钙蛋白和Desmin的降解,对Plectin无明显降解作用。因此,细胞凋亡酶对蛋白降解底物具有选择性和特异性。
3.4 蛋白质亚硝基化
蛋白质亚硝基化是指一氧化氮及其衍生物修饰蛋白质中的半胱氨酸残基生成亚硝基硫醇的过程。蛋白质亚硝基化能够降低骨架蛋白对钙离子的敏感性以及抑制肌球蛋白ATP酶的活性[55],主要通过调节细胞内钙离子浓度,钙蛋白酶需要钙离子的激活才能发挥水解活性,最终影响着蛋白的降解。李玉品[56]等人研究发现GSNO(一氧化氮供体亚硝基谷胱甘肽)修饰的肌原纤维蛋白改变了其对钙蛋白酶的敏感性,提高了Desmin和肌联蛋白降解程度(P<0.05),抑制了肌钙蛋白的降解程度(P<0.05)。张朝阳[57]等用GSNO和一氧化氮合成酶抑制剂N-单甲基-L精氨酸乙酸酯(L-NAME)调控宰后成熟过程中牛肌肉细胞内一氧化氮的含量,探究蛋白质亚硝基化对牛肉品质的影响。通过电镜观察肌纤维结构发现,在成熟第7 d,与对照组GSNO处理组相比,L-NAME处理组的肌纤维M线已不可辨认、Z线模糊不清、结构完整度下降。这表明蛋白质亚硝基化能够提高牛肉中蛋白质的氧化水平,减少肌纤维结构的破坏。L-NAME处理降低了蛋白质硝基化程度,可以降低牛肉的极限pH和持水力,提高牛肉嫩度和亮度值。
3.5 热休克蛋白(HSPs)
热休克蛋白是蛋白质组装与拆卸、蛋白质折叠与展开以及受损蛋白的再折叠过程中必不可少的分子伴侣。它们在保护细胞和结构方面发挥重要作用,并具有抗凋亡活性[58]。HSP有5大类,分别为小分子量HSP家族(泛素、HSP10、αβ-crystallin、HSP27、HSP32、HSP27)、中等分子量HSP家族、HSP70家族、HSP90家族和HSP110家族,其中αβ-crystallin是sHSP家族中的重要成员,它保护细胞骨架蛋白免受各种应激因素的损伤、防止蛋白变性和使变性的蛋白恢复折叠,具有分子伴侣作用,HSP27也可参与细胞的增殖、分化及细胞凋亡的信号转导调节等。HSP27对ROS(Reactive oxygen species)有抑制作用,也可以表达为对骨架蛋白的保护作用,减少蛋白的降解[59]。Balan等[60]以低、中、高pH的牛肉研究sHSP对肌肉质量的影响,发现宰后第1 d,与低pH牛肉相比,在中pH牛肉中观察到更完整的sHSPs。此外,sHSP 20和27的降解与肌原纤维蛋白Desmin和肌钙蛋白的降解之间存在高度显著的相关性。孙金龙等[61]在研究HSP27对肌原纤维影响时发现HSP27能够通过抑制caspase-3、caspase-9的活性来抑制肌原纤维小片化的发生和Desmin和肌钙蛋白的降解。同时发现,Hsp27能够抑制μ-钙激活酶和Caspase-3对肌原纤维蛋白的降解,如图1所示。
4 结论
持水性影响着肉品的加工特性、感官性质和经济效益。肌肉纤维的结构变化与肌肉的持水性密切相关,其中骨架蛋白的降解直接影响到肉品的持水性,本文主要探究了Dystrophin、Plectin、Desmin、Talin、Intergrin等近年来研究发现的主要骨架蛋白的作用机制及对肉品持水性的影响。钙蛋白酶、组织蛋白酶、细胞凋亡酶、蛋白质亚硝基化、热休克蛋白等,这些因素形成了一个复杂系统共同影响着骨架蛋白的降解。
目前对于影响骨架蛋白降解的因素以及骨架蛋白与肉品持水性关系的研究还有待进一步研究确认,蛋白酶系统的交互作用对于肌肉持水性的影响仍旧是亟需探索的研究方向。通过调控宰后肉品的骨架蛋白降解,提高肉品的持水性,获得优良的肉产品,是肉品行业重要的研究方向。
