脑-肠轴与精神疾病肠道微生物的研究进展
2021-09-29李瑞盈鄢明辉游春苹
李瑞盈,鄢明辉,游春苹,
(1.光明乳业股份有限公司乳业研究院,上海乳业生物工程技术研究中心,乳业生物技术国家重点实验室,上海 200436;2.上海海洋大学食品学院,上海 201306)
所有的多细胞生物都与其周围的微生物有紧密的联系,当然人类也不例外。人体中除了存在着大量的细菌外,还有古生菌、病毒和单细胞真核生物[1]。据估计,人体内的细菌细胞数量高达3.8×1013个,高于人体细胞数量的3.0×1013个[2]。微生物普遍分布于人体的各个部位,如皮肤、呼吸道、胃肠道、泌尿生殖系统等。其中在胃肠道(Gastrointestinal Tract,GIT)中分布最多[2];据估计,结肠本身就含有人体70%以上的微生物[3]。此外,GIT是细菌定居的首选场所,因为其中含有丰富的可以被微生物生长代谢所利用的营养物质。
近年来,对于肠道菌群的研究不断深入,众多研究表明肠道菌群与机体的健康息息相关,肠道菌群与神经类精神疾病的联系也是非常紧密的。属于厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和双歧杆菌门(Bifidobacterium)的常见肠道菌群可能会导致机体精神障碍[4]。人体营养不良、肠道活力下降和过多给药都可能引发微生物群的改变[5]。肠道菌群的改变通常被称为肠道菌群失调/微生物菌群失调,这种不平衡也会影响这些微生物产生的副产物,如短链脂肪酸(Short Chain Fatty Acid,SCFA),甚至神经递质,再通过脑-肠轴(Gut – Brain Axis,GBA)对大脑产生影响[6],从而引发相关的精神疾病。本文旨在探讨肠道微生物对于常见精神疾病作用的可能机制,并重点对这几类常见精神疾病与肠道微生物的关系以及其肠道菌群的变化进行论述。
1 肠道微生物
人体肠道内的微生物对宿主的新陈代谢起着至关重要的作用,是一个由数万亿细菌组成的器官,这些细菌主要分布在远端结肠。肠道微生物群平均重1.5 kg,携带的基因至少是人体宿主的150倍[7]。人体肠道微生物的种类很多,不仅包括最常见的细菌,还包括病毒和真菌,它们与宿主之间具有不对称的生物关系,其数量至少比人体细胞多一个数量级[8]。2012年发表的《人类微生物组项目联盟》揭示,人类肠道的主要菌门是拟杆菌属(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)[9]。
肠道菌群对人的生理和营养状况有许多有益作用,其中包括生产维生素的能力,以及将难以消化的纤维转化为人体代谢所需的形式的能力[10]。一般来说,微生物代谢物可能对宿主的健康产生局部和系统的影响。这些代谢物,如短链脂肪酸和维生素,可能与肠上皮相互作用,改变其功能;如果这些化合物被吸收到血液循环中,就会对宿主的新陈代谢和健康产生全身性影响[11]。显然,肠道菌群可以通过不同的机制与人体相互作用。
2 脑-肠轴的双向调控机制
脑-肠轴(brain-gut axis,BGA)是神经系统和胃肠道之间进行双向信号沟通的调节系统。其基本组成包括中枢神经系统(Central-Nervous System,CNS)、自主神经系统(Autonomic-Nervous System,ANS)、下丘脑-垂体-肾上腺轴(Hypothalamic-Pituitary-Adrenal Axis,HPA)和肠道神经系统(Enteric-Nervous System,ENS)等,各组分之间相互影响,相互作用(见图1)。脑-肠轴调节应激反应的过程涉及神经通路、免疫机制和内分泌机制。脑肠轴之间的另一个重要参与者就是存在于人类消化道的微生物群落,胃肠道内信息的变化会通过迷走神经,交感神经等传递到CNS,经过大脑相关区域的整合,发送指令并通过交感神经,副交感神经等作用于外周的器官,以反馈调节的方式调控胃肠道环境。

图 1 肠道微生物群产生的信号会影响脑-肠轴[12]Fig.1 Signals produced by the intestinal microbiota affect the brain-gut axis[12]
2.1 神经解剖通路
肠壁上面有很多的肠神经,它们可以把肠道消化、吸收、免疫的信息,通过肠神经上行到大脑的内脏中枢—丘脑,所以大脑可以接受到我们肠道的很多信号。肠道菌群与大脑之间的相互神经通讯作用一般是通过迷走神经实现。即肠道菌群在刺激ENS的传入神经元时[13],肠道会通过迷走神经信号对抗炎反应产生刺激,从而防止引起炎症。目前,在动物实验中发现肠道菌群能够激活迷走神经,该激活作用在调节对大脑的影响以及后面的行为有重要的作用[14]。来自肠道的某些迷走神经信号可以引发抗炎反射,从而向大脑发出传入信号,激活传出反应,释放出乙酰胆碱,再通过与免疫细胞的相互作用,从而减弱微生物炎症。同时,大脑作为机体的中枢,也可以通过迷走神经去影响肠道的功能。最近Han等[15]研究发现,迷走神经能够通过调控小鼠的摄食行为从而减轻肠道炎症症状。小鼠右侧大脑迷走神经感觉神经节被激活,促进了小鼠的摄食行为,且减轻了肠道炎症反应。Bonaz等[16]已通过刺激迷走神经,使炎症性肠病患者的临床症状得到了缓解。另外,Ghia等[17]的研究发现迷走神经还可通过改变肠腔的渗透性从而改变肠道环境。
2.2 神经内分泌HPA轴通路
作为神经内分泌系统的下丘脑-垂体-肾上腺轴(Hypothalamic-Pituitary-Adrenal Axis,HPA),能够掌控激素对机体内外部产生的反应[18−19]。肠道菌群有助于神经内分泌的成熟,微生物群可以通过各种通讯方式控制外周和中枢神经系统的活动,包括迷走神经的激活、细胞因子的产生、神经肽和神经递质的释放、短链脂肪酸的释放和微生物代谢产物的释放,并利用淋巴和体循环。若这些信号穿过血脑屏障然后到达大脑,就会使小胶质细胞激活,使其在免疫监控等方面发挥作用,包括HPA轴激活状态的调节。当HPA轴被激活,会释放出糖皮质激素,该激素能够调节大脑小胶质细胞的状态,使其激活,进而影响细胞因子的释放以及单核细胞的运输(见图2)。

图 2 微生物对神经炎症和HPA轴活性的调节示意图[19]Fig.2 A schematic diagram of microbial regulation of neuroinflammation and HPA axis activity[19]
同样的,肠道菌群的组成受应激反应和HPA轴的调控[20]。有研究[21]指出在慢性压力状态下,HPA系统的激活以及促肾上腺皮质激素释放因子(Corticotropin-Releasing Factor,CRF)和糖皮质激素的释放可以对胃肠黏膜起到保护作用。
2.3 肠道免疫系统
肠道淋巴组织中的免疫细胞占整个机体的70%~80%,肠道上皮细胞可以通过识别不同的微生物信号分子从而产生免疫反应。肠道微生物群是肠道免疫系统发育的基础[22−23]。肠道上皮细胞通过多种Toll样受体(Toll-like receptors,TLRs)识别不同肠道微生物组成状态下的相关分子模式。在健康的机体中,肠道菌群能够利用配体和代谢产物对肠上皮细胞和肠道免疫细胞直接产生作用,从而使宿主-菌群维持共生稳态[24]。肠道免疫细胞也直接或间接地控制微生物群落[25]。另外,大脑中的小胶质细胞、巨噬细胞和树突状细胞表面的TLRs也可以对存在于血液循环中的不同类微生物的相关分子模式产生免疫应答,通过释放细胞因子从而对大脑产生影响[26]。老年人免疫功能的下降,会引起肠道微生物群的改变。因此,肠道菌群通过免疫系统和大脑之间的交流是双向的相互作用。
3 肠道菌群与精神疾病
3.1 重度抑郁症(Major Depressive Disorder, MDD)
重度抑郁症(MDD)是常见的精神疾病,与合并症、健康不良和死亡率相关[27]。近年来,新兴的研究领域揭示了抑郁和肠道微生物群之间的联系[28]。目前已有大量证据表明,肠道菌群平衡失调会影响抑郁症发病机制中涉及的病理生理通路[29−30]。粪菌移植(Fecal Microbiota Transplantation, FMT)作为一种重建菌群的方法,常被用于研究肠道菌群的研究中[31]。Cheung等[32]将MDD患者的细菌移植到啮齿动物身上会产生类似抑郁的行为,并发现50个肠道细菌类群在MDD患者和对照组存在差异(P<0.05)。
Guida等[33]在小鼠中使用广谱抗生素会导致生物失调、产生类似抑郁的行为,并改变海马神经元的放电,在用干酪乳杆菌进行益生菌治疗后,这种表型发生了逆转。Kelly等[34]在进行转化研究中发现,移植患有重度抑郁症患者肠道内的微生物群到无菌或体内缺乏此类微生物的啮齿动物会使其表现出类似于抑郁的表型,机体会表现出缺乏快感和焦虑的行为,而在移植了健康微生物的对照组中没有出现此类现象。在最近的一项研究中,研究人员招募了30名抑郁症患者和30名健康对照组,对粪便微生物群进行了测序。高通量焦磷酸测序显示,在那些目前患有抑郁症的人身上发现粪便细菌的α-多样性增加了以及拟杆菌门(Bacteroidetes)、变形杆菌门(Proteobacteria)和放线菌门(Actinobacteria)的数量也有所增加,而厚壁菌门(Firmicutes)数量明显减少。抑郁症和焦虑症是两种密切相关的精神障碍疾病,研究中发现具有正常特异无致病性菌群的生长型小鼠比GF小鼠焦虑和活跃程度低;这表明益生菌可以减少焦虑行为[35]。
对啮齿动物的研究表明,抑郁症可通过改变肠道环境,使脂多糖(LPS)和其他分子进入血液,从而刺激toll样受体,产生炎症细胞因子。而抑郁与白介素、肿瘤坏死因子(TNF-α)、和c反应蛋白等炎症生物指标的升高有关[36]。重度抑郁症表现出HPA轴的异常,包括皮质醇的分泌和反应性增加以及垂体和肾上腺的体积和活性增加。将抑郁症患者的肠道菌群移植到无菌小鼠体内,出现海马区Stat5a基因的下调。Stat5a基因参与调节HPA轴的反应[37]。研究发现,在大鼠的强制游泳试验中,益生菌的治疗可以减轻类似抑郁的症状,并导致海马中与HPA轴调节有关的转录本水平下降[38]。研究发现[39],双歧杆菌(Bifidobacterium)CECT 7765会影响神经内分泌功能,从而使小鼠的快感缺乏。近期研究表明,植物乳杆菌299v对重度抑郁症患者在注意力和语言学习方面的认知能力有所提高,并导致犬尿氨酸途径的有益改变[40]。
3.2 精神分裂症(Schizophrenia, SCZ)
精神分裂症是一种严重的精神疾病,以精神病为特征,其中内脏-大脑轴的参与早已被认识[41−42]。对精神分裂症患者口腔样本微生物菌群的分析发现,与正常对照组相比,这些患者的微生物菌群明显含有更多的乳酸菌(Bifidobacterium)[43−44]。进一步的分析表明,乳酸菌群的增加与精神分裂症患者不同症状域的严重程度显著相关[44]。基于这些研究,微生物组成与精神分裂症之间很可能存在一种关系。
Zhu等[45]在精神分裂症患者菌群中发现,兼性厌氧菌和口腔菌增多,短链脂肪酸合成、色氨酸代谢、多种神经递质的合成或降解等功能潜力发生改变。移植患者中富集的前庭链球菌,可以诱导小鼠的精神分裂症样行为、改变外周神经递质水平。Zheng等[46]发现与健康对照组相比,未用药和用药的SCZ患者微生物组α-多样性指数下降,肠道微生物组成明显紊乱。几种独特的细菌类群(如韦荣氏菌科(Veillonellaceae)和毛螺菌科(Lachnospiraceae))与SCZ的严重程度相关。SCZ患者体内微生物群本身可以改变神经化学和神经功能,其方式可能与SCZ病理相关。肠道微生物可以通过谷氨酸的代谢通路的异常和脑肠轴机制来影响精神分裂症的发病。把精神分裂病人的粪菌移植到抗生素干预的无菌小鼠体内后,小鼠表现出空间认知能力的下降。在门水平上,Shen等[47]发现变形菌门的丰度在精神分裂症患者体内有明显地增加,且伴随着系统性炎症反应标志如IL-6、IL-8、IL-1β和TNF-α的增加。
精神分裂症的发病机制尚不完全清楚;然而,脑源性神经营养因子表达的减少以及由此导致的n-甲基-d-天冬氨酸(NMDA)受体[48]的低活性与精神分裂症的病理有关。越来越多的证据表明,免疫系统可能在精神分裂症的发病中发挥重要作用。巨魔样受体(TLR)介导先天免疫应答。其中TLR4对脂多糖(LPS)产生反应并触发炎症反应,脂多糖是革兰氏阴性菌外膜的重要组成部分。由于TLRs参与维持肠上皮内稳态,并保护机体免受共生细菌免疫反应的伤害,因此TLRs能够识别健康受试者的肠道微生物群[49]。然而,TLRs与肠道菌群之间的异常相互作用可能导致慢性炎症,因此,作为精神分裂症的一个特征,微生物群组成的变化可能会引起TLRs介导的免疫反应,从而导致精神分裂症的症状。
3.3 自闭症谱系障碍(Autism Spectrum Disorder,ASD)
自闭症谱系障碍(ASD)是一种广泛性的神经发育障碍,会出现社交与互动障碍,以及重复性的刻板行为。在美国ASD在儿童和青少年中的患病率达到1/59[50]。肠道微生物群被认为在自闭症谱系障碍中起重要作用。肠道菌群在患有自闭症谱系障碍和正常发育的对照组之间存在差异[51]。在ASD动物模型中,特异性肠道微生物也显示出了其治疗潜力[52−53]。
Hsiao等[54]对患有自闭症谱系障碍的母体免疫激活(Maternal Immune-Activation,MIA)模型进行了益生菌治疗的临床前研究,该模型显示出了自闭症行为或肠道菌群异常的胃肠道疾病。在MIA子代临床前模型实验中,口服了脆弱拟杆菌(Bacteroides fragilis)之后肠道的通透性得到了改善,肠道微生物也在一定程度上有所恢复且使自闭症行为有所改善,说明微生物调节是一种有效且安全的ASD治疗方法。有趣的是,在早期的模型中,只有脆弱拟杆菌能够改善焦虑、刻板印象和交流障碍行为,这表明益生菌治疗需要一定的特异性[55]。近期一项研究纳入了30例5~9岁的ASD患者,对其进行了3个月含有嗜酸乳杆菌、鼠李糖乳杆菌和长双歧杆菌的配方补充,然后通过自闭症治疗评估清单(Autism Treatment Evaluation Checklist,ATEC)进行评估。益生菌治疗后的ATEC整体评分显著下降(P=0.0001),自闭症症状的严重程度显著下降(P<0.0001)[56]。Tomova等[57]检测了斯洛伐克儿童体内的微生物群。自闭症患儿粪便微生物菌群中拟杆菌门(Bacteroidetes)/厚壁菌门(Firmicutes)比值明显降低,乳酸菌属(Lactic acidbacterium)数量升高,脱硫弧菌属(Desulfovibrio)轻度升高,与自闭症严重程度相关。益生菌饮食使拟杆菌门(Bacteroidetes)/厚壁菌门(Firmicutes)比值和脱硫弧菌属(Desulfovibrio)水平正常化。
研究报告ASD患者有一种特殊的胃肠道表型,其特征是肠道通透性增加和肠道免疫功能异常[58]。越来越多的证据表明,ASD的患者经常受到胃肠道问题和肠道菌群发育不良的影响,其症状包括腹泻/便秘、腹痛和胃反流。ASD患者会出现免疫系统损伤[59],如血液中促炎细胞因子水平升高、免疫细胞功能失调或针对脑蛋白的抗体的存在。研究表明促炎细胞因子的增加与一些行为症状的严重程度相关。肠道菌群和免疫系统是内在联系的。免疫系统的主要组成功能是控制微生物群和增强肠道屏障。反过来,微生物群对免疫系统也有直接影响,因为细菌代谢物贯穿整个生命周期,可以影响免疫细胞的分化,或调节它们的活性。更具体地说,是通过T调节细胞(Treg)和效应T细胞(如肠道中的T辅助细胞(Th))之间的平衡[60],Treg/Th17平衡可能受到微生物群变化的影响[61]。
3.4 其他精神类疾病
阿尔茨海默病(Alzheimer’s disease,AD)是以痴呆表现为特征的一种疾病,与认知受损和脑淀粉样蛋白(Amyloid-βPeptides,Aβ)积累有关。通过对患有和未患有AD实验组粪便样本中细菌组成的分类鉴定,发现AD患者的肠道微生物多样性已经减少[62]。临床研究表明,在Aβ样变的认知受损老年患者中,与大量的促炎菌属(如大肠杆菌(Escherichia coli)/志贺氏菌(Shigella))相比,脆弱拟杆菌(Bacteroides fragilis)和直肠真杆菌(Eubacterium rectale)这两种具有抗炎活性的细菌在肠道中的丰度较低。因此,对利用益生菌来预防或减缓AD的研究是非常有意义的[63]。肠道微生物的改变所导致的炎症反应会引起血脑屏障的完整性发生变化,进而影响认知行为。研究也发现AD患者血浆内LPS浓度是正常机体的3倍,这使肠道屏障受到破坏,肠渗透性增加的结果。研究发现血清素(5-HT)能抑制Aβ斑块的形成[64],从而减轻患AD风险。血清素(5-HT)95%在肠内合成,因此肠道微生物对5-HT起着很重要的作用。
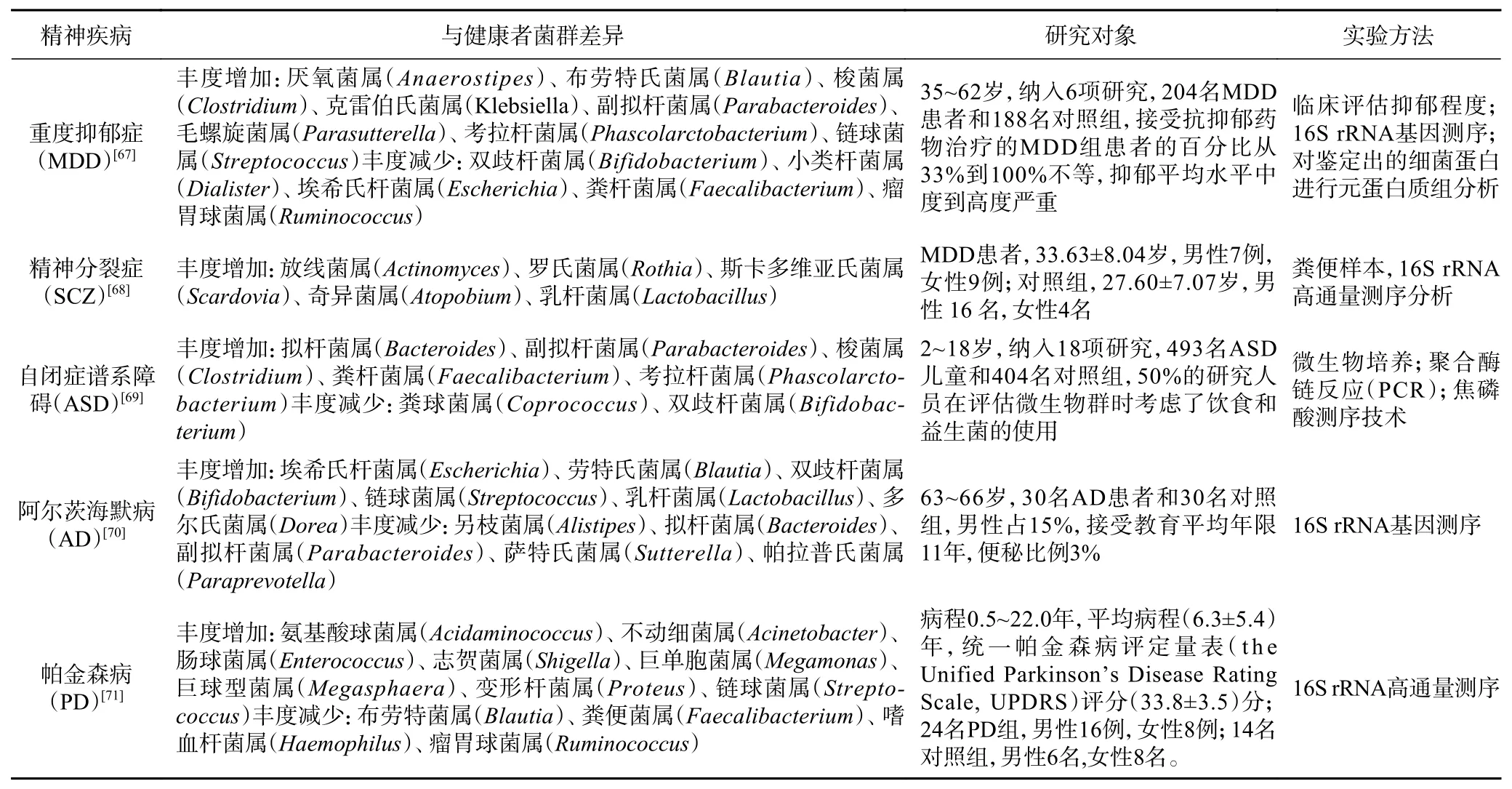
表 1 精神疾病患者与健康者菌群差异Table 1 Difference of microflora between neuropsychiatric diseases and healthy people
帕金森病(Parkinson’s Disease,PD)治病机制复杂,其α-突触蛋白变化是该病的重要致病机制。患者肠道菌群特征表现为碳水化合物发酵和丁酸合成能力降低,蛋白水解发酵和有害氨基酸代谢产物的产生增加[65]。研究PD患者的肠道微生物群,发现了一些常见的微生物群落改变,如PD患者中的毛螺菌科(Lachnospiraceae)减少和疣微菌科(Verrucomicrobiaceae)增加[66],普雷沃菌科(Prevotellaceae)减少。而普雷沃菌科(Prevotellaceae)作为肠内共生细菌,可以促进肠道神经粘膜层的生成,当其减少将导致肠道通透性增加,使局部和系统受到内毒素的入侵,从而导致α-突触蛋白的错误折叠和表达。精神疾病患者与健康者菌群差异见表1。
4 结论与展望
肠道菌群和大脑,情绪、认知行为存在着密切的关系,像抑郁症、焦虑症、精神分裂症、自闭症、阿尔兹海默症和帕金森症等精神类疾病,目前已经被发现和肠道菌群存在着密切的关系。脑肠轴在疾病病理的机制过程当中起到一个非常重要的作用,但是现有的研究还是不够的,因为对机制的研究以及通路的研究,还不能够很好地解释肠道微生物如何去影响精神疾病的发病。所以,在菌群的研究当中,要以多组学研究来研究炎症性肠病;并通过多组学研究,来研究这些健康人群是如何发展为一个精神疾病的;以及在人类生命周期当中,出生之前以及出生后胎儿的肠道菌群的动态的改变。未来在大样本的队列研究、菌群移植、多组学的分析以及临床转化当中,可以更好地去深入研究该领域,能够为精神疾病的发病机制的揭示提供更多的科学依据。饮食似乎是肠道菌群变化最大的原因,可以影响占优势的菌属,因此后续的研究可将对精神疾病起作用的益生菌添加到酸奶等食品中,通过改变精神疾病患者的膳食,进一步研究其对此类精神疾病的作用效果及机制。
