HF溶液和HF-F−溶液的多重平衡计算
2021-09-26张颖权新军
张颖,权新军
吉林大学化学学院,长春 130012
水溶液中的离子平衡是无机化学、普通化学课程的重点内容,在教学中占有重要地位。但在以往教学中对主反应关注较多,而对在某些情况下与主反应同时存在的次反应关注较少(这里所说的主反应是指人们在通常情况下关注度高的反应,次反应是指关注度低的反应,而与反应的重要性无关)。HF水溶液、HF-F−溶液便属于这种情况,在平衡计算时常常关注的是HF的解离反应,而很少关注HF与F−的化合反应,以至于学生在遇到这类问题时往往会忽略后者,从而得出错误结果。本文从多重平衡的角度对HF水溶液以及HF-F−体系水溶液离子浓度的计算展开讨论,希望能为培养学生全面分析问题的能力,解决离子平衡复杂计算提供一点参考。
1 问题的由来

2 HF水溶液氢离子浓度的计算


式(12)中,Ka⊖= 6.3 × 10−4,Ka⊖′ = 5.2,在一定范围内只要给定c值,便构成一元三次方程,该方程可以用一元三次方程在线计算器方便地求解。解出[F−]值后将其代入式(9),可求出[H+],再将[H+]、[F−]值代入式(3),即可求出[HF2−]。
为了比较仅考虑HF的解离平衡与同时考虑HF溶液中的两个平衡所得计算结果的差异,我们选取不同浓度的HF溶液(从1.0 × 10−3至1.0 mol·L−1,通常在无机化学计算中弱酸浓度不会超出这个范围),分别根据式(1) (c< 0.25 mol·L−1时)、式(2) (c >0.25 mol·L−1时)和本方法计算[F−]和[H+],并以本方法结果为准计算式(1)、式(2)所得结果的相对误差。结果见表1。
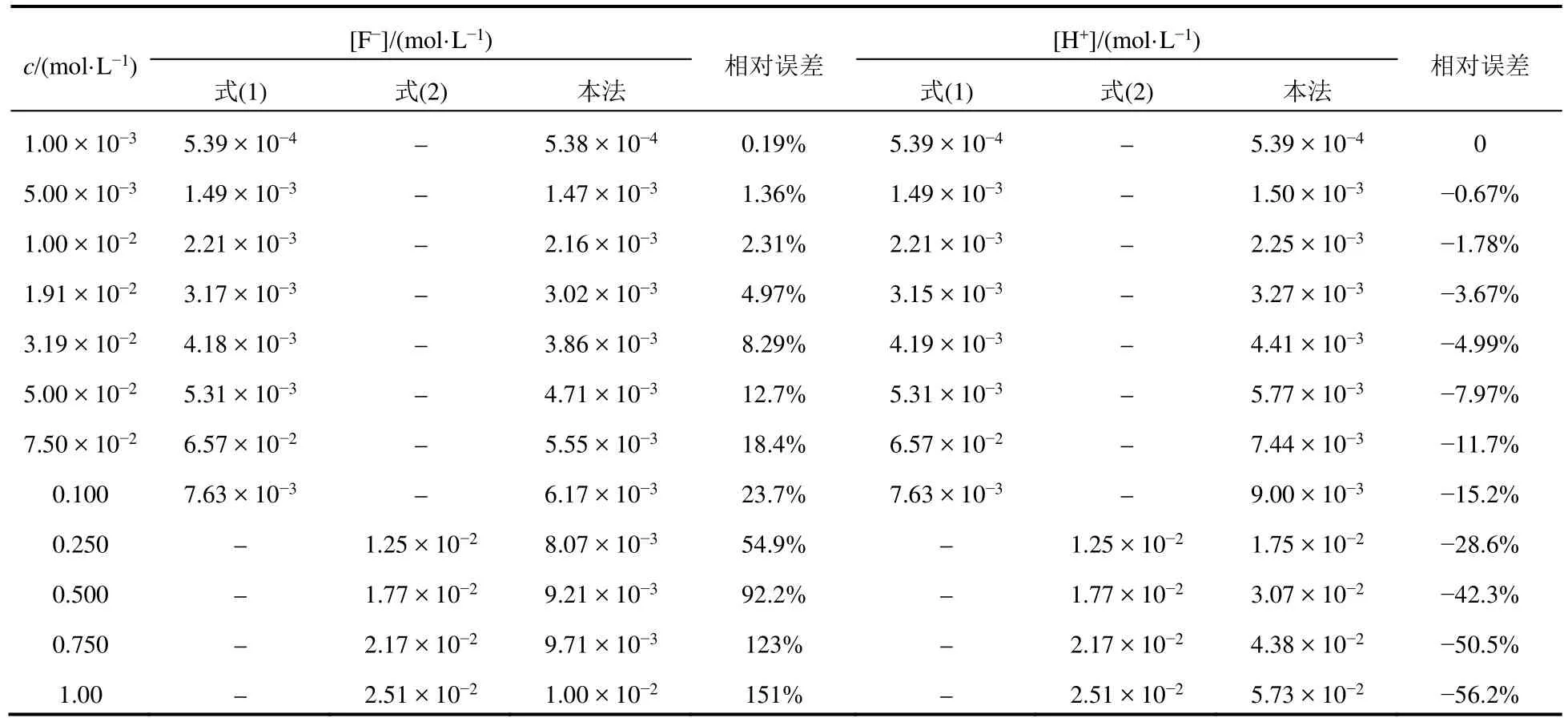
表1 HF溶液中F−和H+离子浓度的对比计算结果
由表1可以看出:
(1) 对于HF水溶液,无论是[F−]还是[H+],仅考虑HF的解离平衡与同时考虑HF溶液中的两个平衡相比计算结果总是存在误差(c=1.00 × 10−3mol·L−1例外是由于有效数字限制的缘故),且HF溶液浓度越大,相对误差越大。
(2) [F−]的误差为正误差,[H+]的误差为负误差。
(3) 当HF溶液浓度一定时,[F−]误差的程度大于[H+]误差的程度。
(4)c=1.91 × 10−2mol·L−1时,[F−]的相对误差为5%,刚好达到无机化学计算允许的最大误差,表明当c< 1.91 × 10−2mol·L−1时,可以近似地按一元弱酸同时计算F−和H+离子浓度,而当c≥1.91 × 10−2mol·L−1时,必须同时考虑HF溶液的两个平衡计算F−和H+离子浓度。
(5)c≥ 2.50 × 10−1mol·L−1时,c/Kaϴ≥ 400,按照一元弱酸离子浓度最简式计算的[F−]的相对误差大于等于54.9%,[H+]的相对误差亦大于等于−28.6%,远远超出无机化学计算允许误差要求,故最简式完全不适用于HF水溶液离子浓度计算。
3 HF-F−溶液氢离子浓度的计算

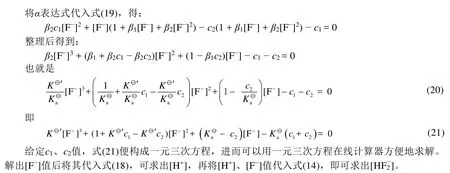
对于HF-F−溶液,人们主要关心的是氢离子浓度的大小。为了比较仅考虑HF的解离平衡与同时考虑HF溶液中的两个平衡所得计算结果的差异,我们首先固定c(NaF) = 0.100 mol·L−1,c(HF)从1.00 ×10−2mol·L−1变化至1.00 mol·L−1,然后再固定c(HF) = 0.100 mol·L−1,c(NaF)从1.00 × 10−2mol·L−1变化至1.00 mol·L−1,利用式(13)以及本文方法计算[H+],并以本方法结果为准计算式(13)结果的相对误差。结果见表2。
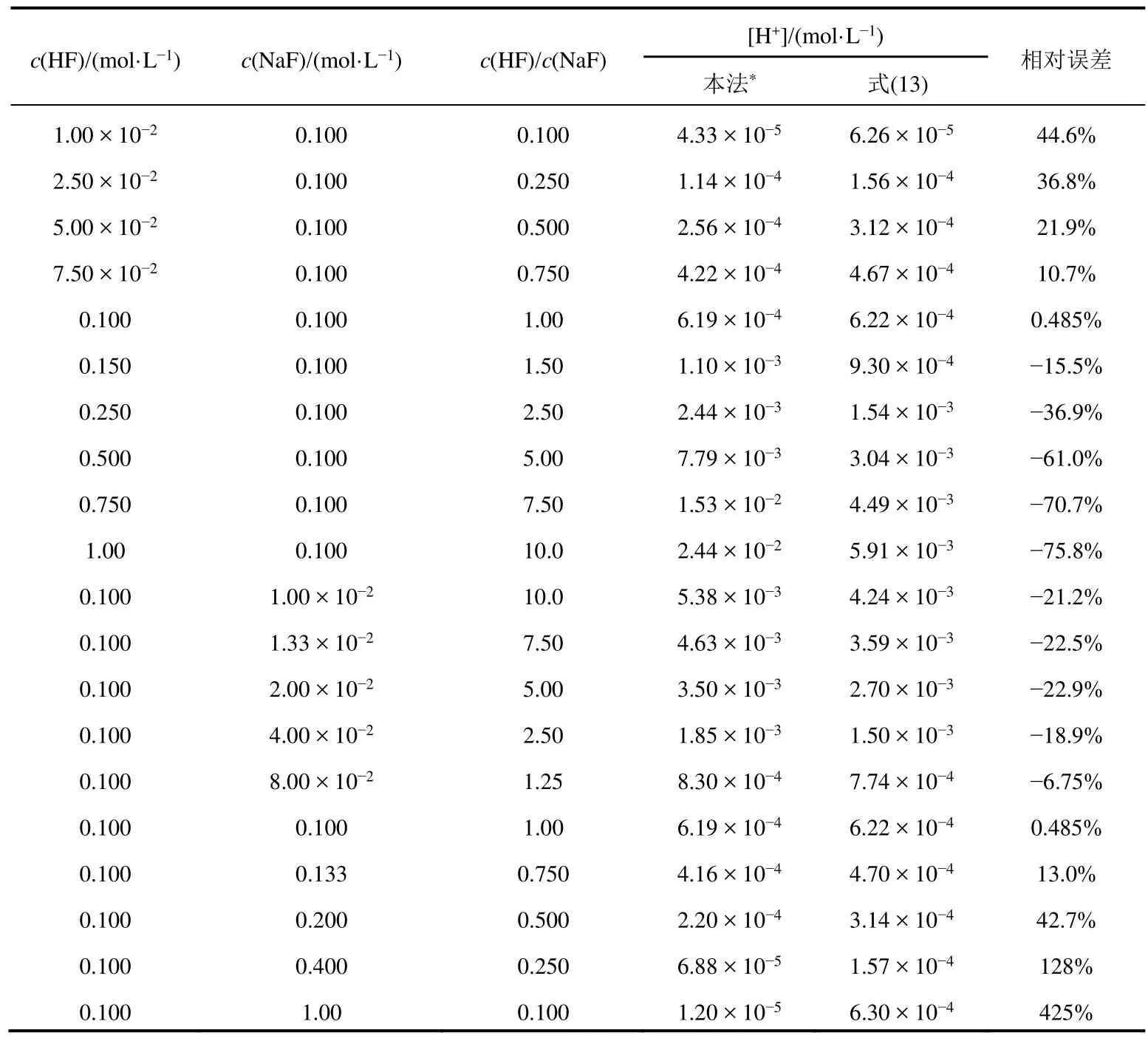
表2 HF-NaF溶液H+离子浓度的对比计算结果
由表2可以看出:
(1) 对于HF-F−溶液,在所讨论的浓度和比例范围内,采用式(13)与同时考虑HF溶液中的两个平衡相比计算结果总是存在误差,且相对误差的大小既与缓冲比c(HF)/c(NaF)有关,也与c(HF)和c(NaF)的大小有关。其中[H+]的相对误差以缓冲比等于1时为最小,当缓冲比偏离于1时相对误差都增大。
缓冲比等于1时[H+]的相对误差最小是由于HF与F-是以相同物质的量化合成HF2−的,换言之,反应(II)的存在对溶液的[HF]/[F−]值影响很小,因此对[H+]影响很小。
(2) 在我们所计算的20个溶液中,除了c(HF)/c(NaF) = 1时外,其他溶液仅考虑HF的解离平衡,与同时考虑HF溶液中的两个平衡相比[H+]计算结果相对误差都大于无机化学计算的允许误差,说明式(13)对于HF-F−溶液来说是不适用的。
需要说明,本文讨论的问题只针对无机普化教学,因而没有考虑离子强度变化对计算结果的影响。
4 结语
(1) 氢氟酸非一般意义上的一元弱酸,在HF溶液和HF-F−溶液中存在着HF的解离和HF与F−化合两个反应,溶液中各物种的平衡浓度都是两个平衡共同作用的产物,只有将两个平衡同时考虑才能得到正确的结果。
(2) 在多重平衡计算中选取有关平衡中相同离子的浓度做未知数有利于方程的消元,继而方便利用在线计算器进行计算。
(3) 对于HF溶液,只有当c< 1.91 × 10−2mol·L−1时,才可以近似地按一元弱酸同时计算[H+]和[F−],而最简式[H+]= (Ka⊖c)1/2完全不适合氢氟酸溶液中氢离子浓度的计算。
(4) 对于计算HF-F−溶液[H+]来说,除c(HF)/c(NaF) = 1时外,仅考虑HF解离平衡得到的计算公式是不适用的。
(5) 在离子平衡的计算中,要关注次反应对主反应的影响。除了本文所讨论的HF溶液和HF-F−溶液外,诸如计算AgCl在NaCl溶液中的溶解度、HgS在NaS溶液中的溶解度等也需要分别考虑[AgCl2]−、[HgS2]2−对AgCl、HgS沉淀溶解平衡的影响。这些过程既涉及比较复杂的计算,又涉及元素化合物的性质,对于培养学生全面分析问题的能力很有帮助。
