补肾化瘀生新方对缺血缺氧微环境下骨髓间充质干细胞生存率及凋亡率的影响❋
2021-09-26王诗琦惠小珊张金生袁书章
王诗琦, 惠小珊, 张金生, 袁书章, 薛 珂
(1.河南中医药大学, 郑州 450046;2.中国中医科学院广安门医院, 北京 100053;3.河南中医药大学第三附属医院, 郑州 450008)
BMSCs是一种具有多向分化潜能的成体干细胞,在临床脑梗死、急性心肌梗死等心脑血管疾病临床移植治疗中取得了一定的疗效。但梗死区微环境缺血缺氧对BMSCs的存活、分化等造成了不利的影响[1]。课题组针对微环境与干细胞的研究已经取得一定进展,进一步探索缺血缺氧微环境对BMSCs的影响,通过中药干预缺血缺氧微环境,提高BMSCs的生存率、分化率,可能对缺血缺氧性心脑血管疾病的治疗有一定的价值和意义。本研究以BMSCs为研究对象,建立缺血缺氧微环境细胞模型,动态观察不同时间点缺血缺氧微环境下BMSCs的状态,探究BMSCs在恶劣微环境下的渐变过程,再给予补肾化瘀生新方含药血清干预,对比缺血缺氧微环境下中药干预后BMSCs发生的变化,为中药复方调控缺血缺氧微环境,提高干细胞生存率,降低ROS损害和凋亡率提供实验依据。本研究经河南中医药大学伦理文员会批准,伦理编号DWLL2018030051。
1 材料
1.1 动物
SPF级SD雄性大鼠30只,体质量(180±10)g,实验动物合格证号SCXK(豫)2015-0005,由郑州大学医学院实验动物中心提供。在河南中医药大学第三附属医院实验动物中心饲养,饲养室内氨浓度<20ppm,通风清洁,明暗周期各12 h,自由摄食和饮水,定期更换垫料。
1.2 药品
补肾化瘀生新方组成:熟地黄12 g,当归12 g,巴戟天10 g,石斛10 g,川芎 15 g,肉桂3 g,甘草3 g,上述药物购于深圳市三九中医药健康产品有限公司。
1.3 主要试剂与仪器
High Glucose DMEM (广州赛业公司,批号RASMX-90011);1XPBS(北京索莱宝公司,批号P1020);Cell Counting Kit-8(日本同仁公司,批号JAPAN(CCK-8));Annexin V-FITC/PI Apoptosis Detection Kit(康为世纪,批号CW2574 S);活性氧(ROS)化学荧光法测试盒(Elabscience公司,批号E-BC-K138-F);H35低氧工作站(英国Don Whitley 公司);LHS-300SC 型二氧化碳培养箱(上海精密仪器仪表有限公司);U-RFLT50型荧光装置,CKX41 型倒置显微镜(日本奥林巴斯公司);BD FACSAria TM Ⅲ型流式细胞分选仪(美国BD公司)。
1.4 含药血清制备
SPF级SD雄性大鼠20只,结合前期课题组研究基础[2],给药剂量按照成人每日给药量的18倍计算,即为12.29 g/mL/100 g。连续7 d灌胃给药,早晚各1次,于第8天末次给药90 min后麻醉,腹主动脉采血至离心管,室温静置30 min,4 ℃离心机3500 r/min离心15 min,取血清于56 ℃恒温水浴锅灭活30 min,-80 ℃冰箱保存备用。
2 方法
2.1 BMSCs 的提取、培养及分离纯化
SPF级SD雄性大鼠10只,采用全骨髓贴壁法脱颈处死。于体积分数为75%乙醇中浸泡5 min,无菌条件剥离两侧股骨及胫骨,在4 ℃的DMEM/F12培养液中除去骨周围肌肉组织,剪去两侧骺端暴露髓腔,5 mL注射器适量吸取DMEM/F12培养液(含有10%FBS)缓慢反复冲洗骨髓腔,至髓腔变白反复吹打细胞悬液,使细胞均匀悬浮,15 ml注射器抽取适量完全培养基冲洗骨髓腔,200目灭菌钢筛过滤骨髓液至离心管,1280 r/min离心5 min,取3 ml细胞悬液接种于25 cm2培养瓶,于37 ℃、5% CO2饱和湿度恒温培养箱内培养。48 h后首次半量换液,后每72 h换液1次,细胞接近90%融合时取足够数量单细胞悬液,1280 r/min离心5 min。加入FITC标记工作浓度为1∶50的抗CD105+抗体,轻缓振摇后,于37 ℃、5% CO2饱和湿度恒温培养箱避光孵育30 min。流式分选制成细胞悬液,以1×1010接种于T25培养瓶,置于37 ℃常温培养箱中培养。24 h后换液除去悬浮细胞,加入含10%FBS完全培养基,每48 h更换培养基。细胞传代培养至P3~P5用于实验。
2.2 缺血缺氧细胞模型制备
结合前期研究[2]及参考文献[8-12],采用DMEM培养基及94% N2、1% O2、5%CO2、37 ℃ H35低氧工作站培养细胞。时间设立为6 h、12 h、24 h、36 h、40 h、44 h、48 h、60 h 8个时间点,建立缺血缺氧细胞模型。
2.3 BMSCs分组与培养
BMSCs分为正常培养组(Control Group)、缺氧组(Hypoxia Group)、缺血缺氧组(hypoxia ischemia group, HI Group)、补肾化瘀生新方组(BSHYSX Group, BSHY Group)。正常组使用完全培养基(含10%FBS),于37 ℃ 5%CO2恒温培养箱内培养;缺氧组使用完全培养基,缺血缺氧组使用DMEM培养基,补肾化瘀生新方组(BSHYSX Group, BSHY Group)使用补肾化瘀生新方含药血清,于H35低氧工作站中培养细胞。
2.4 各时间点BMSCs生存率和凋亡率检测
2.4.1 CCK-8法细胞生存率检测 接种P3代BMSCs细胞1×105个/孔于96孔板中,分为正常培养组、缺氧组、缺血缺氧组,分别在缺血缺氧条件及正常培养条件下培养6 h、12 h、24 h、36 h、40 h、44 h、48 h、60 h后,每孔加入10 μlCCK-8溶液,于37 ℃常温培养箱孵育2 h,酶联免疫检测仪480 nm处测吸光度(A)值,同时设置空白对照孔。细胞生存率(%)=(A实验组-A空白对照)/(A对照组-A空白对照)×100%,实验重复3次。
2.4.2 Annexin V-FITC/PI凋亡检测 接种P3代BMSCs细胞2×105个/孔于6孔板中,分组及培养条件同上。在各时间点取出细胞,PBS洗涤后0.125%胰酶(不含EDTA)消化1 min,终止消化 1000 r/min 离心5 min收集细胞。加入Annexin V-FITC和PI溶液,轻柔混匀,室温避光孵育15 min,加入400 μl PBS轻轻混匀,流式细胞仪迅速检测,实验重复3次。
2.5 ROS活性氧检测
2.5.1 ROS流式检测 接种P3代BMSCs细胞2×105个/孔于6孔板中,分组及培养条件同上。在各时间点取出细胞,PBS洗涤后0.125%胰酶(不含EDTA)消化1 min,终止消化 1000 r/min 离心5 min,收集细胞、调整细胞浓度1×105个/mL,加入0.5 mlPBS重悬细胞后,加入1 ml DCFH-DA荧光探针,置37 ℃常温培养箱孵育40 min后缓冲液洗涤3次,以充分去除未进入细胞内的荧光探针。加入400 μl缓冲液重悬,于流式细胞仪迅速检测,每个实验重复3次。
2.5.2 ROS荧光检测 接种P3代BMSCs以2×105个/孔的密度接种于6孔板中,与CCK-8相同的分组方法,在各时间点取出细胞,按照说明书操作,加入1 ml DCFH-DA荧光探针,放入正常培养箱孵育40 min后取出,缓冲液轻柔冲洗,以充分去除未进入细胞内的DCFH-DA,加入400 μl缓冲液,在共聚焦荧光显微镜下观察细胞形态,每个实验重复3次。
BMSCs细胞正常培养,待细胞分化良好且贴壁80%~85%时,更换5 ml高糖DMEM培养基,于1%O2、94%N2、5%CO2的低氧条件下继续培养。
2.6 补肾化瘀生新方对缺血缺氧模型生存率、凋亡率及ROS的影响
在确立的缺血缺氧模型建立最佳时间点基础上,以补肾化瘀生新方含药血清干预细胞,CCK-8法测定细胞生存率,流式细胞仪检测凋亡率和平均荧光强度,倒置荧光显微镜观察细胞内ROS的表达,实验步骤同前。
2.7 统计学方法
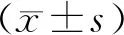
3 结果
3.1 各时间点BMSCs生存率和凋亡率检测
3.1.1 BMSCs生存率变化 表1图1示,经统计学检验,各时间点缺血缺氧组与正常组、缺氧组比较差异有统计学意义(P<0.05)。40 h缺血缺氧组细胞生存率最低(24.86%),后续细胞开始大量死亡。

表1 各组BMSCs生存率变化比较

图1 各时间点BMSCs生存率比较
3.1.2 BMSCs凋亡率变化 表2图2示,缺血缺氧组各时间点与正常组、缺氧组比较差异有统计学意义(P<0.05)。40 h缺血缺氧组BMSCs凋亡率最高(92.77%),后续细胞逐渐出现大量死亡。
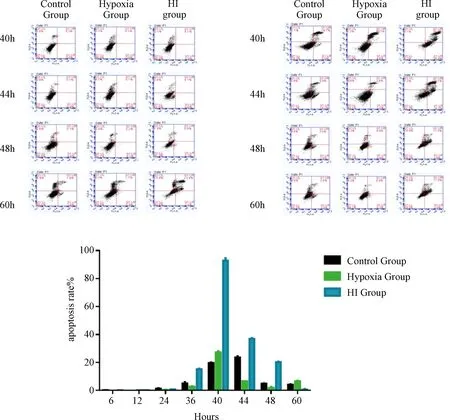
图2 各组BMSCs凋亡变化比较

表2 各组BMSCs凋亡变化比较
3.2 各时间点BMSCs荧光强度检测
表3图3示,各时间点缺血缺氧组与正常组比较差异有统计学意义(P<0.05);各时间点缺血缺氧组与缺氧组比较(60 h除外)差异有统计学意义(P<0.05)。荧光显微镜下观察,40 h细胞内ROS荧光强度较高、细胞量较前增多明显。提示缺氧微环境与缺血缺氧微环境下,明显提升了细胞内的活性氧积累。对多种不同的细胞进行分析可以得出结论,活性氧可能诱导细胞凋亡[3,4]。
图3 各组BMSCSs活性氧水平变化比较

表3 各组BMSCs活性氧平均荧光强度变化比较
3.3 BMSCs缺血缺氧模型建立
根据本实验细胞生存率、凋亡率、ROS含量等平行实验结果互相验证,结合课题组前期研究基础及缺血缺氧细胞模型建立的相关参考文献[8-12],认为40 h为BMSCSs缺血缺氧模型建立的成功最佳时间点。
3.4 补肾化瘀生新方对缺血缺氧微环境下BMSCs生存率和凋亡率的影响
3.4.1 补肾化瘀生新方对缺血缺氧微环境下BMSCs生存率影响 表4、图a示,补肾化瘀含药血清干预后,明显提升了BMSCs在缺血缺氧微环境下的生存率,各时间点差异有统计学意义(P<0.05)。

表4 补肾化瘀生新方对缺血缺氧微环境中BMSCs生存率影响比较
3.4.2 补肾化瘀生新方对缺血缺氧微环境下BMSCs凋亡率影响
表5图b示,各时间点提示,补肾化瘀组凋亡率较缺血缺氧组明显下降,各组比较差异有统计学意义(P<0.05)。

表5 补肾化瘀生新方对缺血缺氧微环境中BMSCs凋亡率影响比较
3.5 补肾化瘀生新方对缺血缺氧微环境下BMSCs活性氧的影响
表6图c示,与缺血缺氧组比较,补肾化瘀组干预效果明显,差异有统计学意义(P<0.05)。荧光显微镜下观察,补肾化瘀生新方干预后细胞荧光强度明显减弱。

表6 补肾化瘀生新方对缺血缺氧微环境中BMSCs活性氧的影响
4 讨论
微环境是干细胞分化领域的重要学说之一,在局部微环境的调控下,干细胞通过旁分泌、自分泌、内分泌等方式,干预或增强某些介导分化的关键基因表达,使干细胞保持持续更新的潜能。但大量研究表明,梗死区微环境缺血缺氧,短时间内释放大量氧自由基,形成局部氧化应激反应,破坏线粒体膜完整性,无法正常供应细胞活动所需ATP,最终造成细胞凋亡或死亡;坏死细胞聚集产生局部炎症反应、坏死局部为保持内环境稳定产生免疫应答等特异性免疫效应等,亦不利于移植后干细胞的存活和分化,无法达到预期目标[5-7]。因此,改善局部缺血缺氧微环境,提高干细胞存活率是未来干细胞研究的新方向。
缺血缺氧条件下的体内外实验研究多各自设立单一时间点或时间段,未能形成模型建立的统一标准。YONG-SEOK HAN等[8,9]研究单个时间点,通过JAK2/STAT3通道调节hMSCs增殖情况,在低氧预处理12 h后对其进行检测;之后这些研究者又设立多个时间点,通过c-met激活BMSCs与细胞朊蛋白PrPC相结合作用挽救缺血性损伤,实验设置在低氧下培养0 h、6h、12 h、24 h和48 h这5个时间点进行检测;张妮等[10]模拟炎症诱导缺血缺氧微环境BMSCs模型,时间点设置为6 h、12 h、24 h;一些研究从动物实验着手,时间设置以天或周为单位[11,12]。本实验基于缺血缺氧实验条件,设置6 h、12 h、24 h、36 h、40 h、44 h、48 h、60 h 8个时间节点,采用3种检测方法平行验证以观察BMSCs在缺血缺氧微环境下的动态渐变过程。研究结果发现,6 h、12 h时缺氧组、缺血缺氧组细胞活力与对照组相比不减反升,可能与BMSCs处于短暂、非致死性的低氧条件下可激活细胞自噬,形成内源性的保护蛋白、激活胞外信号调节激酶 (extracellular signal regulated kinase,Erk)等有关,从而提高细胞的再生能力,减少细胞凋亡[13,14]。24 h开始,缺氧组、缺血缺氧组细胞活力与对照组比较明显降低。细胞凋亡的测定,36 h开始缺氧组与缺血缺氧组细胞凋亡率明显升高,但36 h与48 h缺血缺氧组2个时间点无显著差异,这可能与BMSCs逐渐适应该缺血缺氧环境有关,遂加入40 h和44 h 2个时间点以作动态观察。与正常组各时间点比较,缺血缺氧组40 h时细胞活力最低,凋亡率最高,ROS形成的细胞损伤最明显。结合各项结果,课题组前期研究及相关细胞模型建立标准,认为40 h时BMSCs缺血缺氧模型建立成功。
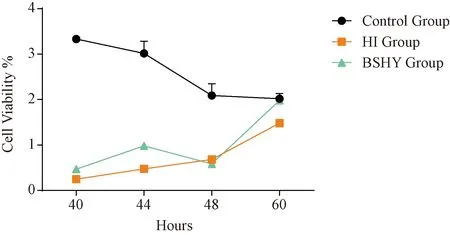
图4 CCK-8检测中药干预后BMSCs生存率变化比较
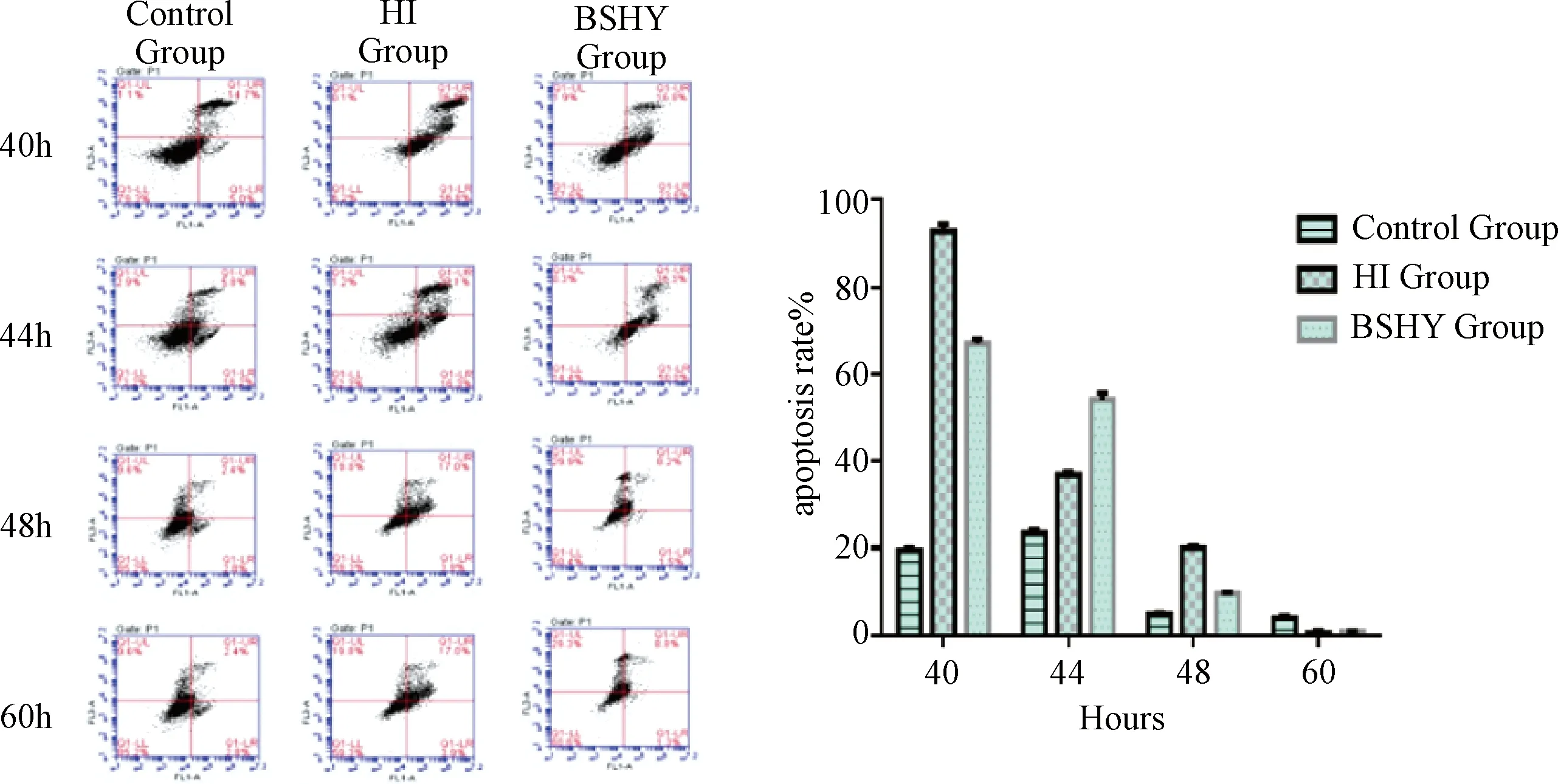
图5 Annexin V-FITC/PI流式检测中药干预后骨髓间充质干细胞凋亡水平变化比较

图6 ROS检测中药干预后骨髓间充质干细胞活性氧水平变化比较
补肾化瘀生新方以熟地黄、巴戟天共为君药,起到滋肾阴、壮肾阳的功效;川芎活血行气,当归补血化瘀共为臣药;肉桂、石斛共为佐药,起到温肾阳、滋阴敛阳之功;甘草调和诸药,全方不仅可以调控机体整体的大环境,还可保证肾精充足,脉道通利[15]。课题组前期采用液相色谱-串联质谱(LC-MS/MS)研究补肾化瘀生新方含药血清体内吸收入血成分,共分析鉴定其药物活性成分为主要吸收入血成分。本实验研究得出,补肾化瘀生新方含药血清干预缺血缺氧微环境下BMSCs的表达,可提升BMSCs在缺血缺氧微环境下的生存率。与缺血缺氧组对比,40 h时补肾化瘀生新组BMSCs凋亡率水平明显降低。这一结果可能与补肾促进“肾精”的生长发育,激活损伤组织中干细胞损伤修复能力有关[16]。与缺血缺氧组比较,补肾化瘀生新组明显降低细胞内氧化应激水平(图c);48 h显示(图c),中药干预组荧光强度降低,细胞成大面积、小聚落分布,提示细胞内ROS水平降低,可能有利于细胞的增殖[17]。
本研究发现,补肾化瘀生新方可提高BMSCs在缺血缺氧环境中生存率,降低凋亡率,对抗ROS对细胞的损伤,推测通过改良缺血缺氧微环境可作为提高BMSCs移植后存活率的又一新途径,这一作用的具体机制仍有待进一步研究。
