三七总皂苷抗大鼠缺血再灌注损伤作用及对心肌自噬水平的影响❋
2021-09-26张海银许言午包怡敏
王 飘, 郑 晴, 胡 婷, 张海银, 许言午, 包怡敏
(上海中医药大学基础医学院, 上海 201203)
缺血性心脏病主要包括冠状动脉疾病和急性心肌梗死等,是中老年人的常见病和多发病之一,其发病率也在逐年上升[1]。使缺血心肌及时恢复血流灌注及氧供应是目前最常见的治疗方法[2],但在治疗疾病的同时,缺血再灌注(ischemia/reperfution,I/R)可能导致氧自由基增加、钙超载、细胞凋亡等,从而造成心肌细胞死亡,诱导心脏功能异常,即产生心肌缺血再灌注损伤(myocardial ischemia reperfusion injurg,MIRI)[3]。由于MIRI的较高致死性和致残性,因此减轻MIRI对于临床治疗缺血性心脏病具有重要意义。自噬可作为内源性调节机制参与到I/R过程中[4,5]。有研究表明,当I/R损伤发生后心肌自噬水平也会增加[6],但自噬在MIRI中的具体作用目前仍存在争议。针对MIRI 损伤的治疗,中药因其毒副作用小、能从疾病多环节入手等优势而表现出较好的疗效,如三七、人参等。三七的功效主要包括强心止血,现代药理学表明三七的主要成分三七总皂苷(panax notoginseng saponins,PNS)具有抗炎、抗氧化等药理作用[7]。现有研究表明,PNS对MIRI有一定的缓解作用,其主要作用途径包括抗氧化应激、抗凋亡等[8,9],但其能否通过自噬途径减轻MIRI损伤的研究还较少。本研究通过观察PNS对自噬的作用,探索PNS对抗I/R损伤保护心肌可能的作用机制。本研究方案经上海中医药大学动物伦理委员会批准,批准号PZSHUTCM190609017。
1 材料与方法
1.1 动物
SPF级雄性SD大鼠27只,约10周龄,上海市斯莱克实验动物有限责任公司提供,实验动物生产许可证号SCXK(沪)2012-0002。统一饲养于上海中医药大学实验动物中心,饲养环境相对湿度(55±10)%,温度(23±2)℃,自由饮水并给予普通饮食,光照周期12 h/12 h明暗交替。
1.2 药品、试剂与仪器
血栓通注射液组成成分为三七总皂苷(昆明制药集团股份有限公司,批号13HK03);血清肌钙蛋白T(cTnT)ELISA检测试剂盒(武汉华美生物工程有限公司,货号CSB-E11403r,批号X03033170);抗体包括SQSTM1/p62(CST,货号5114 s)、Beclin-1(CST,货号3495 s)、LC3B/MAP1LC3B(Novus,货号NB100-2220)。酶标仪(美国伯腾仪器有限公司,型号Synergy);动物呼吸机(成都仪器厂,型号DHX-300);多通道生物信号采集处理系统(成都仪器厂,型号RM6240BD)。
1.3 分组与造模
将大鼠随机分为假手术组(Sham)、模型组(I/R)和三七总皂苷组(I/R+PNS)各9只。采用结扎冠状动脉左前降支(LAD)法建立大鼠心肌I/R模型,麻醉后仰卧位固定并行气管插管,连接呼吸机维持呼吸(90次/min,呼吸比为1∶2,潮气量8~10 mL),在左胸骨第四肋处行胸廓切开术以暴露心脏,并用5-0缝合线结扎LAD。缺血40 min后松开缝合线恢复血流灌注2 h。Sham组大鼠心肌不进行LAD结扎,其余手术步骤均相同。I/R + PNS组大鼠于造模前30 min腹腔注射PNS(50 mg/kg)[10],其他大鼠腹腔注射生理盐水(10 ml/kg)。
1.4 大鼠心功能检测
右颈总动脉插管至左心室,另一端连接生物信号采集处理系统,在造模过程中记录左心室内压力(LVP)曲线,测量左心室等容收缩期压力最大变化速率(+dp/dtmax)、左心室等容舒张期压力最大变化速率(-dp/dtmax)、左心室平均收缩压(mLVSP)、左心室平均舒张压(mLVDP)、左心室开始收缩至达到室内压最大上升速率时间(t-dp/dtmax)的变化,并计算左心室发展压(DP,DP=mLVSP-mLVDP)。
1.5 心肌组织形态学观察
再灌注结束后立即取下心脏,于预冷的生理盐水中冲洗后切取左心室前壁心肌。经预冷的4%多聚甲醛固定后流水冲洗12 h,随后将标本进行脱水处理,脱水标本浸泡于二甲苯中,常规石蜡包埋切片后进行HE染色。染色结束后用常规树脂进行封片,并于光学显微镜下观察心肌病理学改变。
1.6 血清心肌损伤标志物检测
再灌注结束后取颈总动脉血,室温静置30 min,3000 r/min离心10 min回收血清。根据说明将标准品和样品加入微孔板中37 ℃下孵育2 h,随后依次加入生物素抗体、HRP稀释液和底物溶液,并根据要求孵育不同时长,最后添加终止液终止反应,酶标仪450 nm波长读取光密度(OD)值,计算血清中cTnT含量。
1.7 Western blot检测
剪取缺血再灌注区域心肌组织适量,匀浆后以4 ℃ 14000 r/min离心20 min,取上清获得组织总蛋白。采用BCA法检测蛋白浓度,蛋白经SDS-PAGE凝胶电泳并转移至PVDF膜,5%BSA封闭1 h后加入稀释的一抗4 ℃孵育过夜,之后使用适宜的二抗室温孵育1 h,ECL发光试剂盒显影蛋白条带,Image J软件测定条带灰度值,目的蛋白相对表达量用目的蛋白与内参(GAPDH)比值表示。
1.8 统计学方法
2 结果
2.1 三七总皂苷对大鼠心功能的影响
血流动力学能够灵敏地反映心脏收缩和舒张功能。与Sham组比较,大鼠心肌缺血40 min,再灌注2 h后左心室的+dp/dtmax呈下降趋势,DP明显减小,t-dp/dtmax显著增大(P<0.05),说明心室收缩功能下降(图1A、1C、1 D),-dp/dtmax显著下降表明心肌舒张功能也降低(图1B)(P<0.05)。PNS预处理可以明显减轻上述指标的变化,改善心功能。
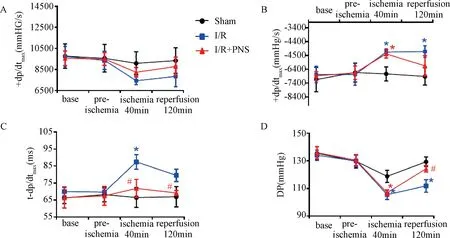
注:与Sham组比较:*P<0.05;与I/R组比较:#P<0.05,n=9
2.2 三七总皂苷对大鼠心肌组织形态的影响
HE染色结果显示,Sham组大鼠的心肌组织纤维分布整齐、形态完整,无纤维结构改变;模型组出现大鼠心肌组织肌纤维紊乱甚至断裂、肌丝溶解等病理变化;而在PNS组中,由于缺血再灌注所引起心肌组织形态的损伤情况有明显改善(图2)。
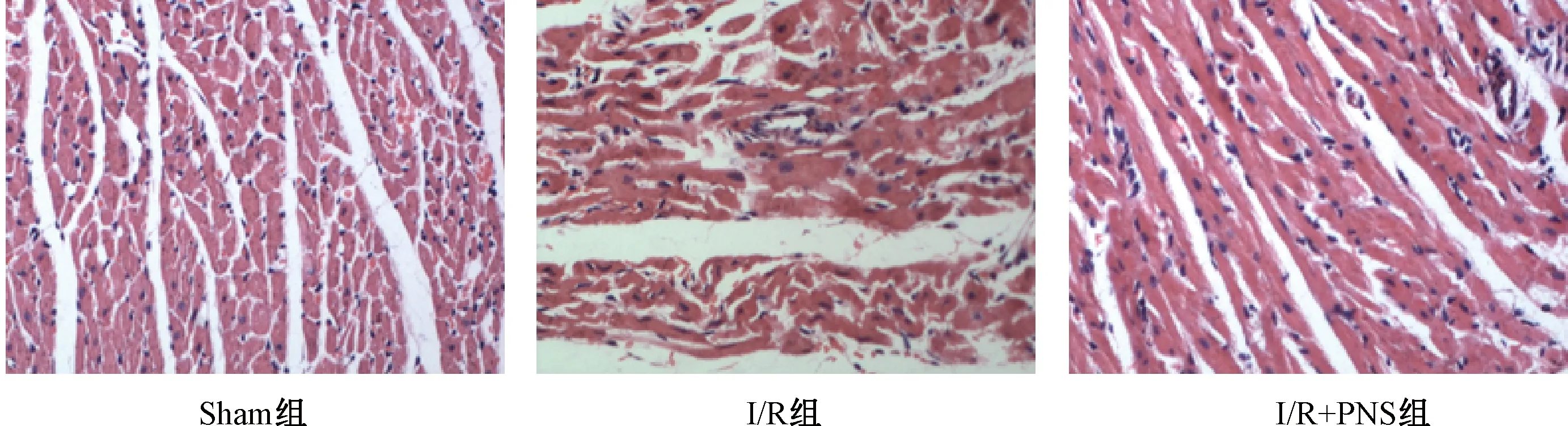
图2 各组大鼠心肌组织形态HE染色结果比较(×200)
2.3 三七总皂苷对大鼠血清肌钙蛋白含量的影响
血清中的肌钙蛋白含量可以反映心肌细胞受损情况。与Sham组比较,I/R组血清cTnT含量明显升高(P<0.05),提示心肌细胞损伤严重;而与I/R组比较,PNS组血清cTnT明显含量下降(图3)(P<0.05),表明PNS可以有效改善因I/R所引起的心肌细胞损伤情况。
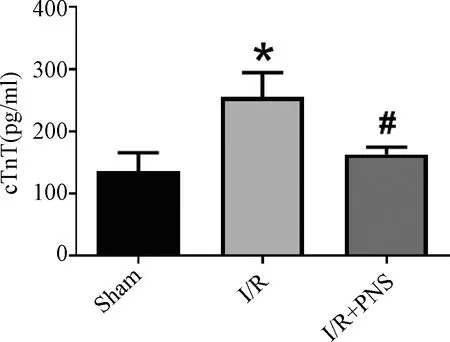
注:与Sham组比较:*P<0.05;与I/R组比较:#P<0.05,n=3
2.4 三七总皂苷对大鼠心肌细胞自噬相关蛋白的影响
与Sham组比较,I/R组心肌组织Beclin-1、LC3Ⅱ的蛋白表达明显升高(P<0.05),P62蛋白表达有上升趋势但差异无统计学意义;与I/R组比较,PNS组大鼠心肌组织蛋白Beclin-1、LC3Ⅱ的表达明显降低(图4C,4 D),P62蛋白表达明显升高(图4B)(P<0.05),表明PNS对自噬有明显的抑制作用。
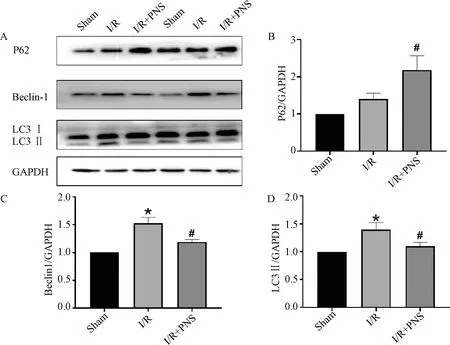
注:与Sham组比较:*P<0.05;与I/R组比较:#P<0.05,n=5~6
3 讨论
缺血性心脏病目前是全球死亡率最高的疾病,临床主要的治疗手段包括溶栓治疗或经皮冠状动脉介入术等,以期达到恢复血流灌注的目的[11]。然而心肌组织发生缺血后,恢复血流灌注时可能会发生组织损伤进行性加重的过程,即缺血再灌注损伤(MIRI)[3]。
MIRI具体表现主要包括心功能下降、心肌组织结构破坏、心肌内肌钙蛋白释放等。心功能下降主要包括心肌收缩和舒张能力减弱,一般可用血流动力学指标反映心功能的变化[12]。+dp/dtmax和-dp/dtmax为衡量心脏收缩和舒张功能的经典指标,当心肌收缩功能或舒张功能障碍时其值降低[13]。本实验结果同样显示,当发生I/R时,+dp/dtmax和-dp/dtmax值明显降低;而经过PNS预处理后+dp/dtmax和-dp/dtmax下降趋势有明显改善,说明PNS可以改善因缺血所导致的心脏收缩及舒张功能障碍。除+dp/dtmax外,左心室发展压(DP)和t-dp/dtmax也可以反映心室收缩功能,当心肌收缩功能障碍时DP值降低,t-dp/dtmax值升高。本研究结果也显示,I/R过程中DP呈明显下降趋势,t-dp/dtmax值明显升高;而用PNS预处理后DP值有明显的上升,t-dp/dtmax值有明显的下降,同样说明PNS预处理后心室收缩功能障碍得到改善。因此,进行PNS预处理可以有效减轻因I/R所导致的心肌收缩和舒张功能障碍,从而达到保护心功能的目的。
除血流动力学指标外,心肌组织病理学观察及血清中肌钙蛋白含量检测也可以判断心肌损伤情况。当出现心肌损伤时,会发生心肌纤维排列紊乱、肌纤维断裂、溶解、坏死等现象[14]。本研究中,HE光镜染色结果显示,I/R组有明显的心肌纤维排列紊乱、横纹消失、心肌萎缩、肌纤维断裂溶解、心肌间质水肿等现象,说明此时心肌损伤明显;PNS预处理的大鼠心肌肌纤维排列较整齐,与I/R组比较病理变化不明显,说明PNS能有效改善I/R所引起的心肌损伤。心肌肌钙蛋白T(cTnT)主要存在于心肌组织中,对心肌损伤具有高度的特异性和敏感性。当心肌细胞受损时,由于细胞结构和膜通透性被破坏,cTnT发生降解并释放到血清中,其血清中含量越多表明心肌损伤越严重[15]。本研究中,ELISA结果显示,与Sham组比较,I/R组血清cTnT含量明显升高,提示再灌注后心肌损伤较严重;PNS预处理明显降低血清中cTnT的含量,说明PNS可以有效改善心肌损伤的情况。
自噬是将功能失调或受损的细胞质成分靶向溶酶体进行降解和再循环,从而维持细胞内环境稳态的一个过程[16]。当心肌缺血再灌注发生后,受损的心肌中自噬水平会发生改变。目前研究表明,抑制过度自噬可以起到保护心肌抗缺血再灌注损伤的作用[17],也有部分研究认为促进自噬发生也可以起到相同作用[18]。而本实验研究结果显示,通过抑制过度自噬可以起到抗心肌缺血再灌注损伤的作用。正常生理状态下,细胞内自噬处于基础水平;而当I/R发生后,为应对氧化应激等反应,使得自噬不断增强,过度自噬则导致心肌细胞大量死亡,从而引起MIRI[19]。Beclin-1是细胞自噬起始阶段的关键因子,可反映细胞自噬水平的高低[20],自噬被抑制时Beclin-1表达被抑制。LC3是存在于自噬体的蛋白且对自噬体的形成起到重要作用,LC3主要以非脂质形式存在于细胞中,即LC3Ⅰ;当自噬发生时,LC3Ⅰ 脂化形成LC3Ⅱ[21,22]。因此,LC3Ⅱ也被用作反映自噬水平的标记物,当自噬增强时,LC3Ⅱ 表达也随之上调。本研究中,I/R组的Beclin-1、LC3Ⅱ 蛋白表达明显升高,说明此时自噬水平明显上升;而PNS预处理有效改善了这种升高趋势,使得Beclin-1、LC3Ⅱ蛋白表达含量明显降低,表明PNS对自噬有一定的抑制作用。为进一步说明PNS对自噬的下游环节是否具有调节作用,本实验又对自噬相关蛋白P62进行了检测。P62是自噬受体同时也是自噬选择性底物[23],可以直接与LC3结合形成自噬体[24],最终被运送至溶酶体系统形成自噬溶酶体并降解;而当自噬体与溶酶体结合受阻时,则会导致P62与泛素化产物结合,导致其表达水平升高。有研究表明,当自噬被抑制时,P62蛋白表达水平升高[25]。本研究结果同样显示,I/R过程中P62表达没有明显的升高趋势,说明此时自噬体与溶酶体结合正常,自噬处于正常发生状态;而PNS预处理则使得P62表达明显升高,说明自噬体与溶酶体结合受阻,自噬处于被抑制状态。综合以上结果可以看出,PNS可以上调心肌组织中P62蛋白的表达,同时下调Beclin-1、LC3Ⅱ的蛋白表达量,说明PNS可以通过抑制自噬起始环节及下游自噬体与溶酶体的结合,达到抑制自噬过度发生的目的,从而保护心肌抗缺血再灌注损伤。
综上所述,PNS可以有效改善心肌缺血再灌注损伤大鼠的心功能,减轻心肌组织病理损伤,其作用机制可能与抑制过度自噬有关,最终达到保护心脏抗心肌缺血再灌注损伤的目的。
