清消法通过调节TLR-2/NF-κB通路对大鼠痤疮局部炎症反应的改善作用研究❋
2021-09-26赵一霈成秀梅薛思思任威威杨彩瑞方惠敏
薛 兵, 赵一霈, 成秀梅, 薛思思, 任威威, 杨彩瑞, 方惠敏, 王 迪
(河北中医学院中西医结合外科, 石家庄 050000)
痤疮是一种发生于颜面、胸背等处的毛囊皮脂腺慢性炎症性疾病,其发病与生殖激素失调、皮脂分泌增加、毛囊管角化过度以及炎症反应有关。研究表明,痤疮的发生与炎症反应密切相关[1]。痤疮丙酸杆菌通过T0ll/NF-κB信号通路,诱导炎性介质的合成和释放,对痤疮炎性因子具有重要的调节作用[2]。研究表明,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和干扰素-γ(inter feron-γ,IFN-γ)在痤疮炎症反应过程中发挥着重要作用[3]。T0ll/NF-κB信号通路可启动TNF-α、IFN-γ参与炎症反应。本研究通过观察大鼠局部炎症反应及TLR-2、 NF - κ B p65、TNF-α、IFN-γ的变化,探讨清消法治疗痤疮的作用机理。本研究已通过河北中医学院动物伦理委员会批准,编号DWLL2019011。
1 材料与方法
1.1 动物及药物
清洁级wistar大鼠40只,体质量(200±20)g,购于河北医科大学实验动物中心,实验动物许可证号SCXK(冀)2018-004。将40只wistar大鼠于河北中医学院科研中心适应性喂养1周,温度(24±2)℃,相对湿度50%~60%,自由饮食。
异维A酸软胶囊(10 mg×20 s,上海信谊延安药业,批准文号国药准字H10930210);枇杷清肺饮加减方组成:枇杷叶9 g,桑白皮9 g,黄芩9 g,黄连6 g,栀子6 g,连翘9 g,金银花 12 g,槐花9 g,山楂12 g,皂角刺6 g,赤芍9 g,浙贝母9 g,甘草3 g,为中药颗粒制剂,购于河北中医学院国医堂,蒸馏水水浴溶解后,4 ℃冰箱保存备用。
1.2 试剂
痤疮丙酸杆菌混悬液(ATCC6919)由广东省微生物研究所提供,厌氧,4 ℃保存;IFN-γ ELISA试剂盒(货号CSB-E04579r),优尔生生物;TNF-α ELISA 试剂盒(货号88-7340),赛默飞生物;DAB 显色试剂盒(货号PK-4001),美国Vectorlabs;兔TLR-2多克隆抗体(货号A11225),武汉Abclonal公司;兔NF-κB P65多克隆抗体(货号GB11142)、HRP标记山羊抗兔(货号GB23303),赛维尔生物。
1.3 动物分组及给药
将40只Wistar大鼠随机分为空白组、模型组、西药组、中药组。模型制备成功后,各组进行相应的灌胃给药,中药组给予枇杷清肺饮加减方,西药组给予异维A酸胶囊,参照人与动物等效剂量换算法(体表面积换算法)[4]。枇杷清肺饮加减方给药浓度11.25 g·kg-1,灌胃给药体积为10 mL·kg-1;异维A酸软胶囊给药浓度3.125 mg·kg-1,灌胃给药体积为10 mL·kg-1;空白组和模型组给予等量生理盐水,每日1次,连续给药21 d。
1.4 大鼠耳廓痤疮模型制备及标本收集
模型组、西药组、中药组大鼠右耳廓皮内注射痤疮丙酸杆菌混悬液(6×107cfu/mL),每日1次,每次50 μl/200 g,连续注射5 d[5]。通过表观指标和病理指标判断模型的成功建立,表观指标变化是痤疮最直接的判定标准,是判定大鼠痤疮模型制备成功与否的核心指标[6]。局部皮肤病理指标是判定大鼠模型成功与否的直接证据[7]。模型建立后表观指标显示,局部组织增厚、变硬、红肿;局部皮肤隆起呈丘疹并出现脓疱;毛囊口出现黑色角栓并开放增大,毛囊面积及皮脂腺直径变大。病理显示,局部表皮增厚,角化过度,棘细胞层肥厚;表皮、真皮、皮下组织界限模糊;毛囊皮脂腺增大明显,可见毛囊漏斗部充满角化物质并扩大成壶状;真皮上层毛细血管扩张明显,有炎性细胞浸润[5]。
末次给药后禁食不禁水24 h备皮,给予10%水合氯醛麻醉,分离腹主动脉后采血,室温静置待凝,低温4 ℃离心15 min(3000 r/min),取上清液待用。同时取大鼠耳组织病灶部位,去除血渍后部分存于-80 ℃冰箱,部分存于4%多聚甲醛溶液中备用。
1.5 检测指标及方法
1.5.1 大鼠耳廓外观及形态 给药期间,肉眼观察大鼠耳廓痤疮模型的耳外观及形态变化,游标卡尺测量大鼠耳廓厚度,计算大鼠耳廓肿胀率:大鼠耳廓肿胀率=(注射后耳廓厚度-注射前耳廓厚度)/注射前耳廓厚度×100%。
1.5.2 大鼠耳廓组织病理改变 大鼠耳廓组织经4 %多聚甲醛固定后脱水、透明、包埋后制成6 μm切片,进行苏木素染色、氨水反蓝、伊红复染,最后光镜(×200)下观察各组大鼠耳廓组织的病理改变并拍摄照片。
1.5.3 大鼠血清TNF-α、IFN-γ含量变化 将 ELISA 试剂盒、大鼠血清样品置于室温复温,严格按照试剂盒说明书对TNF-α、IFN-γ 细胞因子含量进行检测,均于波长450 nm处以空白对照孔调零后检测OD值,并计算各组大鼠血清TNF-α、IFN-γ含量。
1.5.4 免疫组化分析大鼠耳廓组织TLR-2、NF-κB P65表达 将石蜡切片脱蜡至水、孵育、PBS充分洗涤,抗原修复后TLR-2、NF-κB P65一抗抗体4 ℃孵育过夜,次日磷酸缓冲盐溶液(PBS)中充分洗涤,滴加HRP山羊抗兔抗体,室温孵育50 min,切片滴加 DAB显色液5 min左右,苏木素复染3 min左右,自来水冲洗后透明、封片。于显微镜下观察,每组随机选取相同部位5个高倍视野(×400),采用 Image J 1.8.0系统分析,并以积分光密度(IOD) 代表蛋白相对表达量。
1.5.5 Western blot分析大鼠耳廓组织TLR-2、NF-κB P65的表达 取大鼠耳廓组织,加入蛋白酶抑制剂和蛋白裂解液,低温高速离心后提取耳廓组织全蛋白,用二喹啉酸(BCA) 法测定其浓度,-20 ℃储存备用。配制10%聚丙烯酰胺凝胶,每孔蛋白上样量6 μg,设置浓缩胶电压90V,分离胶120V,电泳至溴酚蓝跑出即可终止电泳,转膜,设置恒压25 V,时间30 min,5%的脱脂牛奶中封闭1 h,然后将膜放入一抗抗体TLR-2(1∶1000)、NF-ΚB p65(1∶1000)中,4 ℃孵育过夜,次日洗涤,放入HRP山羊抗兔抗体室温下孵育1 h后显影,使用Image J 1.8.0软件进行图像分析,并量化目标条带的灰度值。
1.6 统计学方法
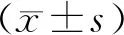
2 结果
2.1 大鼠耳廓外观形态变化
图1示,空白组大鼠耳廓柔软菲薄,颜色淡红,透光度良好,毛细血管清晰,耳管开口处可见均匀分布的细小毛囊及毛发,无丘疹、脓疱、粉刺、角栓等皮损显现;模型组大鼠耳廓变厚、粗糙、干燥,大鼠耳廓颜色暗红,皮肤表面粗糙隆起,高低不平,兼有散在丘疹、脓疱,注射处真皮上层毛细血管扩张明显;中药组和西药组与模型组比较,丘疹、脂栓、脓疱不同程度减少,毛细血管较清晰,毛囊口略缩小、平整。

图1 各组大鼠耳廓变化比较
2.2 各组大鼠耳廓厚度及肿胀率变化
表1示,与空白组比较,模型组大鼠耳廓厚度及肿胀率明显升高,差异有统计学意义(P<0.05);与模型组比较,西药组、中药组的大鼠耳廓厚度和肿胀率均有所改善(P<0.05),且中药组改善程度优于西药组(P<0.05)。

表1 比较各组大鼠耳廓厚度及治疗后肿胀率比较
2.3 各组大鼠耳廓组织病理改变
图2示,空白组大鼠耳廓组织未见明显异常,无炎性细胞,表皮各层界限清晰、完整;模型组大鼠耳廓可见毛囊上皮与表皮颗粒层均增厚,表皮过度角化,表皮、真皮、皮下组织界限模糊,相邻毛囊扩张融合,毛囊口被角化物质填堵延伸至皮脂腺,漏斗部呈壶状扩大(黑色箭头),真皮层可见扩张的毛细血管,毛囊周围炎症细胞浸润 ;西药组表皮增厚缓解,毛囊口角化减轻,仅有少量炎性细胞浸润;中药组毛囊扩张程度明显减轻,炎性细胞浸润减少,且角化层逐步恢复其完整性。

图2 治疗后各组大鼠耳廓组织病理变化比较(HE×200)
2.4 各组大鼠血清TNF-α、IFN-γ含量
表2示,与空白组比较,模型组大鼠血清TNF-α水平升高,IFN-γ水平下降,差异有统计学意义(P<0.05);与模型组比较,中药组、西药组均有所改善,即TNF-α水平有所下降,IFN-γ水平有所升高(均P<0.05);与西药组比较,中药组改善效果好于西药组(P<0.05)。

表2 各组大鼠血清TNF-α、IFN-γ水平比较
2.5 大鼠耳廓组织TLR-2、NF-κB P65的表达
图3示,与空白组比较,模型组大鼠耳廓组织TLR-2、NF-κB P65表达明显增加(P<0.05);与模型组比较,中药组、西药组均有所改善,即TLR-2、NF-κB P65表达均有所减少(P<0.05);与西药组比较,中药组改善效果稍好于西药组,即中药组NF-κB P65表达明显少于西药组(P<0.05),TLR-2表达也少于西药组,但差异无统计学意义(P>0.05)。
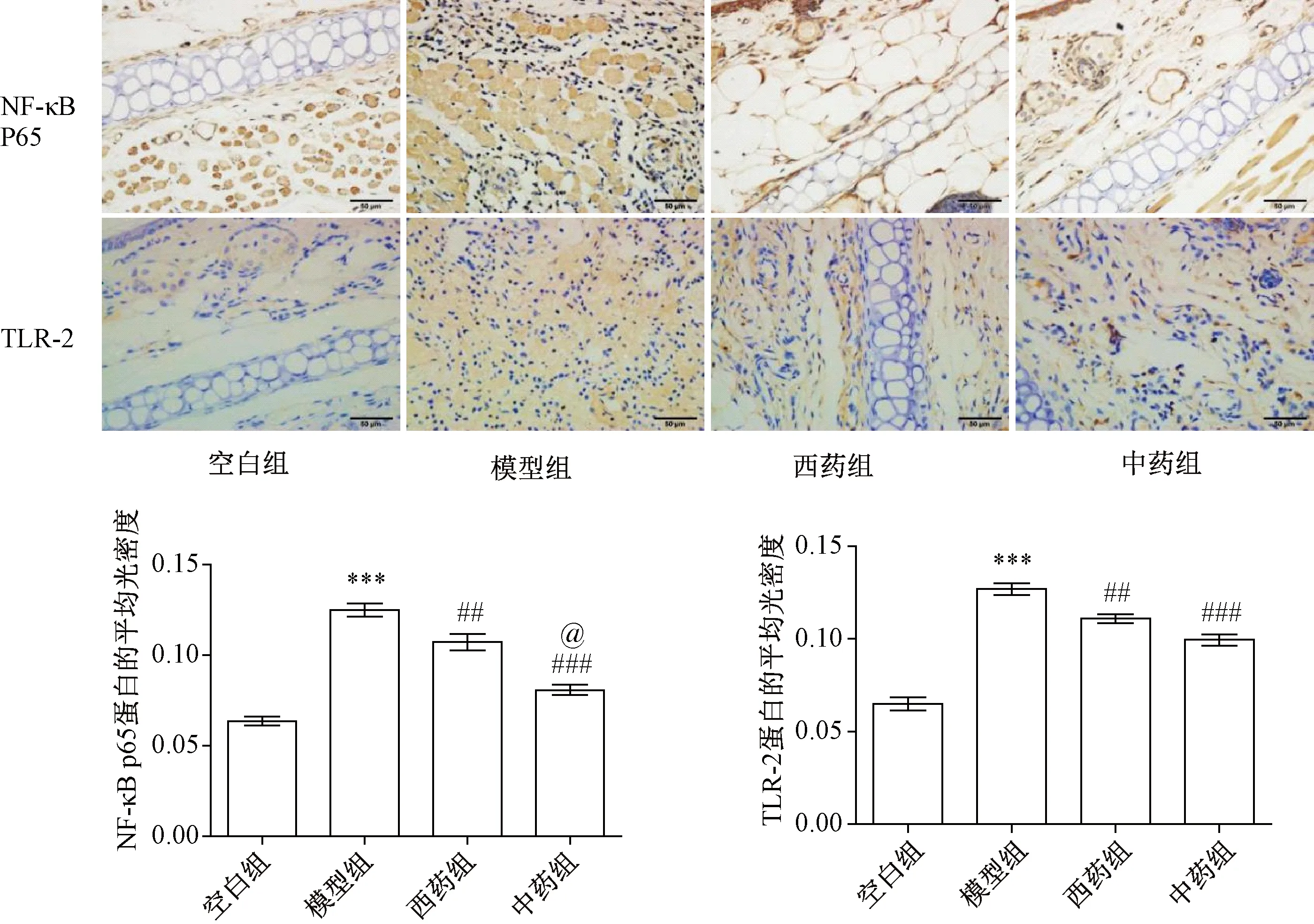
注:与空白组比较:***P<0.001;与模型组比较:###P<0.001,##P<0.01;与西药组比较:@P<0.05
2.6 各组大鼠耳廓组织TLR-2、NF-κB P65的蛋白表达
与空白组比较,模型组大鼠耳廓组织TLR-2、NF-κB P65表达明显增加(P<0.05);与模型组比较,中药组、西药组均有所改善,即TLR-2、NF-κB P65表达均有所减少(P<0.05);而与西药组比较,中药组的改善效果稍好于西药组,即中药组NF-κB P65表达明显少于西药组(P<0.05),TLR-2表达也少于西药组,但差异无统计学意义(P>0.05)。
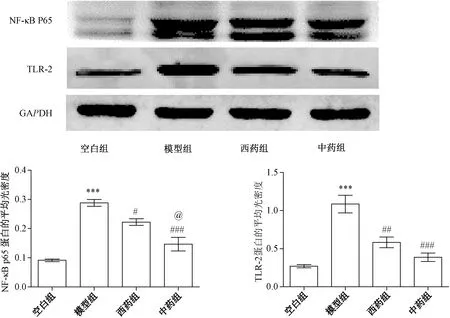
注:与空白组比较:***P<0.001;与模型组比较:###P<0.001,##P<0.01,#P<0.05;与西药组比较:@P<0.05
3 讨论
痤疮是一种临床常见且多发的损美性疾病,容易给患者带来抑郁、焦虑等负性情绪,对患者的生活质量造成严重影响[8]。痤疮的发病机制复杂,现代医学认为其发病与雄激素水平偏高、皮脂腺分泌旺盛、炎症反应等多种因素有关[9],其中炎症反应贯穿痤疮发病始终。在痤疮炎症反应过程中,痤疮丙酸杆菌发挥着重要作用[10]。痤疮丙酸杆菌通过TLRs依赖途径诱导炎性介质的合成和释放,其中TLR2 作为一种跨膜蛋白,能够识别痤疮丙酸杆菌细胞壁上的肽聚糖,启动相应的病原相关分子模式,活化下游的NF-κB,使其从细胞外转移到细胞核内,最终启动细胞因子TNF-α、IFN-γ等参与炎症反应[11-12]。
本研究与空白组比较,模型组大鼠耳廓表现为粗糙、干燥,毛细血管扩张明显;病理可见毛囊上皮与表皮颗粒层均增厚,毛囊口被角化物质堵塞延伸至皮脂腺,漏斗部扩大呈壶状,毛囊周围炎症细胞浸润;血清中TNF-α升高,IFN-γ下降;耳廓组织中TLR-2和NF-κB的表达显著增加,提示痤疮模型组大鼠的耳廓皮肤出现炎症反应。
中医认为,痤疮的病因病机为肺经风热、脾胃积热和肝胆湿热,而外感热邪和情志郁结化火也是诱发痤疮发病的重要因素,火热之毒作用于肌肤,循经上扰于面,致面部气血壅滞,外发为丘疹、结节、囊肿。《医学心悟·医门八法》中指出:“消者,去其壅也。 [13]”《外科启玄》曰:“消者灭也,灭其形症也。 [14]”清消法使痤疮表现在外的丘疹、结节、囊肿等得以消散,同时达到清其内、绝其源的目的,对痤疮起到标本兼治的作用[15]。成秀梅经过多年的中医思辨及临床实践,根据痤疮的病机特点,以清消立法,以枇杷清肺饮加减为方,在原方的基础上去掉原方人参,加入金银花、黄芩、栀子、连翘、山楂、皂角刺、赤芍、浙贝母。方中以枇杷叶、桑白皮、金银花为君药,具有清热解毒、疏散风热的作用;以黄柏、黄芩、黄连为臣药,具有清热解毒、泻热除烦的功效;以栀子、连翘、山楂、皂角刺、赤芍、浙贝母为佐药,具有泄热除湿、凉血活血、软坚散结的作用,诸药共奏清热解毒、软坚散结之效,疗效颇佳。结果显示,与模型组比较,枇杷清肺饮组大鼠耳廓均恢复变软变薄,毛囊扩张亦减轻;病理染色显示,表皮层变薄,毛囊周围炎症细胞浸润程度降低;枇杷清肺饮加减方组大鼠血清IFN-γ明显升高,TNF-α明显降低,提示枇杷清肺饮加减方可能通过促进IFN-γ表达,抑制TNF-α 表达以调节对痤疮的炎症反应。
为进一步探讨枇杷清肺饮对痤疮炎症的改善作用,本研究进一步检测了T0ll/NF-κB信号通路中TLR2、NF-κB P65的蛋白水平。结果显示,与空白组比较,模型组大鼠耳廓组织TLR-2、NF-κB P65表达明显增加;与模型组比较,中药组、西药组均有所改善,即TLR-2、NF-κB P65表达均有所减少,且中药组的改善效果稍好于西药组,提示枇杷清肺饮可能通过调节TLR-2/NF-κB来改善痤疮的炎症反应。
综上所述,清消法通过调节TLR-2/ NF-κB影响TNF-α、IFN-γ表达水平,改善痤疮炎症反应。然而对于阐明清消法对TLR-2/ NF-κB在痤疮发病过程中的调节作用,还需要进一步的细胞学实验研究,从而为痤疮的预防和治疗构建理论基础。
