立体定向放疗序贯仑伐替尼治疗中晚期原发性肝癌的效果与安全性分析
2021-09-25纪晓权张爱民李文刚何卫平段学章
纪晓权, 张爱民, 张 弢, 李文刚, 何卫平, 孙 静, 段学章,
1 南方医科大学 第二临床医学院, 北京 100039;
2 解放军总医院第五医学中心 肿瘤放射治疗科, 北京 100039
原发性肝癌是全球最常见的恶性肿瘤之一,2018年约有84万新病例,78万人死于原发性肝癌[1]。我国原发性肝癌患者的年新发病例约37万,年病死人数约32.6万[2]。肝切除是肝癌治疗的主要手段,5年总存活率为50%左右[3],但在实际临床工作中,只有10%~30%的肝癌患者符合手术切除的条件[4]。按照欧洲巴塞罗那分期标准(barcelona clinic liver cancer,BCLC)[5],早期(BCLC 0或A)肝癌患者应接受肝移植、手术切除或局部消融治疗等根治性治疗。中期(BCLC B)患者通常可接受局部治疗,如经肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)。但对于晚期(BCLC C)患者,按照我国颁发的《原发性肝癌诊疗规范(2019年版)》[6],治疗方法包括局部治疗如放射治疗及介入治疗,和系统治疗如靶向药物治疗及免疫治疗等。但目前单一方法的疗效仍不尽如人意,而将局部治疗与系统治疗联合是否能延长患者的生存时间,达到更好的疗效值得进一步研究。
随着放射治疗技术的进展,已有多项前瞻性和回顾性的试验显示,作为放射治疗手段之一的立体定向放射治疗(stereotactic body radiation therapy,SBRT)有着较高的局部控制率和较低的不良反应[7-11]。而新一代靶向药物仑伐替尼于2018年9月在我国被批准用于Ⅱb期以上的肝癌患者,仑伐替尼可双重抑制血管内皮生长因子和成纤维细胞生长因子血管生成途径,在抑制肿瘤血管生成的同时,直接抑制肿瘤细胞的生长。理论上讲,SBRT可有效控制肿瘤原发灶,而仑伐替尼能阻断肿瘤细胞的信号转导和血管生成等环节,延缓肿瘤复发和转移,两者联合可达到优势互补。但由于目前开展SBRT治疗的医疗机构很少,仑伐替尼也刚开始临床应用,目前尚缺乏两者联合治疗的相关临床研究。笔者对本中心18例SBRT序贯仑伐替尼治疗的患者进行回顾性分析,探讨联合治疗的安全性及能否提高患者的疗效。
1 资料与方法
1.1 研究对象 选取2018年10月—2019年5月解放军总医院第五医学中心收治的中晚期原发性肝癌行SBRT联合仑伐替尼治疗患者。纳入标准:(1)病理组织学或符合临床诊断标准的原发性肝癌BCLC B和C期肝癌患者,原发性肝癌诊断参照《原发性肝癌诊疗规范(2019年版)》[6],分期标准参照BCLC分期标准;(2)肝功能Child-Pugh A级或B级;(3)患者一般情况好,美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~2分;(4)骨髓和肾功能正常;(5)经肿瘤多学科会诊不适合其他治疗,患者自愿行SBRT序贯仑伐替尼治疗并签署治疗同意书。排除要求:(1)影像学检查无法确定肿瘤边界;(2)患者依从性差;(3)无法维持平卧位30~45 min;(4)研究期间参加另一项试验者;(5)既往有肝脏放射治疗史或腹部放射治疗史;(6)有效肝体积<700 cm3。
1.2 治疗方法 所有患者在行SBRT治疗前在CT引导下植入金标4~6枚。待植入5~7 d后,于CT模拟机引导下定位,以CT平扫图像为基准图像,以CT增强/MRI增强为辅助图像,由放射治疗科医生勾画相应肿瘤靶区和危及器官。计划靶区在大体肿瘤靶区基础上外放3~5 mm,根据正常器官限量制订治疗计划,周围正常器官受量设计参照 《美国医学物理师协会TG101 报告》[12],给予计划靶区处方剂量48~55 Gy,中位值50 Gy,分6~10次,单次剂量中位值6(5~9)Gy/次。采用G4射波刀(Accuray公司)治疗,连续照射(周末不休息)。在SBRT治疗结束后1周开始口服仑伐替尼治疗,初始剂量按照仑伐替尼Ⅲ期REFLECT试验[13]服用,当患者体质量< 60 kg时,口服剂量为8 mg/d;体质量≥ 60 kg时,口服剂量为12 mg/d。口服剂量为8 mg/d与12 mg/d的患者分别为4例及14例。治疗期间严密关注患者不良反应和耐受情况。如无疾病进展及无法耐受不良反应持续口服仑伐替尼治疗。18例患者仑伐替尼治疗中位时间为9.5(3.6~25.8)个月,平均时间为10.3个月。
1.3 随访及评价标准 治疗后前3个月,每月随访1次。治疗3个月后,每3个月随访1次,直至2020年11月30日或者患者死亡。随访项目包括血常规、肝功能、凝血功能、血清肿瘤标志物、上腹部增强CT或MRI检查、肺部CT等。在随访期间,患者不良反应评价参照美国国立癌症研究院通用毒性标准4.0[14]。放射性肝损伤的诊断标准按照Pan等[15]的定义,首先应排除由于肿瘤进展(根据影像学检查及肿瘤标志物判定)和肝炎病毒复制所致肝功能异常,通常发生于SBRT治疗后1周~3个月。疗效评价参照改良版实体瘤疗效评价标准(mRECIST)[16]。序贯治疗后3个月上腹部增强 CT 或MRI动脉期,所有目标靶区动脉期显影均消失且肿瘤标志物正常维持 4 周以上为完全缓解(complete response,CR);所有目标靶区动脉期显影直径总和减小30%以上为部分缓解(partial response,PR);所有目标靶区动脉期显影直径总和增加20%以上或者出现新发肿瘤病灶为疾病进展(progression development,PD);介于 PR和 PD 之间为疾病稳定(stable disease,SD)。客观有效率=CR+PR。
1.4 伦理学审查 本研究方案经由解放军总医院第五医学中心伦理委员会审批,批号: 2020-063-D,所纳入患者均签署知情同意书。
1.5 统计学方法 采用SPSS 26.0统计软件进行数据分析。GraphPad 8.0软件绘图。采用Kaplan-Meier法计算总生存情况以及无进展生存、局部控制率。
2 结果
2.1 一般资料 共纳入18例中晚期原发性肝癌行SBRT联合仑伐替尼患者,其中男15例,女3例,年龄26~72岁,中位年龄53岁。肿瘤直径≥5 cm者7例(39%),中位肿瘤直径4.2(1.0~15.6)cm。慢性HBV感染者17例(94%),HCV慢性感染者1例(6%),17例(94%)患者有肝硬化背景。出现血管侵犯及肿瘤肝外转移者14例(78%),其中10例(56%)仅出现血管侵犯,3例(17%)同时存在血管侵犯及肝外转移,1例(6%)仅出现肝外转移。肿瘤数目1~3个10例(56%),>3个8例(44%)。肿瘤位于右肝9例(50%),位于左肝5例(28%),分布于全肝4例(22%)。BCLC B期4例(22%),BCLC C期14例(78%)。肝功能Child-Pugh A级14例(78%),B级4例(22%)。中位AFP水平37.105(2.14~49 519)ng/ml。既往接受过其他治疗(手术切除、射频、介入等)者10例(56%)。
2.2 生存情况 随访至2020年11月30日,共有8例患者死亡,其中3例因肝衰竭死亡,3例因肿瘤进展死亡,1例因胆囊穿孔死亡,1例因消化道出血死亡。治疗开始后3、6、9、12、18个月的总生存率分别为100%、94%、83%、72%、67%(图1),无进展生存率分别为100%、67%、50%、22%、17%(图2),局部控制率为100%、94%、94%、94%、94%。中位总生存期(median overall survival,mOS)>18个月,中位无进展生存期(median progression-free survival,mPFS)为9个月。
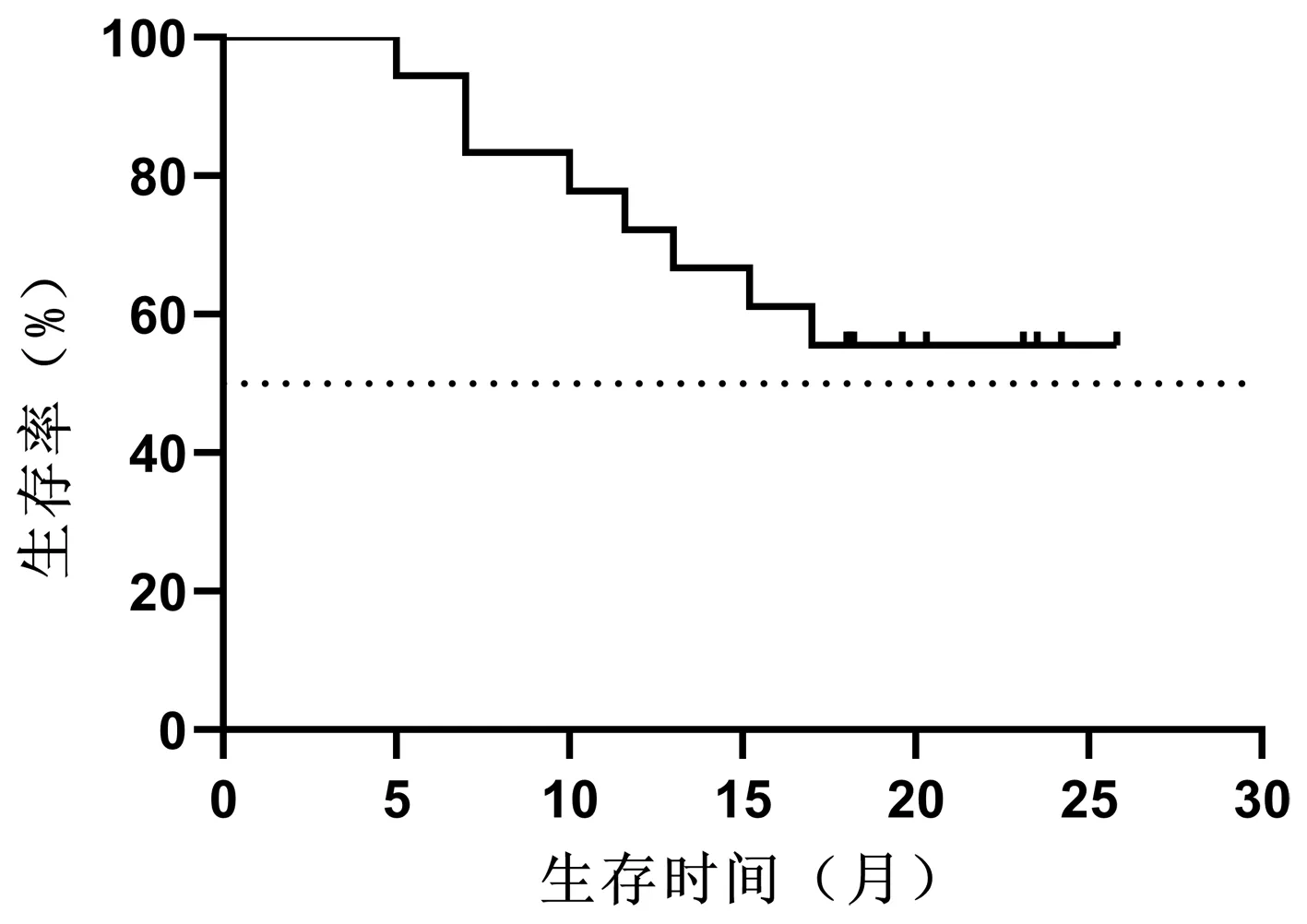
图1 累积生存率

图2 无进展生存率
2.3 肿瘤控制情况 序贯治疗后3个月,CR患者为4例(22%),PR患者为6例(33%),SD患者为6例(33%),PD患者为2例(11%),客观有效率为55.6%。
2.4 SBRT不良反应 在治疗过程中,5例(28%)患者出现1~2级胃肠道反应,表现为纳差、恶心;1例(6%)患者出现3级胃肠道反应,表现为严重恶心、呕吐,经对症治疗后症状缓解。无患者因无法耐受和/或肝功能异常而使放射治疗计划周期延长,所有患者均按计划完成放射治疗。
2.5 仑伐替尼治疗不良反应 在18例患者中,12例(67%)至少出现1次不良反应,其中2例(11%)患者因出现3级不良反应(分别表现为腹痛和腹泻)无法耐受而停药。无患者出现4~5级不良反应。不良反应发生率由高至低依次为高血压33%(6例)、蛋白尿17%(3例)、腹痛17%(3例)、腹泻11%(2例)、体质量下降11%(2例)、疲乏11%(2例)、腹胀6%(1例)(表1)。
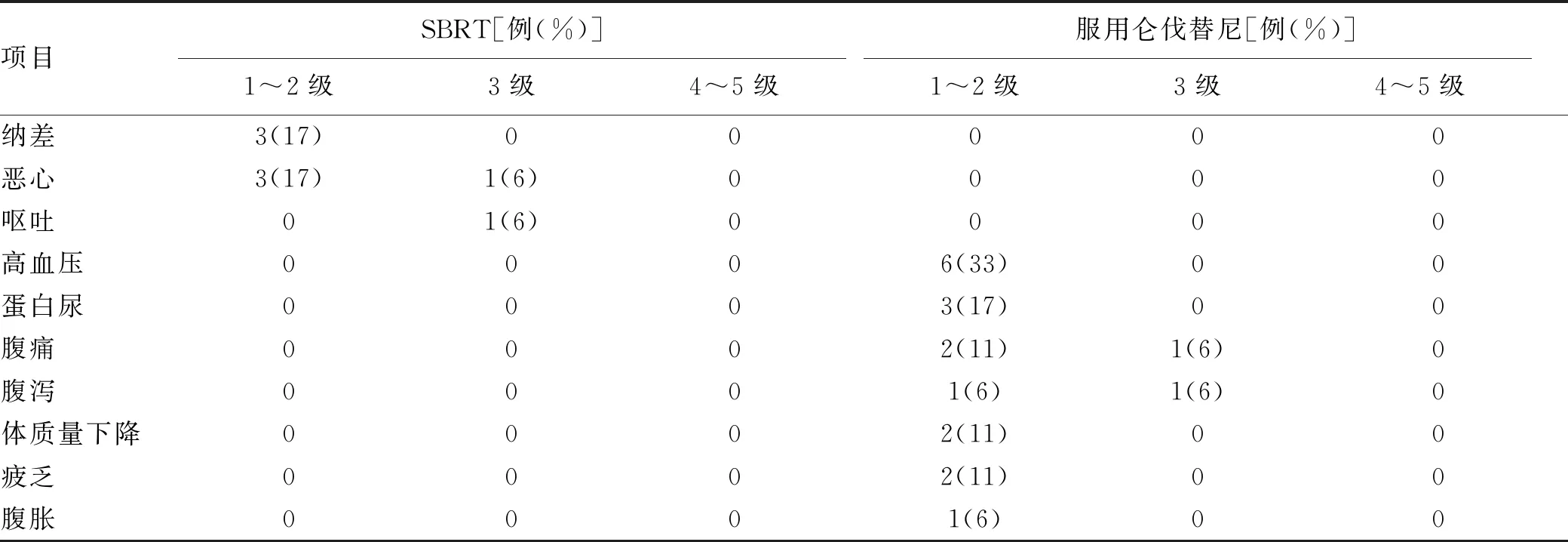
表1 SBRT和仑伐替尼治疗不良反应
2.6 不明原因不良反应 有7例(39%)患者出现1~2级白细胞、血小板减少或两者同时减少,其中6例(33%)出现1~2级白细胞减少,6例(33%)出现1~2级血小板减少,5例(28%)出现1~2级白血病、血小板两者同时减少,但原因未能明确。
3 讨论
尽管在过去15年中,早/中期肝癌患者的存活率有所提高,但晚期肝癌患者的预后仍未获得显著改善。美国癌症统计数据库SEER数据[17]显示,2008年—2013年与2001年—2007年相比,存在血管侵犯或转移性肿瘤的晚期肝癌患者5年生存率未能改善。
目前,SBRT治疗晚期肝癌的临床研究报道较少,仅限于一些单中心回顾性研究。2018年,欧洲放射治疗权威杂志RadiotherapyandOncology发表的研究[18]证实,SBRT治疗门静脉癌栓的有效率为70.7%,远高于其他放射治疗手段。本中心研究团队前期对射波刀SBRT治疗大肝癌临床样本开展回顾性研究[19],结果显示,3年总生存率达53.5%。同时,研究发现SBRT治疗的Ⅲa期HCC患者的肿瘤局部控制率高,在随访3年时局部控制率仍可达86%,但患者治疗后的无疾病进展生存率在随访3年时仅为36%,患者仍面临治疗后肿瘤复发和转移的难题。因此,寻找阻止或者延缓复发和转移的治疗方案是目前亟待解决的问题。
近10年来,酪氨酸激酶抑制剂——索拉非尼是唯一被批准用于肝功能保留的晚期肝癌患者的治疗药物。2016年,一项SBRT联合索拉非尼Ⅰ期临床研究[20]结果表明,当肝脏受照体积大时,毒性反应明显,因此不建议两者联用。关于仑伐替尼的Ⅲ期临床试验[13]中,仑伐替尼组mOS为13.6个月,mPFS为7.4个月;而索拉非尼组mOS为12.3个月,mPFS为3.7个月。本研究首次将SBRT与仑伐替尼联用治疗中晚期原发性肝癌,结果显示,mOS>18个月,mPFS为9个月,高于前文所述仑伐替尼Ⅲ期临床试验,且BCLC B期和C期占比为22%、78%,与Ⅲ期试验相近。
2020年5月,美国食品药品监督管理局基于IMbrave150[21]的研究数据,批准阿替丽珠单抗与贝伐单抗联合用于治疗既往未行系统治疗、不可切除局部晚期肝癌患者。IMbrave150[21]试验显示,阿替丽珠单抗与贝伐单抗联合治疗组6、12个月的估计生存率分别为84.8%和67.2%,mPFS为6.8个月。而本研究6、12个月的生存率分别为94%和72%,mPFS为9个月,但BCLC C期占比为78%,低于IMbrave150试验的82%。值得一提的是,本研究中有10例(56%)为既往接受过其他治疗(手术切除、射频、介入等)后复发的患者,而IMbrave150试验均为初治患者。
除治疗疗效以外,SBRT和仑伐替尼序贯治疗的副反应也是需要关注的重点。本研究中,所有患者的毒性反应均可耐受。有7例患者出现1~2级白细胞、血小板减少或两者同时减少,但原因未能明确。由于放射治疗和靶向治疗均可出现白细胞、血小板减少不良反应,且18例患者中有17例合并肝硬化背景,肝硬化合并脾功能亢进亦可使白细胞、血小板减少。
本研究为小样本回顾性研究,观察次数有限,可能对结果造成一定偏倚,且无法进行预后因素分析。
综上所述,本研究初步证实SBRT序贯仑伐替尼治疗中晚期原发性肝癌是有效、安全的治疗手段。为获取高级别的循证医学证据,尚需积极开展前瞻性随机、对照、多中心的大型临床试验。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:纪晓权、孙静负责起草及撰写文章;张爱民、张弢、李文刚、何卫平负责数据收集、统计与随访;段学章负责修改文章并最终定稿。
