昼夜节律及其相关基因与非酒精性脂肪性肝病的关系
2021-09-25赵晨露赵文霞
赵晨露, 赵文霞
1 河南中医药大学 第一临床医学院, 郑州 450016; 2 河南中医药大学第一附属医院 脾胃肝胆科, 郑州 450000
非酒精性脂肪性肝病(NAFLD)是常见的慢性肝病,组织学以肝脏脂肪积聚为特征,在疾病进展过程中可见肝脏脂肪变、肝纤维化、肝硬化甚至肝细胞癌[1]。NAFLD发病机制尚不明确,广泛接受的是“多重打击学说”,该学说在经典“二次打击学说”基础上,认为NAFLD发生与多种因素共同作用有关,包括胰岛素抵抗、遗传及表观遗传、肠道菌群、脂肪组织分泌的脂肪因子等[2]。最近有学者[3]认为昼夜节律紊乱可能成为NAFLD发病过程中的又一打击因素。本文基于近年来的相关数据,总结了昼夜节律基因参与NAFLD发病过程中的作用机制,为临床早期防治提供理论依据。
1 昼夜节律概述
1.1 昼夜节律的形成 哺乳动物的昼夜节律以24 h为一个周期,可精确调节睡眠-觉醒周期、进食-禁食周期、内分泌节律以及新陈代谢节律等生理活动[4]。昼夜节律是一种细胞自主的分子机制,昼夜节律振荡器赋予相关基因有节律的表达,将生理和行为同步到昼夜周期内[5]。哺乳动物昼夜节律振荡器由分子钟操作,位于下丘脑视交叉上核中的生物振荡器又称为中心时钟或主时钟[6],其可通过体液(皮质醇、褪黑激素等)、物理(温度变化)和神经的输出信号来调节外围时钟(包括肝脏、脂肪组织、胰腺等),从而协调新陈代谢功能[7]。
1.2 昼夜节律的分子调控 分子钟由多个转录-翻译反馈环组成(图1),其中核心循环包括周期蛋白(period, PER)和隐花色素家族 (cryptochrome,CRY),它们的表达被大脑和肌肉芳香烃受体核转运蛋白1(brain and muscleArnt-like protein-1, BMAL1)和昼夜运动输出周期蛋白(circadian locomotor output cycles kaput, CLOCK)激活,后两者组成的异二聚体与E-box增强子序列结合后,可以启动PER和CRY基因的转录[8],随后在细胞质中形成PER:CRY异二聚体,进入细胞核后抑制BMAL1∶CLOCK介导的转录,形成第一条自主反馈环路;BMAL1∶CLOCK异二聚体还可以诱导过氧化物酶体增殖物激活受体α(peroxisome proliferators-activated receptors α, PPARα)、视黄酸相关孤儿核受体(retinoid-related orphan nuclear receptors,ROR)、核激素受体REV-ERB等核受体的转录,PPARα和ROR可以激活BMAL1基因的表达,而REV-ERB则抑制BMAL1转录提供负反馈[9],形成了第二条自主反馈环路;最近研究[10]已发现DECs(DEC1和DEC2)的表达也起着时钟基因的功能,DEC可以通过与BMAL1结合或者与BMAL1∶CLOCK竞争E-box的结合位点来抑制自身的转录,DEC还可以抑制Per1的转录,这可以形成第三条自主反馈环路;此外,研究[11]发现白蛋白D位点结合蛋白基因和E4BP4可以结合D-box,激活和抑制转录以稳定和微调PER /CRY反馈环,从而促进第四环的形成。这种相互作用对于产生和维持昼夜节律机制的正确运作至关重要。

图1 昼夜节律的分子调控机制
2 昼夜节律与NAFLD的关系
相关临床研究[12]显示,经常轮班倒班的女护士2型糖尿病的发生风险较高,且与轮班倒班的工作年限呈正相关(1~5年、5~9年、≥10年其2型糖尿病发生风险分别为1.09、1.28、1.47);慢性睡眠限制和昼夜节律中断会导致体内32%的胰岛素分泌减少,这可能是促使此类人群患糖尿病风险增高的原因[13]。熬夜、轮班等生活方式使内部时钟与环境时态之间失去同步,导致昼夜节律紊乱,打乱了体内胰岛素、瘦素、脂联素、褪黑素分泌的固有节律,导致进食行为改变、糖脂代谢改变以及体质量增加,促使NAFLD、肥胖、2型糖尿病等代谢性疾病的发病率大大增加[14]。基础研究[15]亦发现,改变明暗周期(光照20 h,黑暗4 h)后夜间沙漠啮齿动物出现了肝组织结构的改变和肝细胞代谢活性的下降,前者以广泛分散的炎症灶、白细胞浸润、结缔组织延伸为主,与Kupffer细胞激活趋化中性粒细胞有关;后者以高血糖、血脂波动等代谢紊乱为主,与光照周期改变引起的PER2基因节律表达的破坏有关。与其他外周组织的昼夜节律相比,肝脏的昼夜节律更容易受持续光照的影响,持续光照明显降低了肝脏中CLOCK、BMAL1、CRY1、PER1和大多数参与肝脂质代谢的基因的节律性表达[16]。这些证据均表明,昼夜节律能够影响肝脏的代谢活性。
2.1 昼夜节律基因参与脂质代谢
肝脏是脂质代谢的主要场所,通过调节脂蛋白的合成、脂质的吸收和转化、脂肪酸的氧化来参与脂质代谢。全基因组基因表达研究[17]证实了肝脏多种生理活动均受昼夜节律的调节,其中包括肝脏脂质代谢。昼夜节律基因通过调节脂质代谢过程中的限速酶和转运蛋白的表达,从而维持脂代谢平衡,防止脂肪过多堆积。其中CLOCK、BMAL1、REV-ERB、ROR、PER、CRY等昼夜节律基因是脂质代谢的关键调节剂。
2.1.1 CLOCK/BMAL1 在不同的动物模型中,昼夜节律紊乱将导致脂质代谢障碍。CLOCK或BMAL1基因突变小鼠会产生高甘油三酯血症和高胆固醇血症[18],全身性敲除CLOCK基因的小鼠模型表现出饮食增加、高脂血症和体质量增加[19]。BMAL1在脂肪储存、利用和脂肪细胞分化中起重要作用。全身性BMAL1敲除小鼠表现出葡萄糖耐受不良、低胰岛素血症、脂肪储存减少、肝脏和肌肉中异位脂肪形成增加以及即使常规喂食也会引起肝脂肪变性[20];肝脏特异性BMAL1敲除小鼠在禁食期间表现出低血糖、游离脂肪酸水平升高、肝甘油三酯增加等血脂异常[21]。脂肪细胞BMAL1特异性缺失导致小鼠肥胖、食物摄入的昼夜节律发生改变,血浆甘油三酯和葡萄糖水平的昼夜节律变化消失[22]。
2.1.2 REV-ERB/ROR REV-ERB和ROR基因是将生物钟与脂质代谢联系起来的重要组成部分。REV-ERB和ROR已被证明与脂肪细胞的分化、脂肪形成和脂质储存有关[23-24]。REV-ERB和ROR分别作为转录抑制因子和激活因子,共同控制参与脂质代谢的蛋白质及靶基因的昼夜节律表达[25]。REV-ERB和ROR可以识别相同的DNA结合位点但执行相反的调节功能[26]。全身双敲除REV-ERBα和REV-ERBβ小鼠出现核心时钟和脂质代谢相关基因的节律表达发生改变,出现高血糖、高脂血症和肝脂肪变性[27]。相比之下,RORα及其配体可以诱导超氧化物歧化酶(superoxide dismutase,SOD)2和谷胱甘肽过氧化酶(glutathione peroxidase,GPx)1的表达,减少肝脏的氧化应激和炎症反应,从而减轻非酒精性脂肪性肝炎[28];此外,研究[29]发现RORα还可以增强肝脏Kupffer细胞的M2极化,通过分泌抗炎和免疫调节性细胞因子IL-10来保护肝细胞免受损伤。
2.1.3 PER/CRY PER2除了与核心时钟基因结合外,还可以通过抑制白色脂肪和肝脏中PPARα、PPARγ的转录来调节脂质代谢[30]。PER3可以通过两种方式调节脂肪形成:(1)通过调节脂肪细胞前体细胞的节律来调节体内脂肪形成;(2)通过调节Krüppel样因子的表达来参与脂肪形成,当删除PER3时脂肪形成节律丧失,脂肪生成增加以及肝脏发生脂肪变性[31]。
这些证据表明与脂质代谢相关的昼夜节律基因的表达异常可以诱发宿主脂代谢节律丧失,从而促进了肝脏脂肪沉积。
2.2 昼夜节律基因参与葡萄糖代谢 葡萄糖代谢是一个严格的调节过程,涉及胰腺产生胰高血糖素和胰岛素、肝脏中的糖原分解和糖异生作用以及肌肉和脂肪组织在胰岛素作用下从血液中摄取葡萄糖[32]。在哺乳动物中,存在于各种组织和器官中大约80%的蛋白质编码基因在转录水平上显示出昼夜节律振荡。参与糖代谢过程的激素(如胰高血糖素、胰岛素、瘦素等)的血浆水平显示出昼夜节律振荡[33]。
目前研究较多的与糖代谢密切相关的昼夜节律基因是BMAL1基因,其模型包括全身BMAL1基因敲除和外周组织特异性BMAL1基因敲除(表1)。全身BMAL1基因敲除小鼠不仅出现血脂紊乱、肝脏、肌肉、脂肪组织中脂质沉积等脂代谢紊乱的表型,而且也观察到糖代谢异常的现象,如葡萄糖耐量减低、胰岛素分泌减少,以及胰岛素抵抗和肥胖[34-35]。也有报道[36]显示全身或者血管平滑肌BMAL1基因敲除小鼠出现了血压、心率的昼夜节律紊乱,可能与血管重塑受损、血管损伤以及血管内皮功能紊乱有关。
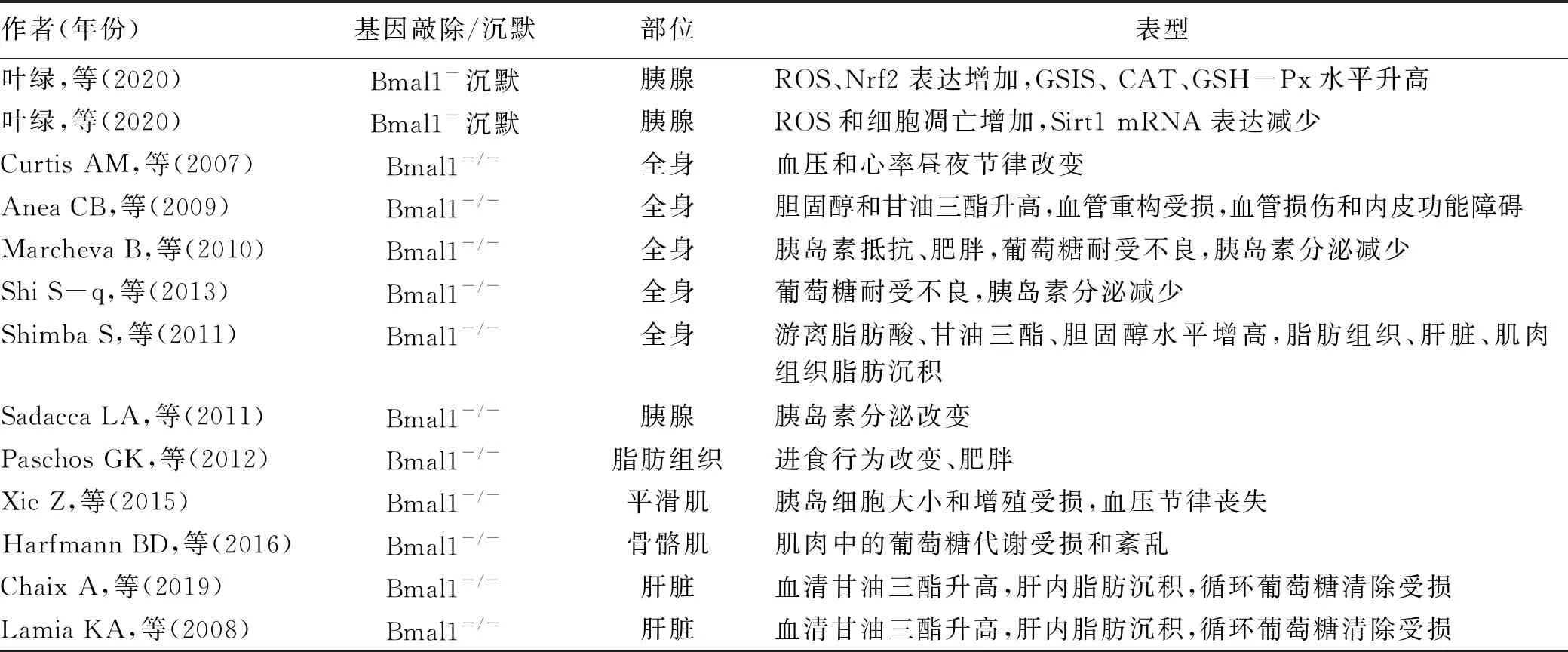
表1 不同部位昼夜节律基因BMAL1敲除或沉默对糖代谢的影响
胰腺特异性BMAL1基因敲除小鼠出现了胰岛素分泌改变。由于胰岛β细胞内抗氧化酶基因表达水平较低,SOD水平仅为肝脏的30%,过氧化氢酶(catalase,CAT)及GPx仅为肝脏的5%[37],因此β细胞清除活性氧(reactive oxygen species,ROS)、抗氧化能力较弱,对氧化应激损伤更敏感[38]。研究[39]显示,抑制胰腺β细胞BMAL1基因表达后,核因子E2相关因子2(nuclear factor-E2 related factor 2, Nrf2)mRNA表达增加,CAT和GPx表达减少,提示抑制BMAL1基因表达会导致高水平的氧化应激状态,超出了β细胞的抗氧化能力,导致细胞氧化应激损伤。同时电镜下观察到抑制BMAL1表达后,β细胞表现出线粒体肿胀、线粒体嵴断裂和消失,进一步说明了BMAL1基因表达异常是通过氧化应激途径导致了β细胞功能损伤。另一项研究[38]发现,将小鼠胰腺β细胞BMAL1基因沉默后,去乙酰化酶Sirt1基因表达减少,Sirt1在细胞凋亡中起重要的调节作用,主要通过组蛋白/非组蛋白去乙酰化影响基因转录,从而发挥抗氧化、减少细胞凋亡、增加细胞存活率的作用。提示BMAL1基因主要通过调节氧化应激通路影响胰岛β细胞的功能和凋亡。
BMAL1不仅在胰腺中,而且对肝脏、骨骼肌、脂肪组织等外周器官的糖代谢有重要作用。肝脏BMAL1敲除小鼠在禁食期间表现出低血糖,参与肝脏糖代谢基因的昼夜节律表达改变,血液中葡萄糖清除受损[40]。小鼠骨骼肌BMAL1特异性缺失造成葡萄糖摄取减少、葡萄糖转运蛋白表达降低,由于参与骨骼肌糖酵解的关键酶活性降低,导致肌肉组织葡萄糖代谢受损,使小鼠体内葡萄糖稳态受到干扰,发生葡萄糖耐量降低或胰岛素抵抗[41]。同样小鼠脂肪组织BMAL1特异性缺失导致肥胖、食物摄入的昼夜节律改变,血浆甘油三酯、葡萄糖水平的昼夜节律变化消失[42],提示脂肪组织BMAL1基因与脂质代谢、脂肪酸氧化和能量稳态调节有关。这些证据表明,外周生物钟在葡萄糖的调节中同样起着重要作用。
2.3 昼夜节律影响肠道菌群 研究[43]表明肠道菌群的改变参与了NAFLD的发生。Snijder等[44]首次在蓝藻菌和真菌中发现其代谢水平呈现昼夜节律性,与光照时间有关。随后的一系列实验证实了肠道菌群也存在昼夜变化。这种昼夜节律变化主要表现在肠道菌群的组成与丰度、功能活动两方面。在组成与丰度方面,通过将小鼠置于模拟的人工昼夜环境中(12 h光照、12 h黑暗),在ZT0、ZT6、ZT12、ZT18时分别进行粪便取样以及细菌测序,结果显示15%的菌群在丰度方面呈现出周期性变化,大多属于梭菌目、乳杆菌目以及拟杆菌目[45]。其中拟杆菌门的总数在23∶00和11∶00波动较大,其他时间波动较小,而厚壁菌门的总数昼夜波动较小,由此推测拟杆菌门数量的昼夜波动是构成肠道菌群昼夜节律的主要驱动力[46]。在功能活动方面,由于肠道菌群在数量上呈现昼夜波动,其也导致肠道菌群的功能随之波动,从而适应宿主的生理代谢。啮齿类动物在夜间进食期间,宿主的能量代谢等活动较活跃,同时伴随肠道菌群中的厚壁菌门、拟杆菌门数量增多;在白天休眠时期,宿主的解毒、胃肠蠕动等活动较活跃,同时伴随肠道菌群中的乳杆菌数量增多[45]。此外,肠道黏膜通透性也受到昼夜节律基因的控制,可能与紧密连接结构中的闭合蛋白和紧密连接蛋白1的昼夜节律性表达有关[47]。
肠道菌群的节律性变化是由宿主驱动的,宿主进食-禁食节律可调节肠道微生物的功能,因此,明暗交替是哺乳动物中枢生物钟的授时因子,进食时间是肠道菌群生物钟的授时因子。PER1/2双敲除小鼠表现出肠道菌群和其部分功能的昼夜节律明显改变,但是给予长期规律性饮食后发现肠道菌群的部分节律性得到了恢复[48],说明改变宿主饮食的节律性可以恢复肠道菌群的节律性波动,提示对于因肠道菌群失调引起的肥胖、2型糖尿病、代谢综合征、脂肪肝等代谢疾病的治疗可以从调整节奏性饮食的角度思考。
2.4 昼夜节律基因参与氧化应激 氧化代谢是所有需氧生物的正常生理过程,也是ROS的主要来源。生理条件下多余的ROS被细胞抗氧化系统清除。当氧化分子(如超氧化物和过氧化氢)的产生超过抗氧化分子(如CAT、GPx、SOD、NAPDH)的清除能力时,就会发生氧化应激。ROS清除系统对于代谢细胞的功能和存活至关重要,过量的ROS会引起脂质和蛋白质的过氧化以及蛋白质和核酸的氧化修饰,从而引起代谢和心血管并发症[49]。氧化应激可通过刺激脂肪前细胞增殖、脂肪形成和慢性炎症而引起脂肪组织功能障碍,从而导致肥胖[50]。同样氧化应激在NAFLD的发生、发展中起关键作用,ROS引起脂质过氧化,继而导致炎症反应和肝星状细胞的激活,促进纤维化的发生[2]。
在昼夜周期中,脂质过氧化和蛋白质氧化水平在关键的代谢器官或组织(如肝脏和肌肉)中表现出昼夜节律性。许多具有抗氧化作用的酶(如GSH-Px、SOD)以及褪黑素等在其表达或活性水平上具有昼夜节律性,因此氧化应激与生物钟有着先天的联系[51]。在哺乳动物细胞和小鼠肝脏中观察到H2O2水平的昼夜节律振荡,并可以通过半胱氨酸氧化直接调节CLOCK昼夜节律功能[52]。烟酰胺腺嘌呤二核苷酸(NAD)不仅自身具有昼夜节律振荡,而且是能量代谢和昼夜节律控制之间的重要环节[53]。CLOCK:BMAL1异二聚体的结合活性取决于细胞的氧化还原状态,即NADH/NAD和NADPH/NADP比值,而NADPH/NADP比值以昼夜节律振荡[54]。磷酸戊糖途径可以通过NADPH代谢来调节肝脏生物钟。抑制磷酸戊糖途径可以增加氧化应激、延长昼夜节律、激活Nrf2通路、增加CLOCK:BMAL1异二聚体DNA的结合并改变钟控基因的表达[55]。以上证据支持氧化应激和昼夜节律相互关联的假设,昼夜节律调节细胞氧化还原功能的节律性振荡,而细胞中氧化还原状态的变化也会影响生物钟基因。
2.5 昼夜节律基因参与内质网应激 蛋白质的折叠和组装主要在内质网中完成,内质网通过精细的机制保证折叠正确的蛋白质输出并发挥其功能,但是对于折叠不正确的蛋白质,内质网在分子伴侣的配合下将其组装成天然复合物进行降解。当细胞或环境应激源破坏内质网功能时,未折叠的或者折叠错误的蛋白质就会在内质网中聚集,这种情况称为内质网应激。机体为了应对内质网应激,细胞激活一系列复杂而协调的信号转导途径,称为未折叠蛋白反应(unfolded protein reaction, UPR)[56]。UPR是一种生存反应,可以修饰转录和翻译程序以恢复内质网稳态。
UPR途径主要由3种细胞应激传感器启动:跨膜激酶/核酸内切酶1、双链RNA活化蛋白激酶样激酶、活化转录因子6。UPR在维持肝脂质稳态方面起着关键作用,在应激条件下,UPR的破坏会导致肝脂肪变性和非酒精性脂肪性肝炎。敲除或者抑制小鼠肝脏中跨膜激酶/核酸内切酶1或活化转录因子6,会导致在急性内质网应激或高脂饮食条件下发生肝脂肪变性[57]。此外,内质网应激诱导的转录激活因子XBP1缺乏时也会导致肝脂质蓄积[58]。以上证据表明肝脏UPR途径可以防止肝脂质沉积。
参与肝脏代谢的许多酶位于内质网膜上,昼夜节律会影响肝脏的脂质代谢和内质网定位酶。昼夜节律紊乱导致XBP1介导的UPR激活的节律振荡,并引起内质网定位酶的失调,导致固醇调节元件结合蛋白转录因子的异常激活[59],促使脂质生成增加,诱发肝脏脂肪变。
3 小结
综上所述,昼夜节律基因参与了NAFLD发病过程中的多种机制,目前昼夜节律相关的动物实验模型以全身基因敲除为主,肝脏特异性昼夜节律基因敲除的研究较少,因此需要进一步开展肝脏特异性基因敲除的基础研究,而且有必要开发一种具有人类轮班工作特征的标准动物模型,以更好的理解昼夜节律基因在外周器官中的作用机制,继续阐述昼夜节律基因与NAFLD发病的分子途径和机理,为临床治疗提供数据。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:赵晨露负责撰写论文;赵文霞负责指导撰写文章、修改论文。
