玉木耳多糖体外消化及抗氧化活性研究*
2021-09-25王鹏,刘静,韩晶,马雪,李杨,郭丽
王 鹏,刘 静,韩 晶,马 雪,李 杨,郭 丽
(绥化学院食品与制药工程学院,黑龙江 绥化 152061)
玉木耳(Auricularia cornea Ehrenb.)是近年来吉林农业大学李玉院士团队从毛木耳(Auricularia polytricha)菌株选育获得的,具有稳定遗传特征的天然变异品种[1]。玉木耳子实体为白色,营养丰富,作为优质高产新品种在全国广泛推广。玉木耳是药食同源的食用菌,其中天然高分子化合物多糖发挥良好的药理作用,玉木耳中多糖含量约为7%左右[2-3]。研究发现玉木耳多糖具有良好的抗氧化、抗炎抗肿瘤、保肝、抑菌作用[4-7],因而引起了越来越多学者的兴趣。
近年来,对玉木耳多糖的研究主要集中在玉木耳多糖的提取优化、结构表征,玉木耳多糖与食品成分间相互作用和功能活性,以及功能食品研究等方面。吴玉柱等[3]采用超声波辅助法优化提取具有良好抗氧化活性的玉木耳多糖,得率为7.43%;张蕾等[5]采用超声辅助醇提法获得含量为9.75%的玉木耳多糖;王银平[8]采用热水浸提和超声辅助法分别提取玉木耳多糖,使用DEAE-纤维素DE-52离子交换柱和Sepharose CL-6B凝胶柱对玉木耳多糖进行分离纯化和结构表征分析。李妍等[9]研究发现玉木耳多糖的添加使玉米淀粉-多糖复配体系具有较好的稳定性和抗氧化性,玉木耳多糖的添加可提高体系淀粉的有序结构,使凝胶结构均匀致密。刘岩、金凤石[10-11]研发出具有抗运动疲劳的玉木耳饮料,该饮料可明显延长小鼠负重游泳时间。曹玉春等[6]研究发现玉木耳提取物对H22荷瘤小鼠体内抗肿瘤作用效果显著。罗敬文[7]采用水提醇沉法获得玉木耳、黑木耳和毛木耳多糖,相同提取条件下,玉木耳多糖提取率最高为13.87%,获得的玉木耳多糖对金黄色葡萄球菌和枯草芽孢杆菌有较好的抑制作用,同时具有显著的抗氧化能力。另有试验研究表明玉木耳多糖具有抗氧化活性[3,5,7,12],但其在动物体内是否具有抗氧化作用还未见报道。
体外消化系统模型被广泛应用于食品或药品在消化道中运行状态及消化特性的研究,通过将物质依次暴露于模拟的口腔、胃和小肠条件下,模拟食物成分在人体消化道中的运输过程[13]。大量研究报道表明山药、海带等植物多糖经体外模拟胃肠消化后具有抗氧化活性[14-16]。因此,通过模拟唾液、胃肠消化系统,研究玉木耳多糖消化行为和抗氧化活性变化,以期为玉木耳多糖的肠道功效奠定理论基础,为指导利用玉木耳等食用菌多糖进行抗氧化食品开发提供理论依据。
1 材料与方法
1.1 材料与仪器
玉木耳干品,吉林农大玉木耳合作社;胃蛋白酶(300 000 U·g-1)、胰酶(8 000 U·g-1)、猪胆盐(纯度≥98%)、胰蛋白酶(250 000 U·g-1),上海生工生物工程有限公司;胃脂肪酶(30 000 U·g-1),日本天野酶制剂株式会社;ABTS[2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸二铵盐]、TPTZ[2,4,6-三 (2-吡啶基) 三嗪]、1,1-苯基-2-三硝基苯肼(DPPH)、3,5-二硝基水杨酸(DNS),上海阿拉丁试剂有限公司;可溶性淀粉,天津市瑞金特化学品有限公司。
KQ-600D型数控超声波清洗机,昆山市超声仪器有限公司;752型紫外可见分光光度计,上海析谱仪器有限公司;80-2B型离心机,湖南星科科学仪器有限公司;FW135型高速万能粉碎机,天津市泰斯特仪器有限公司;SHZ-D(Ⅲ) 型循环水式真空泵,上海科雳仪器设备有限公司;FD-27真空冷冻干燥机,北京德天佑科技发展有限公司;HL-2恒流泵,上海青浦沪西仪器厂;RE-52AA旋转蒸发器,上海亚荣生化仪器厂。
1.2 试验方法
1.2.1 玉木耳多糖的提取方法
参照郭国丽[17]的方法,进行一定的改进。将玉木耳粉碎后用60目的筛网过筛,用60倍体积的蒸馏水浸泡12 h,在100℃水浴中密封浸提3 h,在浸提过程中用电动搅拌机(200 r·min-1)搅拌,期间用水补足至初始体积;将浸提后的玉木耳全液进行抽滤,置于离心机中离心 (4 000 r·min-1,10 min),收集上清液,沉淀再次浸提,反复浸提3次。将3次所得上清液汇总后于旋转蒸发器(50℃)中浓缩到原体积的1/3。
将浓缩液与3倍体积乙醇(95%) 混匀置于4℃放置 12 h,离心 (5 000 r·min-1,10 min) 后得到沉淀,用去离子水将沉淀混合溶解后置于-20℃预冻;最后将预冻好的混合物放在真空冷冻干燥机中冻干(-70℃,1 Pa) 28 h,得到玉木耳多糖。
1.2.2 模拟唾液消化多糖
参照参考文献[18],进行人体口腔唾液的采集。选择3位没有慢性疾病且4个月内没有服用过抗生素类药物的志愿者,在收集唾液之前确保志愿者没有进食与喝水。首先志愿者先用少量的去离子水漱口3次,使口腔内的pH保持中性,吐出的第1次唾液舍弃不用;给志愿者1个带有刻度的试管,让志愿者以每30秒吐1次的频率向试管中吐唾液15 mL;采集到唾液后将其放入离心机(5 000 r·min-1,10 min)中,去除细胞组织,采集上清液置于-20℃条件下保存备用。
唾液淀粉酶活性的测定[19]:用磷酸缓冲液(pH 6.5) 配制2%的可溶性淀粉溶液,煮沸后取20 mL溶液,向其中加入80 mL蒸馏水稀释,加热至37℃,加入2 mL的唾液混匀,取0.3 mL混合液与0.3 mL的1%的碘液混合,观察混合液的颜色变化。每隔10 s进行1次观察,直到蓝色完全消失。唾液中淀粉酶活性(D,U·mL-1)计算公式为:

式中:v为唾液的体积(mL);n为蓝色消失的时间 (s)
模拟唾液消化[20]:配制2 mg·mL-1玉木耳多糖溶液,溶解至无颗粒(可加热至40℃)。取3支带有刻度的试管,标注好A组、B组、C组。A组(空白对照):唾液2 mL与蒸馏水2 mL;B组(消化前):多糖溶液2 mL与蒸馏水2 mL;C组(消化后):唾液2 mL与多糖溶液2 mL。将试管放入37℃的恒温水浴锅中孵育5 min,再置于沸水中灭酶5 min测其各项指标。
1.2.3 模拟胃部消化多糖
胃液的配制[21]:预配制胃电解质溶液2 L,其中包 括 2.2 g KCl、 6.2 g NaCl、 0.3 g CaCl2、 1.2 g NaHCO3。用HCl(0.1 mol·L-1)将胃电解质溶液的pH调到3。取1 500 mL的胃电解质溶液,向其中加入350 mg的胃脂肪酶、350 mg的胃蛋白酶和3 mL CH3COONa (1 mol·L-1、pH 5) 溶液,搅拌均匀后用0.1 mol·L-1的HCl将pH调至3,胃液配制完成。
模拟胃部消化[22]:配制2 mg·mL-1玉木耳多糖溶液,溶解至无颗粒(可加热至40℃),将溶液放在磁力搅拌器上,在37℃条件下连续搅拌,同时以0.56 mL·min-1的速度向多糖溶液中恒速泵入胃液,并且用0.1 mol·L-1的HCl将多糖溶液pH控制在3。于消化过程中的0、1 h、2 h、3 h、4 h、5 h、6 h时测定其各项指标。
1.2.4 模拟肠道消化多糖
肠液的配制[21]:预配制肠电解质溶液1 L,其中包括KCl 0.65 g、NaCl 5.4 g、CaCl20.33 g,用NaOH(0.1 mol·L-1)将肠电解质溶液的pH调至7。配制7%胰酶溶液和4%胆酸盐溶液,取500 g肠电解质溶液,向其中加入0.13 g胰蛋白酶、500 g胰酶溶液、1 000 g胆酸盐溶液,混匀后用NaOH(0.1 mol·L-1)将pH调至7,肠液配制完成。
模拟肠道消化[22]:取经胃部消化后的多糖溶液放于烧杯中,将烧杯置于37℃的磁力搅拌器上连续搅拌,并同时以0.56 mL·min-1的速度向多糖溶液中连续恒速的泵入肠液,用1 mol·L-1的NaHCO3将多糖溶液的pH控制在7。于消化过程中的0、1 h、2 h、3 h、4 h、5 h、6 h时测定其各项指标。
1.3 测定方法
1.3.1 还原糖含量测定
采用3,5-二硝基水杨酸(DNS) 法测定还原糖含量。取1 mL多糖溶液加入0.75 mL的DNS溶液,沸水浴5 min后取出,冷却到室温,用蒸馏水补至5 mL后震荡摇匀,于540 nm下测定其吸光度。
1.3.2 多糖含量测定
采用苯酚硫酸法测定多糖含量。取1 mL多糖稀释液加入1 mL苯酚(5%) 和5 mL硫酸,静置10 min,在30℃恒温水浴锅中反应20 min,于490 nm下测定其吸光度。
1.3.3 抗氧化活性的测定
ABTS自由基清除能力测定:将25 mL的ABTS(7 mmol·L-1)溶液与25 mL的过硫酸钾(2.45 mmol·L-1)溶液混合避光放置16 h~24 h得到ABTS反应液,用磷酸缓冲液(pH 7.4) 将ABTS反应液稀释,在分光光度计中测其吸光度值的范围在0.70±0.02则为合格;0.03 mL多糖溶液加入3 mL的ABTS反应液,在20℃下反应6 min,于734 nm下测定其吸光度;ABTS自由基清除率(I,%)计算公式:
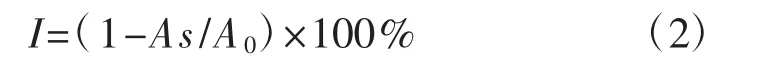
式中:A0为空白对照组吸光度(pH 7.4磷酸缓冲液);As为消化后的多糖溶液反应后的吸光度。
FRAP亚铁离子还原能力测定:醋酸-醋酸钠缓冲液(0.3 mol·L-1、pH 3.6)、盐酸(40 mmol·L-1)配制的TPTZ(10 mml·L-1)及超纯水配制的FeCl3(20 mmol·L-1)溶液,将以上3种溶液按照体积比10∶1∶1混合后制得FRAP溶液。0.1 mL多糖溶液加入1.8 mL FRAP,再加入3.1 mL去离子水,在20℃下反应8 min,于593 nm下测定其吸光度;FRAP亚铁离子还原能力(A)计算公式:

式中:As为消化后的多糖溶液反应后的吸光度;A0为空白对照组吸光度。
DPPH自由基清除能力:样品组Ai为2 mL消化后的多糖溶液与2 mL的DPPH溶液充分混合;空白组Aj为2 mL消化后的多糖溶液与2 mL无水乙醇充分混合;对照组Ac为2 mL去离子水与2 mL的DPPH溶液充分混合。混合后的溶液立即用分光光度计在517 nm下测定其吸光度值,之后放在避光处30 min后测定吸光度。DPPH自由基清除率(I,%)计算公式为:

羟自由基清除能力:对照组Ap为取2 mL磷酸缓冲液(0.2 mol·L-1)加入1.0 mL去离子水后,加入1.0 mL的FeSO4(0.75 mol·L-1),随后再加入1.0 mL的H2O2(0.01%) 震荡1 min,最后加入1.0 mL邻菲罗啉;空白组Ab为取2 mL磷酸缓冲液(0.2 mol·L-1)加入1.0 mL去离子水,以及1.0 mL FeSO4(0.75 mol·L-1)后,再加入1.0 mL去离子水震荡1 min,最后加入1.0 mL邻菲罗啉;样品组As为取2 mL磷酸缓冲液(0.2 mol·L-1)加入1.0 mL消化后的多糖溶液,加入1.0 mL的FeSO4(0.75 mol·L-1),再加入1.0 mL的H2O2(0.01%) 后震荡1 min,最后加入1.0 mL邻菲罗啉。用分光光度计在波长536 nm下测定其吸光度值。羟自由基清除率(d,%)计算公式:

1.4 数据处理
所有试验数据均采用SPSS 19.0统计软件分析,每组试验重复3次,数据结果以平均值±SD的方式表示。采用ANOVA进行邓肯氏多重差异分析。
2 结果与分析
2.1 模拟唾液消化时玉木耳多糖含量及抗氧化活性变化
2.1.1 模拟唾液消化玉木耳还原糖、多糖含量变化
口腔是消化道的起始部分,各类食物经过口腔的咀嚼以及唾液的分泌,可将其分解成小块,使食物更有利于胃肠的消化吸收。唾液则是食物接触到人体的第一种消化液,人唾液组成成分存在个体差异,但存在一定的范围。还原糖是一种具有还原性的糖类,由于多糖容易聚集成聚合物,而聚合物的破裂或者是分子链之间的糖苷键断裂会使多糖被还原成还原糖。针对玉木耳多糖在唾液消化前后多糖含量的变化进行分析,试验所用唾液的淀粉酶活性为181.17 U·mL-1,结果见图1。
如图1所示,在唾液消化前后,玉木耳还原糖含量有所差别,与B组(消化前)相比,C组(消化后) 中玉木耳还原糖含量显著上升趋势(P<0.05),上升幅度为164.8%。据文献报道,多糖分子链间糖苷键的断裂会引起还原末端含量的增加[23],可见消化液中酶类将多糖分子链间糖苷键断裂而使还原糖含量增加,这也与连紫璇[24]在人工唾液对玉米秸秆降解产物还原糖得率的影响中的研究结果一致,通过试验表明人工唾液可有效地增加还原糖得率。人的唾液中主要包括唾液淀粉酶、粘多糖、粘蛋白及溶菌酶等[25]。其中A组(空白对照) 中不包含还原糖,所以A组还原糖含量很少。
唾液消化多糖后,与B组(消化前)相比,多糖含量显著下降趋势(P<0.05),下降率为40.3%,可见玉木耳多糖受人体唾液的影响较大,人工唾液中酶类降解多糖,使多糖分子链之间的糖苷键断裂,导致C组(消化后) 多糖含量下降。A组(空白对照)中含有少量的多糖,这是由于唾液中本身就含有一些粘多糖。
2.1.2 模拟唾液消化玉木耳多糖消化液抗氧化活性
唾液消化玉木耳多糖消化液抗氧化活性研究试验结果见图2。
如图2所示,与消化前相比,消化后反应液清除ABTS自由基能力与FRAP还原能力都有显著上升趋势(P<0.05),上升率分别为2.9%和14.1%。分析清除能力显著上升的原因可能是由于在消化过程中,消化液中唾液淀粉酶的作用,使玉木耳多糖糖苷键断裂,产生了低分子量多糖,含有更多的具有还原性的游离羟基,提高了多糖的抗氧化能力。袁青霞[26]对桑葚多糖的抗氧化研究中也表明抗氧化活性与低分子量有关。而空白对照液与消化前后反应液相比,其清除ABTS自由基能力显著上升(P<0.05),上升率分别为40.7%和44.8%,这与狄彤[27]研究红江蓠多糖口腔消化后的抗氧化活性不同,分析原因可能是由于灭酶时间的不同,导致试验结果的差异。

图2 模拟唾液消化前后玉木耳多糖消化液抗氧化活性的变化Fig.2 Changes in antioxidant activity of Auricularia cornea polysaccharide by simulated saliva digestion
与B组(消化前)相比,C组(消化后)反应液DPPH自由基清除能力有显著上升趋势(P<0.05),上升了108.6%,分析原因可能是玉木耳多糖中含有带酚基团的糖类、硫酸基团以及糖醛酸等物质与DPPH自由基形成了较强的氢键[28],影响了多糖的生物活性,从而导致抗氧化活性的提高,消化前后反应液清除羟自由基的能力无显著性差异(P>0.05)。
2.2 模拟胃消化时玉木耳多糖含量及抗氧化活性
2.2.1 模拟胃消化玉木耳还原糖、多糖含量变化
胃消化玉木耳还原糖、多糖含量变化试验结果见3。
如图3所示,模拟胃消化0~6 h过程中,玉木耳还原糖含量呈显著性上升趋势(P<0.05),增幅约12.5%~33.3%。与消化起始时相比,消化6 h后的还原糖含量上升了29.2%,分析升高的原因可能是消化液中的胃蛋白酶与胃脂肪酶破坏了多糖分子间糖苷键结构,使还原末端量增加。也可能由于胃中酸性环境和胃电解质溶液体系使多糖的稳定性以及构象发生变化,闵芳芳等[29]在研究青钱柳多糖模拟胃消化时还原糖含量也出现上升趋势,与本试验趋势一致。由于玉木耳多糖在胃中没有被完全破坏,还原末端含量产生较少,所以还原糖含量总体偏低。胡捷伦[13]研究大粒车前子多糖的体外模拟胃消化,还原糖含量呈现上升趋势,与本研究还原糖含量变化趋势相似。

图3 模拟胃消化不同时间下玉木耳还原糖、多糖含量的变化Fig.3 Changes in reducing sugar and polysaccharide content of Auricularia cornea at different times of simulated gastric digestion
模拟胃消化0~6 h过程中,玉木耳多糖含量呈显著性下降趋势(P<0.05),与消化起始时相比,消化6 h后的玉木耳多糖含量下降了74.4%,分析下降的原因可能是胃部消化对多糖的结构造成影响,使糖苷键断裂,导致多糖分子量降低,最终导致玉木耳多糖含量下降。
2.2.2 模拟胃消化玉木耳多糖消化液抗氧化活性研究
胃消化玉木耳多糖消化液抗氧化活性试验结果见图4。
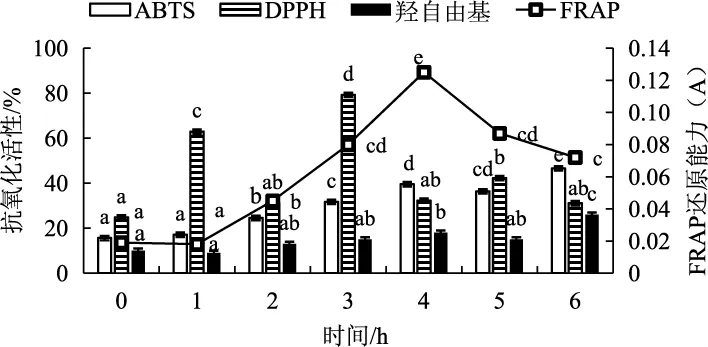
图4 模拟胃消化不同时间下玉木耳多糖消化液抗氧化活性的变化Fig.4 Changes in antioxidant activity of Auricularia cornea polysaccharide at different times of simulated gastric digestion
如图4所示,模拟胃消化0~6 h过程中,玉木耳多糖消化液对ABTS自由基和羟自由基的清除能力呈显著性上升趋势(P<0.05)。与消化初始相比,消化6 h后的清除能力分别上升了197.8%和160.0%,分析升高的原因可能是经过胃液的消化,多糖分子量逐渐降低,使抗氧化能力逐渐上升,这与刘恋[30]对条斑紫菜多糖模拟消化产物的抗氧化活性研究中羟自由基清除能力的上升趋势相似。
模拟胃消化0~6 h过程中,玉木耳多糖消化液对于DPPH自由基清除能力和FRAP亚铁离子还原能力都呈显著上升趋势(P<0.05),在消化3 h~4 h时,DPPH自由基清除能力与FRAP亚铁离子还原能力分别达到最高点并趋于稳定,与消化起始时间相比,消化3 h~4 h后的清除能力与还原能力分别上升了218.7%和84.8%。分析上升的原因是多糖经胃液消化后,多糖分子量降低,还原糖含量上升,还原末端量上升,导致还原能力与清除能力上升。多糖的还原能力与自由基清除能力在一定程度上也反应了其抗氧化能力的强弱,还原能力越强,抗氧化能力也越强。姚思雯等[31]对菠萝蜜多糖体外消化抗氧化活性研究中发现,菠萝蜜多糖对DPPH自由基清除能力影响的变化趋势与本研究相近。
2.3 模拟肠消化时玉木耳多糖含量及抗氧化活性
2.3.1 模拟肠消化玉木耳还原糖、多糖含量变化
肠消化玉木耳还原糖、多糖含量变化试验结果见图5。

图5 模拟肠消化不同时间下玉木耳还原糖、多糖含量的变化Fig.5 Changes in reducing sugar and polysaccharide content of Auricularia cornea at different times of simulated intestinal digestion
如图5所示,模拟肠消化0~6 h过程中,玉木耳还原糖含量呈显著性上升趋势(P<0.05)。与消化初始相比,消化5 h后的还原糖含量上升了74.1%,分析上升的原因是肠液中的胰酶、胰蛋白酶使多糖间糖苷键断裂,形成还原末端,使还原糖含量增加。对麦冬多糖[32]的体内消化研究发现,多糖进入肠道后与肠道内的内源性酶、内源性介质(胆汁)以及微生物(酶)发生作用,产生降解,可见体外模拟与体内消化具有一定共同性[33]。Hu等[16]在车前草多糖的体外模拟肠道消化模型的研究中发现,多糖降解同样与肠道内源性酶有关,并且还原糖含量也出现上升趋势。
模拟肠消化0~6 h过程中,玉木耳多糖含量呈显著性下降趋势(P<0.05),与消化初始相比,消化6 h后的多糖含量下降了69.4%,分析下降的原因是肠液对玉木耳多糖产生影响,玉木耳多糖下降的同时还原糖含量呈现上升的趋势,在消化4 h,多糖含量呈现显著下降(P<0.05),与此同时还原糖含量呈现显著上升趋势(P<0.05)。梅娜娜等[34]在金钗石斛多糖模拟消化的研究中,肠道部分其多糖分子质量也出现降低,其多糖趋势变化与本研究相似。
在体外模拟胃和肠的消化过程中,玉木耳多糖均呈现显著性下降趋势(P<0.05),并且存在着组间差异性(P<0.05)。通过试验数据发现,体外模拟胃消化过程中还原糖含量的上升比率远远高于体外模拟肠消化中还原糖含量的上升比率,说明胃中的胃电解质溶液以及胃蛋白酶对玉木耳多糖的降解能力更强。
2.3.2 模拟肠消化玉木耳多糖消化液抗氧化活性研究
肠消化玉木耳多糖消化液抗氧化活性试验结果见图6。

图6 模拟肠消化不同时间下玉木耳多糖消化液抗氧化活性的变化Fig.6 Changes in antioxidant activity of Auricularia cornea polysaccharide at different times of simulated intestinal digestion
模拟肠消化0~6 h过程中,玉木耳多糖消化液对ABTS自由基、DPPH自由基、羟自由基清除能力以及FRAP亚铁离子还原能力均呈显著性上升趋势(P<0.05)。在消化的4 h,抗氧化能力均处于最高点,与消化初始相比,消化4 h后的抗氧化活性分别上升了7.32倍、1.73倍、48.00倍和9.06倍,分析原因可能是在消化4 h时,由于胃蛋白酶、胰酶、胆汁、胃酸等的酶使糖苷键断裂,释放了较多的低分子量多糖,促进了抗氧化活性物质的释放[35]。刘璐[36]在降解树莓多糖的抗氧化研究中发现,树莓多糖对FRAP还原能力、DPPH自由基以及羟自由基的清除能力均呈现上升趋势,与本研究趋势相近。
3 结论
试验通过体外模拟唾液、胃肠道消化对玉木耳多糖的降解和抗氧化活性进行了研究。经过唾液、胃肠道消化后的玉木耳多糖含量呈现下降趋势,还原糖含量逐渐上升(P<0.05)。
玉木耳多糖在胃消化3 h时,DPPH自由基清除能力达到最高,为79.3%;在胃消化4 h时,FRAP亚铁离子还原能力达到最高,为0.125。在肠道消化过程中玉木耳多糖消化液对ABTS自由基、DPPH自由基、羟自由基清除能力以及FRAP亚铁离子还原能力均呈显著上升趋势(P<0.05),在消化4 h时,抗氧化活性均达到最高,对应值分别为41.3%、94.5%、98%、0.171。玉木耳多糖在胃肠道消化后仍具有抗氧化,研究结果可为口服玉木耳多糖作为抗氧化食品提供科学支持。后续有必要继续深入研究玉木耳多糖体外模拟消化产物的分子质量、多糖结构及组成变化情况,将更有助于详细了解玉木耳多糖的消化机制,对玉木耳多糖作为抗氧化食品的发展前景具有重要的意义。
