耐高温灵芝菌株的选育*
2021-09-25刘月芹罗丽媛刘欢瑞贺晓龙
刘月芹,罗丽媛,刘欢瑞,贺晓龙
(延安大学生命科学学院,陕西 延安 716000)
灵芝(Ganoderma lucidum Karst)是一种主要分布于我国东部和南部的腐生真菌,具有较高的营养、保健和医疗价值[1]。灵芝富含糖类(还原糖和多糖)、三萜类、黄酮类、多肽及生物碱等多种活性成分[2],具有抗肿瘤、抗氧化、抗病毒、补气安神、止咳平喘、延年益寿的功效,被广泛应用于人类各种疾病的预防和治疗中[3-6]。
根据食用菌对温度的要求,可分为低温型(18℃~21℃),中温型 (22℃~28℃) 和高温型(28℃~32℃) 3种类型[7]。灵芝属高温型菌类,菌丝体最适生长温度为25℃~30℃[7]。然而,近年我国中南部的大部分省市的夏季温度普遍在35℃~38℃,人工培养灵芝控温成本较高且污染较大,导致目前市场上灵芝产品的生产成本高,若能选育出耐高温的灵芝菌种并投入生产,则可使灵芝这一宝贵资源得到更高效的利用,使灵芝产品的市场前景更加广阔。
微生物菌种的选育方法包括诱变育种、杂交育种、原生质体融合技术、基因工程育种等[8-12]。在这些菌种选育的方法中,原生质体紫外诱变育种是目前实验室以及生产单位中最常用的菌种选育方法[13-16],同时食用菌原生质体制备与再生技术已经相对成熟,为本试验顺利开展奠定了良好的基础[17-18]。
利用原生质体紫外诱变的方法,对诱变后的灵芝菌株进行培养。通过考察灵芝菌丝体生长状态和生长速度,经过初筛和复筛选育出能在37℃高温下生长良好的诱变菌株,对实现灵芝的高温栽培、高温发酵生产天然产物和其他耐高温菌株的选育提供了一定参考。
1 材料与方法
1.1 试验材料与仪器
1.1.1 菌株
灵芝菌株(Ganoderma lucidum CGMCC 5.616),购买于中国普通微生物菌种保藏管理中心(菌株的最适培养温度为28℃),保存于4℃冰箱PDA斜面培养基。
甘露醇、溶壁酶,上海生工生物工程有限公司;葡萄糖、酵母浸粉、麦芽糖,天津科密欧化学试剂有限公司。
1.1.3 仪器设备
VS-1300U超净工作台,苏州净化设备有限公司;DW-86L388超低温冰箱,青岛海尔特种电器有限公司;BPG-9156A恒温干燥箱,上海一恒科学仪器有限公司;DHP-9902恒温培养箱,上海一恒科学仪器有限公司;UV-1200紫外可见分光光度计,上海美谱达仪器有限公司;ZQZY-BG组合式光照振荡培养箱,上海知楚仪器有限公司;5424高速冷冻离心机,德国艾本德股份公司。
1.1.4 培养基
PDA液体培养基:土豆(去皮)200 g,在水中煮至土豆将熟,加入葡萄糖20 g,再加水至总体积1 000 mL,pH自然。
PDA固体培养基:液体培养基配方中加入琼脂20 g,加水至总体积1 000 mL,pH自然。
由式(4)和(5)计算MPRM电路的动态功耗和静态功耗,需计算逻辑门gk的信号概率Pr(gk)和Pk,v.为兼顾信号概率计算的时间效率以及准确性,在计算信号概率时,对MPRM电路中不存在相关性的信号采用简单信号概率计算法,对存在相关性的信号则采用概率表达式法.
麦芽糖酵母膏葡萄糖(maltose yeast extract glucose,MYG) 再生培养基:麦芽糖10 g、葡萄糖4 g、酵母浸粉5 g,溶于0.6 mol·L-1甘露醇溶液中,至总体积1 000 mL,pH为7.2。
MYG固体培养基:MYG液体再生培养基中加入琼脂20 g,溶于0.6 mol·L-1甘露醇溶液中,至总体积1 000 mL,pH为7.4。
1.2 试验方法
1.2.1 菌种活化及液体培养
取保存于4℃冰箱的灵芝菌株,在无菌环境下接种于试管斜面PDA培养基上,28℃恒温培养箱中培养7 d~10 d,至菌丝密集生长即活化完成。
取活化后的灵芝菌种试管,在无菌环境下将约5 mm2大小的菌种块,接种于盛有45 mL PDA液体培养基的100 mL三角瓶中,28℃下静止培养1 d后于260 r·min-1震动培养2 h后,将转速调节为180 r·min-1,温度不变,继续培养5 d后备用。
1.2.2 原生质体制备与再生
用灭过菌的4层纱布过滤培养好的菌丝,无菌水洗涤2次~3次,用无菌吸水纸吸干菌丝水分,将其置于酶液中(0.24 g溶壁酶溶解于12 mL的0.6 mol·L-1甘露醇溶液中,经0.22 μm细菌过滤膜过滤除菌),轻微震荡,置于32℃、80 r·min-1的摇床中震荡酶解3 h。用砂芯漏斗过滤除去酶解液中残留的菌丝,收集滤液,使用高速冷冻离心机在4℃、4 000 r·min-1条件下离心10 min,弃上清液,沉淀用0.6 mol·L-1甘露醇溶液洗涤2次,在显微镜下观察去壁成功后,得到纯化的原生质体[17]。使用血球计数板对纯化的原生质体进行计数,稀释浓度约为1×106个/mL,吸取100 μL涂布于MYG固体再生培养基中黑暗培养12 d后,统计原生质体的再生率[14]。
1.2.3 原生质体紫外诱变
在再生率满足试验要求的情况下(>0.5%)[18],按上述方法制备原生质体,分别取3 mL稀释的原生质体悬液置于无菌培养皿内,每3个培养皿一组,在黑暗条件下,用功率为10 W的紫外灯距离20 cm分别照射 0、10 s、20 s、30 s、40 s、50 s、60 s、70 s。取100 μL诱变后的原生质体用涂布棒涂布于MYG再生培养基中,黑暗中培养7 d~14 d后,在显微镜下观察再生菌落是否为白色的圆点状并记录,统计不同照射时间下的灵芝原生质体致死率[13,19]。5次重复试验后,取平均值绘制致死曲线。
1.2.4 初筛标准的确立
确立初步筛选的标准:将出发菌株(G.lucidum CGMCC 5.616母种)接种于PDA固体培养皿中,培养3 d后用笔划出灵芝菌丝的生长范围,后置于高温(49℃、50℃、51℃、52℃、53℃) 培养箱中分别培养2 h,每个温度下设5个平行,共25个培养皿。将热激后的培养皿转移到28℃培养箱中继续培养,每天观察菌丝在热激处理后菌丝恢复生长的情况,确定出发菌株的对高温的临界温度,并将该温度下热激2 h是否能恢复生长作为耐高温诱变菌株的初筛标准。
1.2.5 耐高温诱变菌株筛选
对经紫外诱变后出发菌株的再生菌株用接种锄截取5 mm2大小带有白色圆点状的菌丝块进行分离纯化,然后随机挑取35个诱变菌株和出发菌株分别接种于平板培养皿中,培养5 d后,分别在初筛确立的临界温度培养箱中热激2 h后,同时重新置于28℃恒温培养箱中进行恢复培养,黑暗条件下培养13 d后开始观察,每3天观察1次,筛选比出发菌株恢复生长快,且与出发菌株对峙培养出现拮抗反应的诱变菌株即为耐高温诱变菌株[14]。
1.2.6 诱变菌株生长速度试验
将出发菌株与挑选出的35个诱变菌株分别接种于PDA斜面试管中,每个菌株接种6支试管,28℃恒温培养,待菌丝长出后划线开始观察,每个菌株分别抽取划线后的6支试管中的3支试管继续在28℃培养5 d,划线测量菌丝生长长度,计算菌株在28℃时的生长速度,即恒温生长速度;将另外3支试管置于37℃(根据试验目的要选育出能在35℃~38℃高温下生长良好的耐高温菌株而自行设置的温度)培养5 d,划线测量菌丝长度,计算菌株在高温下的生长速度,即高温生长速度;再将高温下生长的菌株重新置于28℃下培养5 d,划线测量其生长长度,计算生长速度,即恢复生长速度。菌丝生长速率(V,mm·d-1)的计算公式为:
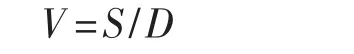
式中:S为菌丝长度(mm);D为菌丝生长天数(d)。
1.2.7 数据分析
采用Origin 8.5进行方差分析(P<0.05显著性差异;P<0.01极显著性差异)。
2 结果与分析
2.1 原生质体的制备与再生
本试验原生质体的获得是在溶壁酶浓度为2%,酶解温度为32℃,酶解时间3 h的条件下制备,在此条件下,制得的原生质体数量可达到1.36×106个/mL,原生质体的再生率为1.28%,原生质体的数量和质量能够满足本试验所需。
2.2 紫外诱变时间的确定
用紫外线灯将出发菌株的原生质体悬液进行不同时间梯度 (0、10 s、20 s、30 s、40 s、50 s、60 s、70 s)的照射处理,根据原生质体的再生情况制作紫外诱变效应曲线见图1。
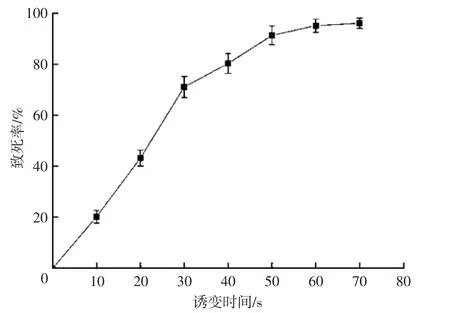
图1 紫外诱变效应曲线Fig.1 The effect curve of UV mutagenesis
由图1可以看出,菌株在0~30 s致死率升高较快,照射时间为60 s后致死率达到95%。在进行紫外诱变的过程中,一般认为致死率70%左右时,菌株突变的效果最好[14]。因此,为了获得较高的正突变率,选择诱变时间为30 s的诱变菌株进行试验。
2.3 初步筛选标准的确立
以出发菌株为试验材料进行耐热性试验,结果显示经过52℃高温刺激2 h后,出发菌株的菌丝无法恢复生长;经过51℃高温刺激后,出发菌株的菌丝萎缩明显,13 d后恢复生长,菌丝生长稀疏,速度缓慢。由此确定出发菌株的恢复生长的临界温度为51℃。将51℃热激2 h后恢复生长所筛选出的菌株为耐高温诱变菌株。
2.4 耐高温菌株的获得
高温会导致菌丝生长缓慢,甚至停止生长或死亡[20]。通过对诱变菌株进行51℃热激2 h耐高温复筛试验后,最终获得耐高温诱变菌株10株,根据初筛标准确立时的试验结果,从第13天开始测量菌丝生长长度和观察菌丝长势。其菌丝恢复生长情况见表1。
由表1可知,经过诱变后,60%菌株的生长情况比出发菌株好,40%诱变菌株的菌丝生长速度低于出发菌株。其中生长较好的10株耐高温菌株为Y1、Y3、Y4、Y8、Y11、Y17、Y20、Y28、Y30 和Y35。Y1菌株在修复生长的第13天、第16天和第19天,其生长速度比出发菌种分别提高了33.56%、32.91%和31.77%,差异显著(P<0.05)。Y30菌株第19天的生长速度与出发菌种相比差异不显著,但第13天、第16天的生长速度比出发菌株分别提高了41.09%,30.74%且差异显著(P<0.05)。从结果可以看出,通过原生质体紫外诱变的方法可有效筛选出耐高温灵芝诱变菌株。

表1 高温热激后菌丝修复生长情况Tab.1 The mycelial recovery growth after high temperature heat shock
2.5 诱变菌株菌丝生长速度
为进一步验证初筛的10株耐高温诱变菌株的耐温情况,将各诱变菌株在28℃、37℃及经历37℃高温胁迫后重新置于28℃下的生长速度分别记为恒温生长速度、高温生长速度和恢复生长速度,其统计结果见表2。
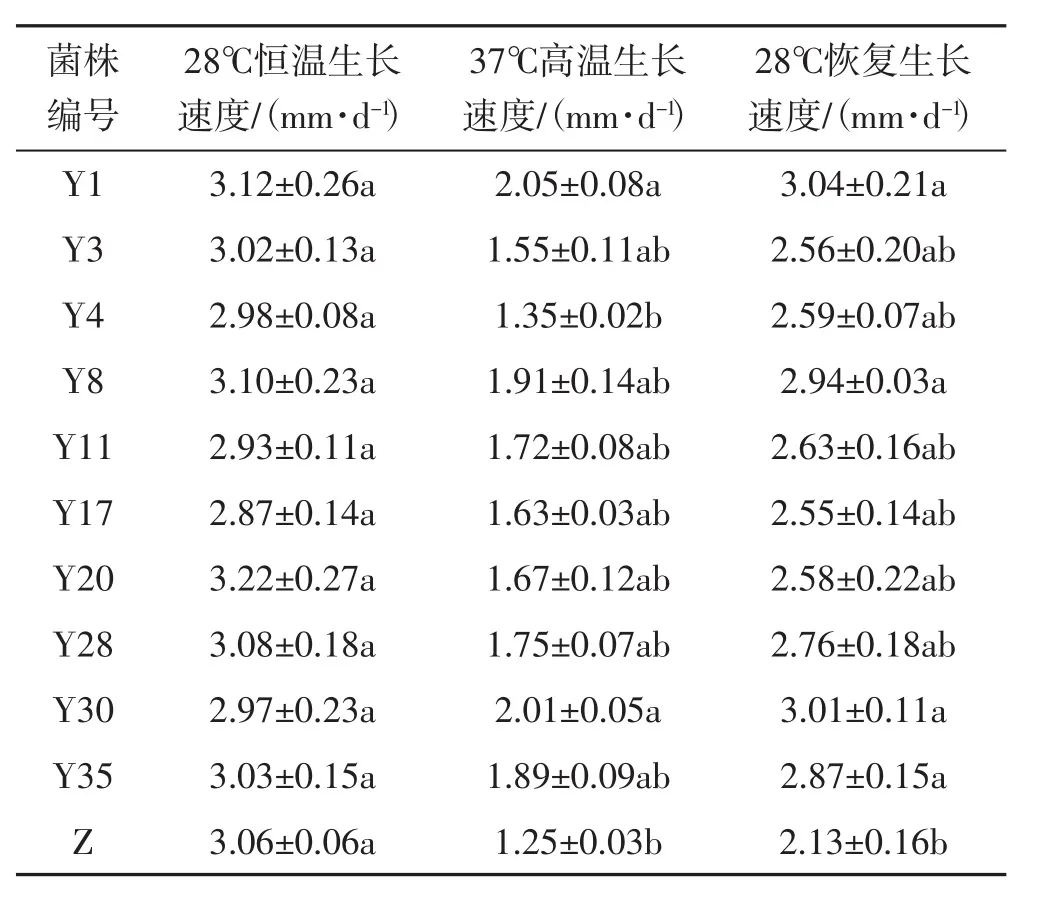
表2 诱变菌株菌丝生长速度试验Tab.2 The test of mycelium growth rate of mutagenic strains
如表2所示,28℃恒温生长条件下,出发菌株和诱变菌株的生长速度并无差异。但37℃高温下,诱变菌株的生长速度均高于出发菌株。尤其菌株Y1和Y30,其生长速度比出发菌株分别提高了64.02%、60.83%,差异显著(P<0.05)。28℃下菌株Y1、Y30、Y8和Y35的修复生长速度比出发菌株分别提高了42.72%、38.26%、38.02%和34.74%,且差异显著(P<0.05)。其他诱变菌株的恢复生长速度虽然与出发菌株相比并无差异,但均高于出发菌株。这表示高温对灵芝菌丝的生长速度有明显的抑制作用,但耐高温诱变菌株确实有较强且稳定的耐高温能力。
3 讨论与结论
利用耐高温菌株可以实现菌株的高温发酵,该方式可以减少污染,缩短生产周期,提高次生代谢产物的产量,节能降耗,大幅度降低菌种生产成本。目前,大型真菌的大部分研究均为利用紫外诱变的方法以获得目的菌株[21-22]。通过紫外诱变选育耐高温菌株是一种简便可行的方法,紫外诱变原生质体成功的关键是紫外照射条件的选择,由于紫外照射下原生质体突变的方向不确定,试验中需要对耐高温菌株进行筛选。为了获得更有使用价值和利于生产的菌株,采用紫外照射致死率在70%~80%时的照射条件,在本试验中经过多次反复处理,选择了照射时间30 s,致死率为72%的照射条件。在食用菌诱变菌株的筛选中,由于育种目的不同,诱变菌株的筛选方法也不尽相同。如以提高产物为目的筛选菌株,主要依靠产物的物理和化学性质,如通过观察琼脂培养基上的抑菌圈、透明圈及水解圈等;以对环境高耐受性为目的筛选菌株,可以利用相应的选择培养基[14,23-24]。本试验通过建立耐高温菌株51℃下热激2 h的初筛标准,共获得耐高温灵芝菌株10株,并通过进一步的高温试验,验证了这10株耐高温菌株在37℃下有较好的生长活性,其中菌株Y1和Y30的耐高温性能尤为显著。试验筛选出的耐高温灵芝诱变菌株不仅为灵芝的基础研究及其他耐高温菌株的选育提供了一定的参考价值,还为实现灵芝的高温栽培、高温发酵生产天然产物提供了技术支持和理论依据。
