不同阴离子钠盐对土壤Cd形态与微生物群落的影响
2021-09-24王立夫赵淑雯李杉杉秦璐瑶孙晓艺雷小琴陈世宝
王立夫,赵淑雯,李杉杉,秦璐瑶,孙晓艺,雷小琴,陈世宝,王 萌
不同阴离子钠盐对土壤Cd形态与微生物群落的影响
王立夫,赵淑雯,李杉杉,秦璐瑶,孙晓艺,雷小琴,陈世宝,王 萌*
(中国农业科学院农业资源与农业区划研究所,农业农村部植物营养与肥料重点实验室,北京 100081)
为了探明污染土壤在盐碱胁迫条件下镉(Cd)有效性与微生物群落的响应,采集污灌区Cd污染农田土壤,模拟北方土壤典型盐碱胁迫情景,设置不同阴离子钠盐配置处理,利用微生境培养实验,采用高通量测序技术,结合对土壤性质、土壤Cd形态等的测定.结果表明:施用钠盐可显著提高钠吸附比(SAR)、碱化度(ESP),降低有机碳(SOC)含量、阳离子交换量(CEC);促进土壤中小粒径团聚体(<0.002mm)的形成,增加了Cd在小颗粒团聚体的质量负载;与对照相比,两种土壤中T1处理(主要阴离子为SO42-、Cl-)均显著(<0.05)增加交换态Cd含量(27.06%和11.00%).钠盐的添加降低了土壤中细菌的丰度和多样性,其中T1处理的微生物群落均匀度最低;盐碱胁迫处理改变了土壤细菌的关键类群,如增加了耐盐碱腈基降解菌科、葡萄球菌科、假单胞菌科和耐重金属芽孢杆菌科的菌群丰度,不同处理菌群结构差异与土壤阴离子组成有关,如相比而言,T1处理可增加变形菌门、芽单胞菌门、拟杆菌门的丰度.冗余分析结果表明土壤pH值、交换态Cd含量、SAR和ESP是影响细菌群落组成变化的关键环境因子,拟杆菌门、芽单胞菌门和变形菌门的丰度与pH值呈正相关,而酸杆菌门、绿弯菌门的丰度与交换态Cd含量、SAR呈现显著正相关.可见,盐碱胁迫增加了土壤Cd的有效性,显著改变了土壤微生物群落结构.
污灌土壤;镉有效性;形态;微生物群落
在我国农田中约2/3为中低产农田,其中土壤盐渍化是土地退化的主要类型之一,而长期污水灌溉是造成土壤盐渍化的主要原因[1-2].目前我国污灌农田面积达140亿m2,尤其是资源性缺水的北方旱作地区(如北京、天津、河北、河南等)[3].污灌土壤除了具有盐基饱和度较高带来的盐渍化、土壤呈碱性等特点外,往往伴随着重金属超标,其中尤以镉(Cd)污染问题最为突出[3-4].土壤中的盐基离子可通过影响土壤溶液的离子强度、pH值等性质改变土壤多相体系中Cd的平衡,进而影响Cd的有效性[5].近年来,我国农田土壤的重金属和盐碱化复合污染问题愈发严重,污灌区土壤Cd污染已对我国农产品的安全生产和人体健康构成严重威胁[6].
土壤中Cd的生物有效性主要取决其化学形态.如盐渍化土壤中Cl-与Cd2+易形成不易被土壤吸附的配位体CdCl2-,所导致有效态Cd的增加;HCO3-或CO32-通过影响土壤性质如pH值等来降低Cd的有效性等问题.虽然目前在无机盐离子对土壤Cd形态与有效性的影响机制方面已经取得大量的研究结果,但在不同性质土壤中,这些离子驱动Cd形态转化的差异性还有待于新的证据的获得.土壤微生物是Cd形态转化的主要驱动者[7].比如,微生物可通过带电荷的表面或细胞壁和粘液层的羧基、巯基等基团,直接吸收或吸附重金属离子[8-9].同时,微生物作为土壤中最活跃的组分,对土壤物质组分、理化性质和微环境表现出高度响应特性.土壤盐碱强度可直接影响微生物群落结构、功能和遗传多样性等[9-10].研究表明,土壤中的盐分含量与微生物总量、活性呈负相关;不同类型盐碱土中微生物分布格局差异较大,其主要原因是土壤中主体阴离子种类的差异,不同菌种对Cl-、SO42-、CO32-、HCO3-的响应不同进而群落结构种间调整.鉴于土壤微生物群落特性取决于环境条件,然而,当前针对不同阴离子钠盐胁迫条件下,土壤微生物过程及其对Cd形态与有效性的影响还缺乏系统、深入的研究.在我国北方地区由于污灌带来的土壤盐渍化,土壤阴离子主要以Cl-、SO42-、CO32-、HCO3-为主.鉴于此,本研究采集北方两种(河南省新乡市和河北省保定市)不同性质由于长期污灌引起的Cd污染土壤,针对不同土壤盐碱胁迫情形,利用微生境培养试验,采用高通量测序测试技术,结合土壤性质、土壤团聚体分布、Cd形态等测定,利用PCoA、线性判别分析等,研究不同盐碱胁迫条件下,土壤Cd形态变化的关键微生物过程及影响因素,以期为我国中低产农田安全生产提供理论依据.
1 材料与方法
1.1 供试土壤
本实验土壤样品采集于我国华北地区典型污灌区,分别位于河北保定、河南新乡Cd污染农田.采样区面积界定约为100m2,根据地块形状采取五点式采样法,采集0~20cm的耕层土壤,并使用GPS定位记录样点经纬度坐标,土壤类型均为褐土.每个土壤样点由5个取样点混合而成,经四分法缩分.将采集的土壤样品在室内常温风干,剔除动植物残体、石块等杂物过2mm尼龙筛进行基础理化性质测定供试土壤的基本理化性质见表1.

表1 供试土壤基本理化性质
注:CEC:阳离子交换量,SOC:土壤有机碳,EC:电导率.
1.2 试验处理
试验在中国农业科学院农业资源与农业区划所实验室进行.以采集的Cd污染土壤(河南新乡土和河北保定土)为对象,采用批处理土培实验,依据我国北方土壤盐碱特性,每种土壤设置5种处理:(1)不添加钠盐(CK);(2)T1处理,添加NaCl:Na2SO4=1:1的钠盐;(3)T2处理,添加NaCl:Na2SO4:NaHCO3=1:2:1的钠盐;(4)T3处理,NaCl:Na2SO4:NaHCO3:Na2CO3= 1:9:9:1的钠盐;(5)T4处理,添加NaCl:Na2SO4: NaHCO3:Na2CO3=1:1:1:1的钠盐.经过前期预实验,添加0,1,3,6,9,12,15,18g/kg不同摩尔比的钠盐,发现钠盐浓度为9g·kg-1时开始对细菌群落生长速率产生显著抑制作用.因此,本研究中,两种土壤不同处理添加钠盐浓度为9g/kg,每个处理重复3次,随机排列.将不同配置和浓度的钠盐溶液混入土壤中后,放入直径5cm,高10cm的PVC培养管,每根PVC管中放置100g土壤,并添加去离子水至70%最大田间持水量,充分搅拌均匀.培养管置于人工气候箱内进行培养[(25±2)℃],期间维持土壤70%的最大田间持水量,培养56d后取新鲜土壤1g放入冻存管中,置于-80℃冰箱中,用作土壤微生物群落结构测定,其余土壤自然风干备用.
1.3 测定项目与方法
土壤理化性质参考鲁如坤等[11]方法.采用EDTA滴定法测定Ca2+、Mg2+含量,乙酸铵溶液交换-火焰光度法测定Na+、K+.
Cd含量测定方法参照(GB/T-17141)[12].
土壤团聚体组成测定:采用湿筛法将土壤颗粒分离为0.2~2mm径级、0.02~0.2mm径级、0.002~ 0.02mm径级和<0.002mm径级.土壤团聚体的物理分离过程参照文献[13]方法.
Cd化学形态测定:准确称1g样品于50mL聚丙烯塑料离心管中,采用改进的Tessier连续提取法[14],对施加钠盐后土壤Cd形态进行逐步提取、离心, 取其上清液过滤、定容、测定.
1.4 DNA提取和扩增
土壤DNA的提取、PCR扩增体系与程序、高通量测序参照文献[15]方法.
高通量测序数据分析:高通量测序数据拼接并去除嵌合体后,采用Qiime1.0软件进行生物信息学分析,选取相似度在97%条件下的OTU生成预期的稀释曲线,并利用mothur软件计算丰富度指数Chao1、覆盖度指数(good's coverage)以及多样性指数Simpson和Shannon进行Alpha多样性分析;利用PCoA进行细菌群落分布的主成分分析.进一步地,将不同土壤对应盐碱胁迫处理进行分组,通过LEfSe软件应用线性判别分析方法(linear discriminant analysis, LDA)进行组间差异物种筛选;利用Canoco软件进行冗余分析,描绘盐碱胁迫下土壤微生物群落与环境因子间的关系.
1.5 数据处理与分析
SAR和ESP是衡量土壤碱化度的重要指标,计算公式分别为:
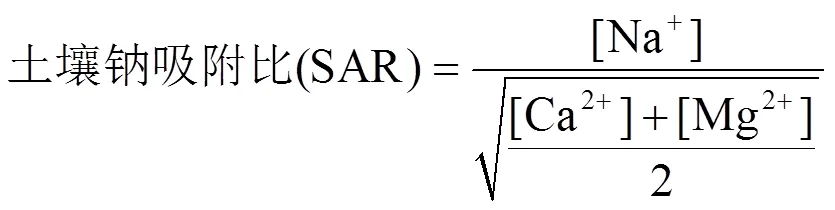
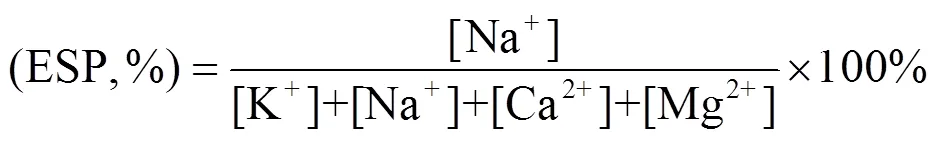
式中:[K+]、[Na+]、[Ca2+]、[Mg2+]分别为每千克土壤中K、Na、Ca和Mg离子的量,单位为cmol/kg.
所有的实验数据均采用SPSS 16.0软件进行分析处理,并采用One-way ANOVA法分析不同修复剂处理的差异显著性,当<0.05时代表差异显著,用不同的字母来表示.以3组重复数据计算平均值和标准差,利用Origin 9.1作图.
2 结果与分析
2.1 不同盐碱胁迫处理对土壤理化性质的影响
施加不同钠盐处理后,土壤样品的pH值、CEC、SOC和EC测定结果见表3.两种不同土壤施加钠盐处理与空白对照在这些土壤基本性质方面均呈不同程度的变化,但变化的趋势较相近.与对照组相比,土壤pH值、EC显著提高,其中T1处理对提高EC的影响最为显著,使两种土壤EC分别增加了3.27倍、4.71倍,T4处理则对pH值的增加作用最为显著,与CK相比,T4处理下两种土壤pH值增加0.78和0.46个单位.同时,CEC、SOC含量明显下降,但不同钠盐处理间差异不显著.
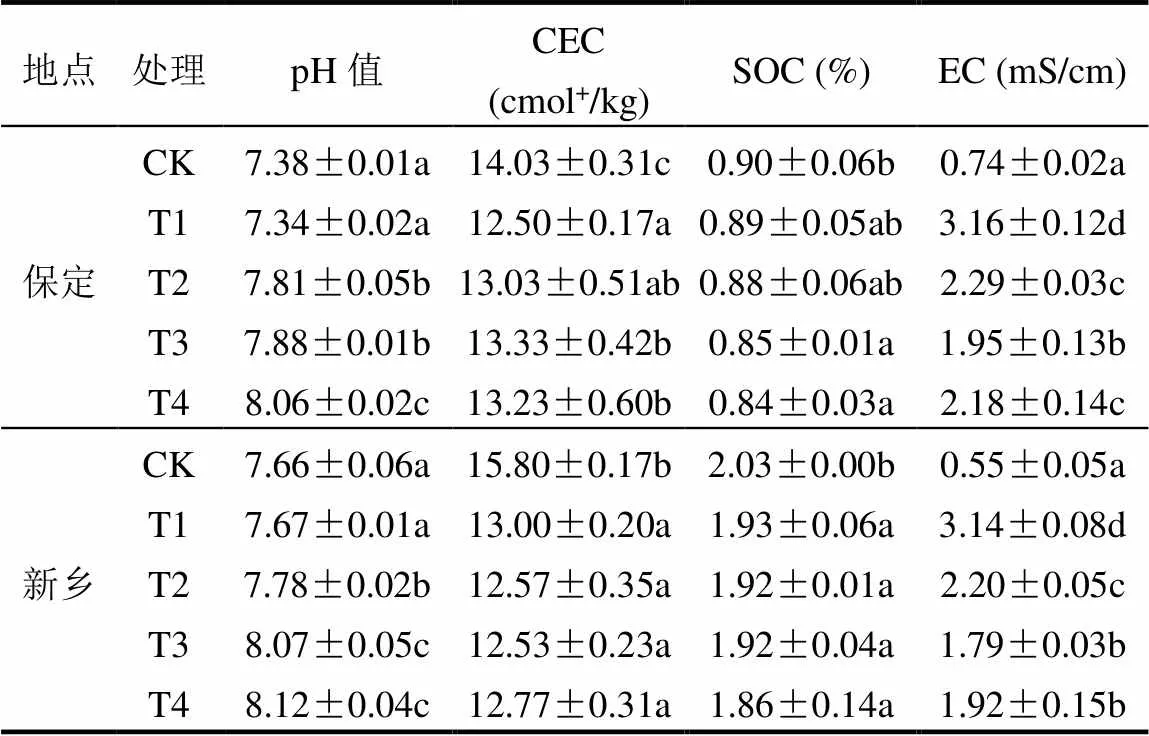
表3 不同盐碱胁迫处理对土壤理化性质的影响
注:表中数据为平均值±标准差,同一列中不同小写字母表示处理间差异显著(<0.05).
钠吸附比是指土壤中Na+和Ca2+、Mg2+的相对数量,当土壤中Na+含量过高时会使土壤黏粒分散、膨胀.由图1可知,施用钠盐后2种土壤的SAR值均有不同程度的增高,保定土壤SAR值增幅在23.14%~33.63%.新乡土壤各处理SAR值增幅在29.39%~43.22%.碱化度是指土壤胶体吸附的交换性钠占阳离子交换量的百分率度.通常将土壤ESP在5%~10%定为轻度碱化土壤,10%~15%为中度碱化土壤,15%~20%为强碱化土壤[16].由图1(b)可知,在保定土壤中,施加钠盐虽在一定程度上增加了土壤ESP,但土壤ESP在7.56%~9.33%,仍属于轻度碱化;在新乡土壤中,施加钠盐显著增加了土壤ESP,土壤ESP范围在10.98%~15.11%,其中T4处理ESP达到了15.11属于强碱化,其他处理属中度碱化.
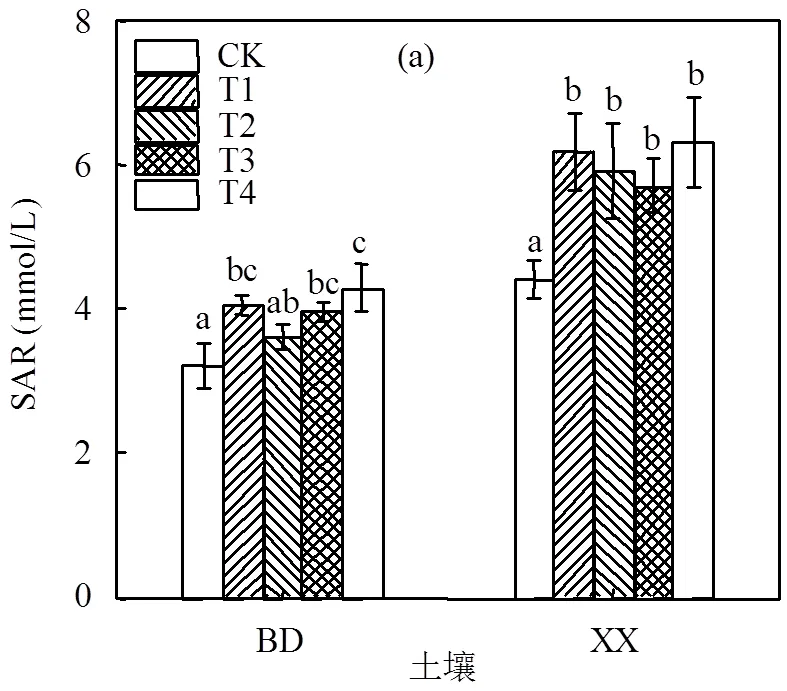
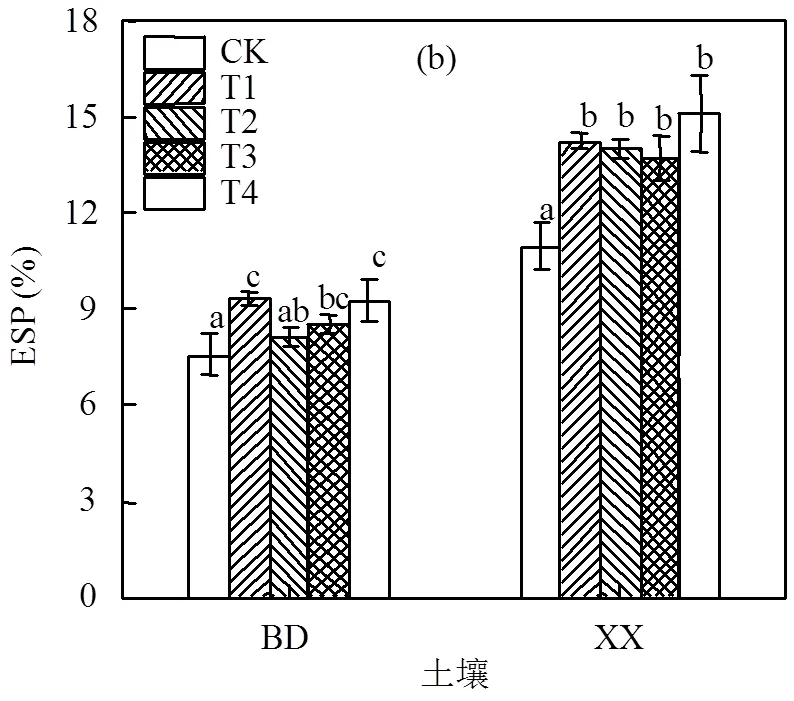
图1 不同盐碱胁迫处理对土壤SAR和ESP的影响
不同处理对土壤团聚体组成的影响如图2(a)所示.在保定土壤中,未添加钠盐的土壤中以0.02~ 0.2mm径级径级的团聚体为主,占总体组成的36.8%,其次为0.2~2mm(30%)、0.002~0.02mm(17.4%)和>2mm(8.4%),<0.002mm径级的团聚体含量最低,仅为7.4%.在添加钠盐后,<0.002mm径级的团聚体显著增加,而>2mm径级和0.2~2mm径级的团聚体比例显著降低,与对照(CK)相比,T4处理对土壤团聚体组成影响最为显著,其中,<0.002mm径级的团聚体增加了155.8%,同时>2mm径级和0.2~2mm径级的团聚体减少了51.5%和23.3%.T3、T2的影响次之,T1较其他3种处理作用效果弱.同样地,如图2(b)所示,在新乡土壤中,添加钠盐的处理土壤团聚体组成的变化趋势与保定土壤中的变化类似,<0.002mm径级的团聚体显著增加,>2mm径级和0.2~2mm径级的团聚体比例显著降低,T4处理对土壤团聚体组成影响最为显著,<0.002mm径级的团聚体增加了155.8%,同时>2mm径级和0.2~2mm径级的团聚体减少了51.5%和23.3%.
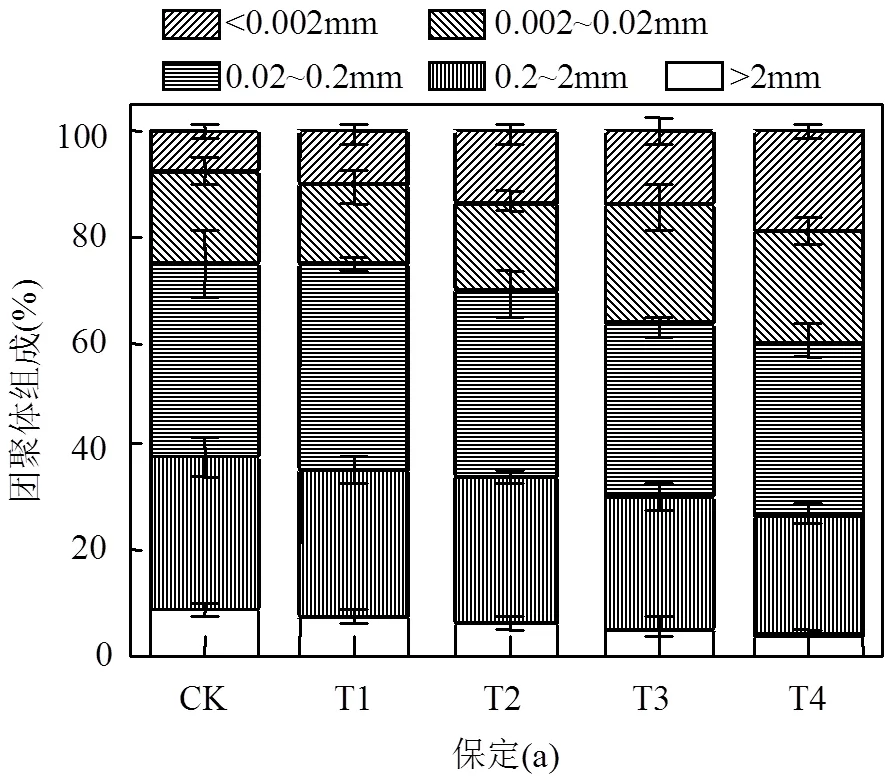
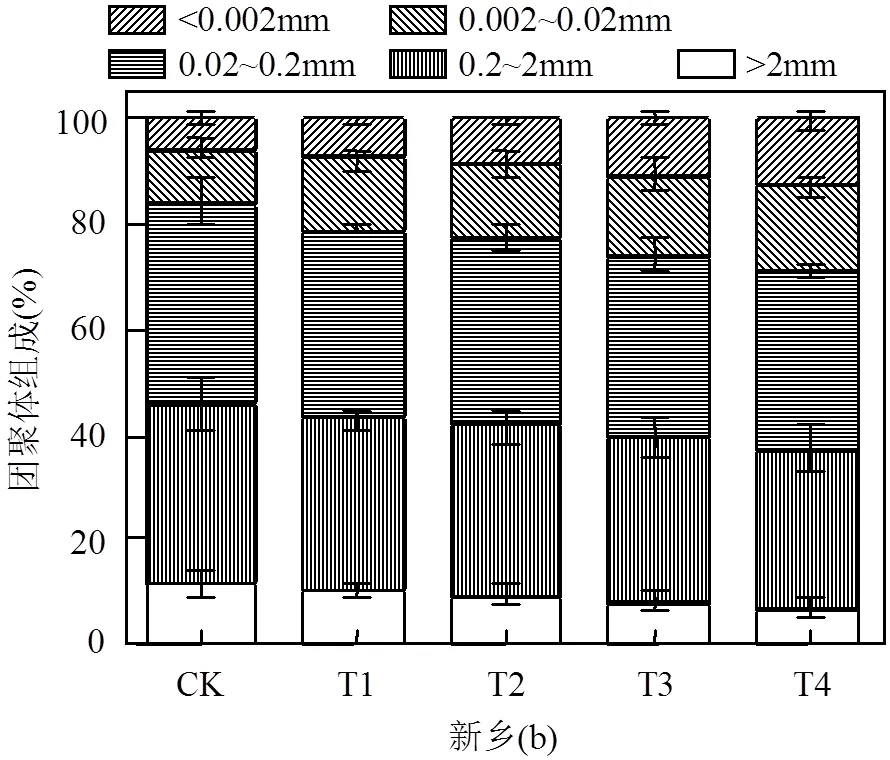
图2 不同盐碱胁迫对土壤团聚体组成的影响
2.2 不同盐碱胁迫处理对土壤Cd形态变化的影响
在Tessier分级中,可根据生物对Cd不同形态的吸收难易程度,将Cd形态分为3类:有效态(交换态)、潜在有效态(碳酸盐结合态、铁锰氧化物结合态、有机结合态)和不可利用态(残渣态),这种分类方法能更直观的表明各形态在土壤中的作用,可用来划分对于施用钠盐对土壤中Cd不同形态之间转化所产生的影响.
交换态Cd具有较大的迁移性,最容易被生物所吸收利用,亦为有效态.如图3(a)所示,在保定土壤中,添加不同钠盐下,土壤中交换态Cd含量发生了相应的变化.T1、T2处理中交换态Cd含量较CK显著增加,并且T1处理的增加幅度最大,为27.13%,T2处理次之,为11.54%,类似地,如图3(b)所示,在新乡土壤中,与对照组相比T1处理交换态Cd增高27.47%,T2、T3处理的变化不显著,T4处理降低了17.13%.
碳酸盐结合态Cd是与碳酸盐矿物产生沉淀或共沉淀的镉.由图3(a)可知,在保定土壤中,除T1处理外,其余处理的碳酸盐结合态Cd含量均显著提高,增幅在13.84%~37.40%;如图3(b)所示,在新乡土壤中,与CK相比,T1处理碳酸盐结合态Cd含量下降5.40%,T2处理无明显变化,T3、T4处理碳酸盐结合态Cd含量分别增加了5.8%和14.38%.
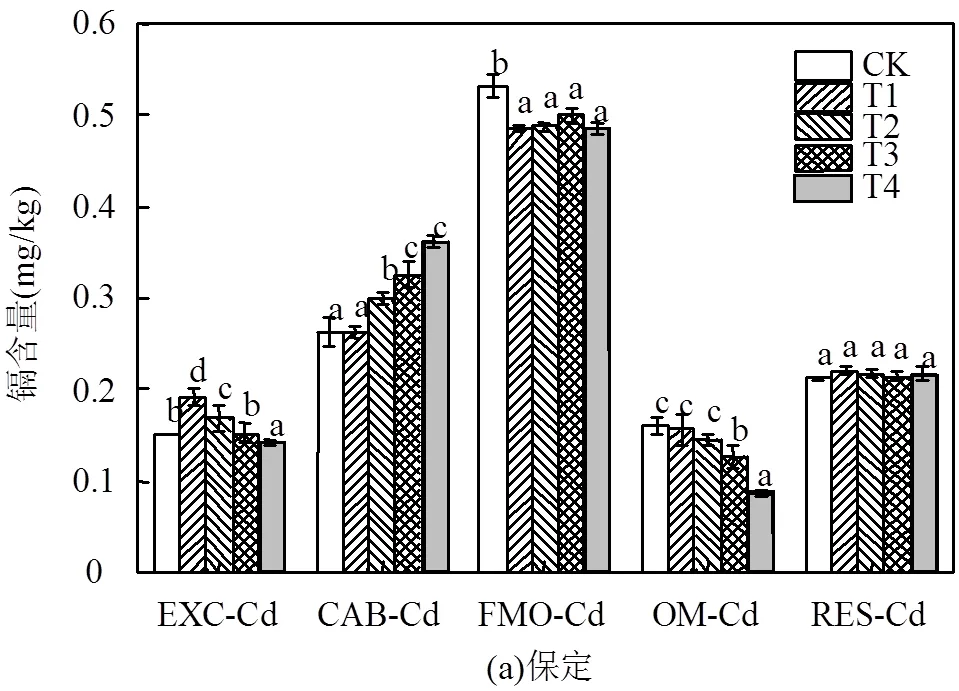
EXC-可交换态,CAR-碳酸盐结合态,FMO-铁锰氧化物结合态,OM-有机结合态,RES-残渣态
铁锰氧化物结合态Cd是Cd2+与铁锰氧化物结合在一起被包裹定型或本身成为氢氧化物沉淀的部分.由图3(a)可知,在保定土壤中,施盐处理较对照均显著下降,降幅为6.06%~8.81%,而在新乡土壤中与对照相比,T1、T2处理铁锰氧化物结合态Cd含量显著降低,降低幅度为10.72%~11.42%[图3(b)],而T3、T4处理变化不显著.
有机结合态Cd是以有机质活性基团为配位体,以Cd2+为中心离子形成的结合态络合化合物或螯合化合物.由图3(a)可知,在保定土壤中,与对照相比,施用钠盐处理总体呈下降趋势,除了T1外其余处理有机结合态Cd含量均显著下降,降幅在9.06%~ 46.24%.而在新乡土壤中[(图3b)],T1、T2处理变化不显著,而T3、T4处理有机结合态Cd含量显著下降,分别为24.90%和35.55%.
残渣态Cd性质稳定,是土壤中迁移性与生物利用性最低的组分,一般不被生物所利用.由图3可知,两种土壤在施加钠盐后,残渣态Cd含量无明显变化.
2.3 不同盐碱胁迫处理对土壤微生物群落的影响
2.3.1 α、β多样性分析 不同盐碱处理土壤α-多样性统计结果见表4,高通量测序读数表明土壤样品细菌群落的多样性以及不同的系统发育OTUs是从2161到3491.所建立的细菌文库的覆盖率为98%,说明实验所建立的文库可真实、有效地反映样本环境细菌多样性.从下表可见,盐碱胁迫处理降低了不同土壤(保定和新乡)细菌种群的Chao指数和Shannon指数,同时提高了Simpson指数,并且通过不同盐碱胁迫处理土壤细菌α-多样性对比发现,T1处理的Chao指数和Shannon指数最低,且Simpson指数最高.

图4 不同盐碱胁迫处理的土壤细菌群落主成分分析(PCoA)
如图4所示,不同处理与对照间细菌群落结构差异较大.T1的群落与CK的群落结构差异最为显著,不同盐碱胁迫处理间群落结构也呈现一定差异.第二主成分(Axis.2)将CK处理的细菌群落与T1、T2、T3及T4处理间的细菌群落进行了区分,而第一主成分(Axis.1)将不同地区土壤(BD和XX)进行了区分,CK处理的细菌群落接近AM的.
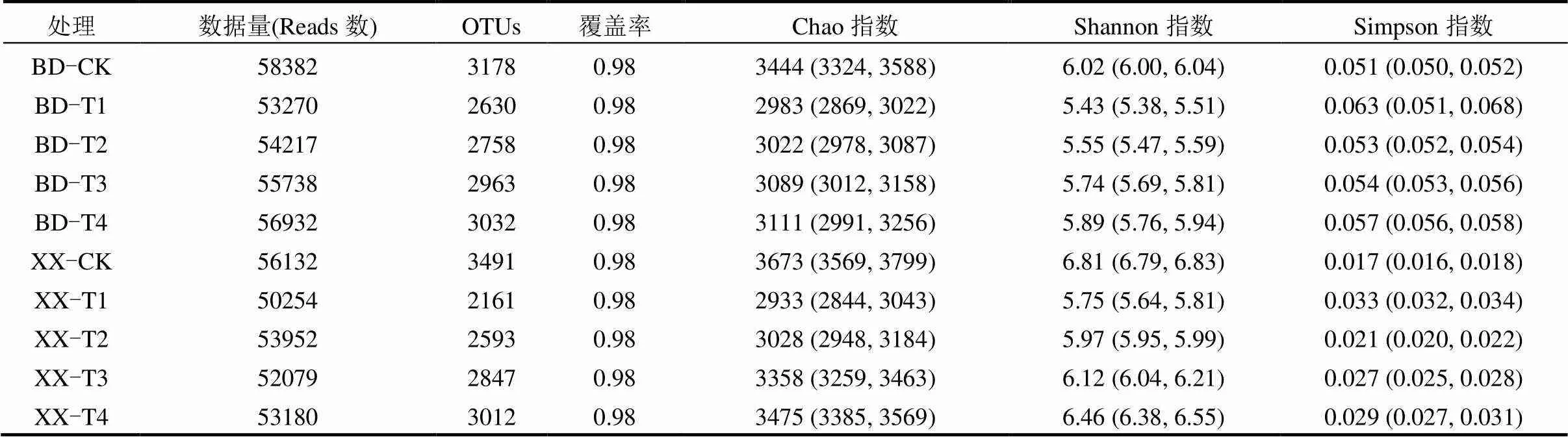
表4 不同盐碱胁迫处理土壤细菌α多样性统计
注:括号内为最小值和最大值.
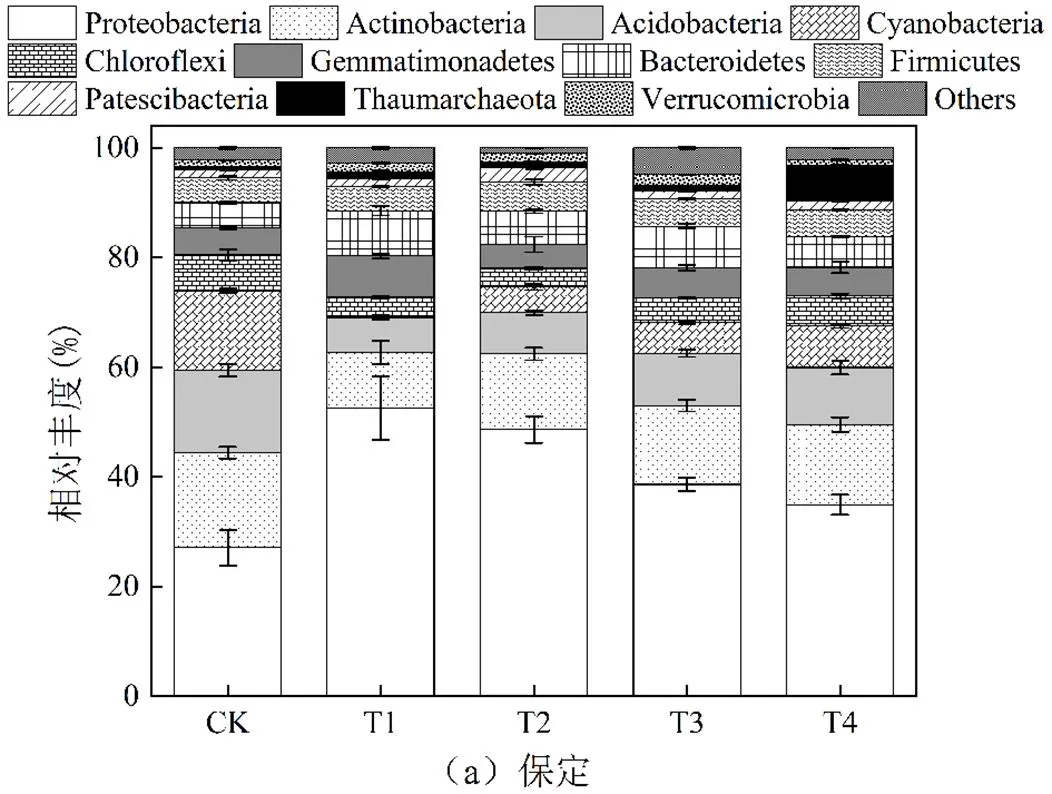
2.3.2 土壤细菌群落组成 不同盐碱胁迫处理土壤中微生物群落组成分析如图5,相对丰度大于1%的细菌门共有10种,变形菌门(Proteobacteria)和放线菌门(Actinobacteria)是不同处理土壤样品中的优势菌群,其次为绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria).根据菌群丰度分析,不同钠盐的添加可显著提高Cd污染土壤中变形菌门、芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)的丰度,但降低了放线菌门、酸杆菌门、绿弯菌门的丰度.
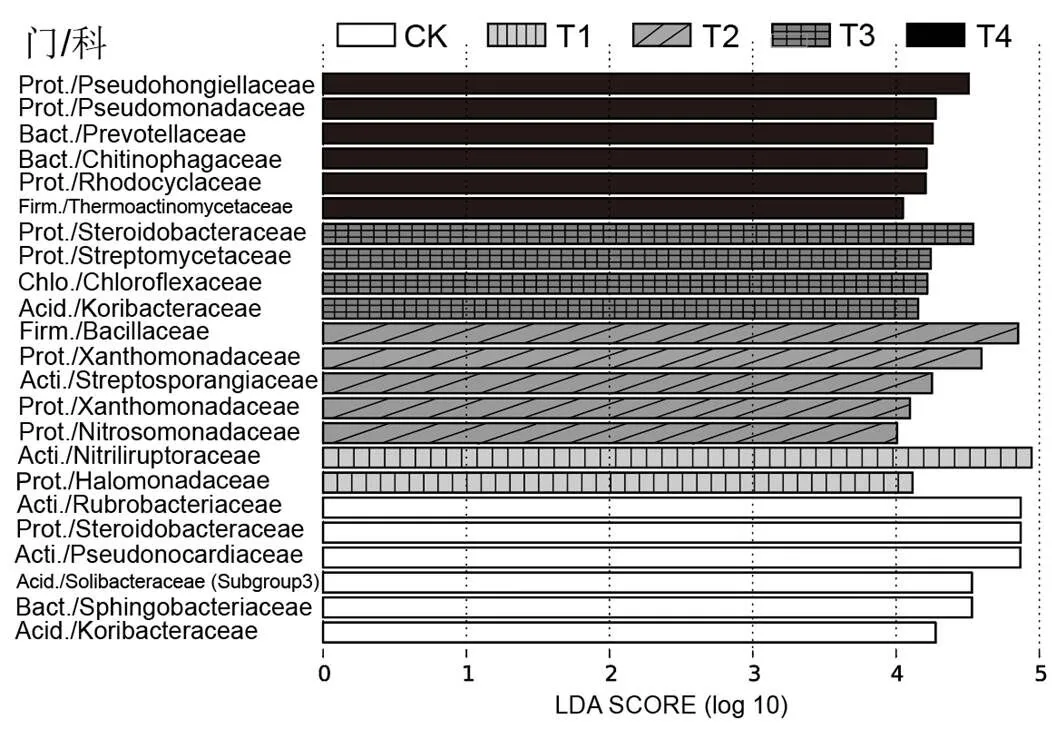
图6 不同盐碱胁迫处理土壤微生物物种差异性分析(LDA>4)
缩写:Acid., Acidobacteria; Prot., Proteobacteria; Bact., Bacteroidetes; Firm., Firmicutes; Acti., Actinobacteria; Chlo., Chloroflexi
应用LEfSe分析识别不同处理中产生显著性差异影响的物种类群.如图6,LEfSe分析共检测到23个在不同处理中具有统计学与生物学意义的生物标记物,可见,在不同盐碱处理作用下,微生物类群发生显著变化.例如,Nitriliruptoraceae (腈基降解菌科)是相应盐胁迫最敏感的生物标记物(LDA值最大),(腈基降解菌属)种群展现出较强的亲盐能力,适应不同高碱性环境(pH>9.25)[17]. Staphylococcaceae(葡萄球菌科)和Pseudomonadaceae (假单胞菌科)中的葡萄球菌和假单胞菌对盐碱具有较强的耐受性,被认定为耐盐碱种群[18].(芽孢杆菌科)菌科中,芽孢杆菌属的菌株对不同金属离子(Fe、Cd、Zn、Co、Ni)的耐受性较强[19],芽孢杆菌能够产生多种酶和抗生素物质,它在维持土壤健康方面发挥着关键作用[20].
2.4 土壤环境因子与细菌群落间相关性分析
采用功能冗余分析了Cd污染土壤中环境变量与细菌群落结构的相关性.如图7所示,RDA1轴特征值为64.36%,包含了大量土壤环境因子和微生物群落信息,RDA2轴与土壤pH值、SOC、ESP呈正相关.冗余分析(RDA)显示,土壤pH(<0.01)、EXC-Cd(<0.01)、SAR(<0.05)和ESP(<0.05)与细菌群落组成变化有显著关联.拟杆菌门、芽单胞菌门和变形菌门的丰度与pH值呈正相关,而酸杆菌门、绿弯菌门的丰度与EXC-Cd、CAB-Cd、SAR呈现显著正相关.
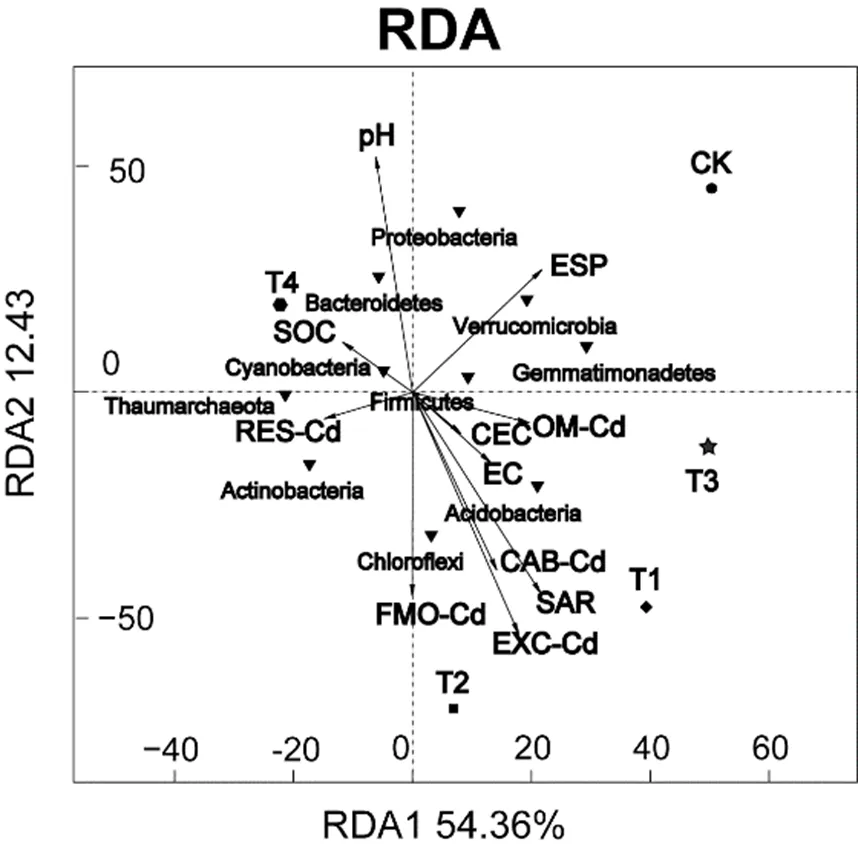
图7 土壤微生物群落与环境因子之间关系的冗余分析
3 讨论
盐碱胁迫强度主要是通过pH值、EC、ESP以及SAR四种指标进行综合表征.通常地,EC值越大表示土壤中水溶性盐含量越高,土壤碱度通常以pH值作为强度指标,以ESP或SAR作为容量指标. 在本研究中,添加钠盐不同程度提高了中pH值、EC、SAR、ESP值,这与添加到土壤中的盐基离子有关.此外根据团聚体组成的变化可知,添加钠盐可促使大粒径团聚体的分散、小粒径团聚体的形成,这是因为一方面Na+作为土壤分散剂,可直接导致团聚体的破碎;另一方面土壤溶液和交换点位的Na+会形成排斥电荷,导致土粒分散[21].另外,微生物的分泌物也可使土壤颗粒胶结,而钠盐胁迫对土壤微生物群落组成的影响,也将间接影响团聚体的稳定性.值得注意的是,土壤团聚体能够显著影响土壤对镉的固持能力,水稳性团聚体的分散也将促使Cd从大粒径团聚体中分散处理,负载到小粒径团聚体中.是因为细颗粒土壤团聚体与重金属的亲和力更强,并且由于其体积小更容易转移,因而细颗粒团聚体中的重金属更容易被转运到植物组织中[22].因此,添加钠盐促进小粒径团聚体的形成,增强了Cd在小颗粒团聚体的质量负载,也将进一步提高土壤中Cd的移动性、有效性.另外,本试验中的钠盐是根据质量比(g/kg)添加到土壤中,所以不同阴离子的物质的量有一定的差异,因此也将会对结果产生一定的影响.
在本研究中,土壤中的镉的形态变化受到盐基离子与阴离子的影响.T1、T2处理下,可交换态Cd含量增加,可能是由于钠盐的添加,强化了阳离子如Na+、Mg2+、Ca2+与Cd2+对土壤吸附点位的竞争,促进了土壤胶体中镉的解吸[23],同时随着土壤溶液中Cl-和SO42-的增加,会与Cd形成不带电或带负电荷的络合物,从而削弱Cd的静电作用,增加Cd的自由度[24].不同地,T4处理的交换态Cd含量则显著降低,这主要是因为T4处理中存在较多的CO32-、HCO3-.碳酸根离子的大量存在一方面提高土壤pH值,增加土壤表面负电荷进而增强对Cd2+的吸附[25].另一方面,可将Cd2+水解成CdOH-,而CdOH-较Cd2+更容易被土壤吸附[26],此外Cd2+与碳酸根之间还会形成碳酸盐沉淀,进而降低土壤溶液中Cd2+的浓度;对于碳酸盐结合态Cd,在施加钠盐后,尤其是含有HCO3-或CO32-的处理会显著提高土壤中碳酸盐结合态Cd的含量,这是由于碳酸盐对Cd具有较强的吸附能力,导致碳酸盐结合态Cd的含量增加[27].此外,碳酸盐还会提高土壤pH从而影响碳酸盐结合态Cd含量,研究表明碳酸盐结合态镉易受土壤自身pH值的影响,当pH值较高时会转化成碳酸盐结合态镉进而沉淀,而当pH值较低时则易重新释放到环境中[28];在施加钠盐后,铁锰氧化物结合态Cd 有不同程度的降低,这是因为无机盐阴离子(Cl、SO42-、CO32-)会促进Cd从铁锰氧化物解吸出来[29],其原因为无机盐阴离子与Cd2+反应生成CdYn+,CdYn+的有效水和离子半径更大,不易被铁锰氧化物吸附,从而导致铁锰氧化物结合态Cd含量的减少[30].此外,两种土壤铁锰氧化物态Cd不同的变化可能与土壤母质的差异有关;研究表明有机态Cd含量与土壤中有机质呈显著或极显著正相关[31],土壤有机质提供了羟基、羧基等活性基团,这些基团具有较强的络合和吸附能力,形成有机结合态[32].本研究中施加钠盐处理导致土壤有机质含量降低,因此有机结合态Cd含量减少;两种土壤在施加钠盐后,残渣态Cd含量无明显变化,这是因为土壤中的残渣态Cd一般被固定在土壤中的矿物和硅酸盐物质的晶格中,在短期内不易发生变化.
微生物群落是土壤生物活性的重要指标,不同盐碱胁迫以及重金属含量高低能够改变土壤微生物群落组成和丰度.α-多样性被称为生境内的多样性,主要关注局域均匀生境下的物种数目.α-多样性指数包括Chao指数(物种数)、Shannon指数(群落物种的丰富度)以及Simpson指数(群落物种的优势度)常用于评价细菌群落结构情况.在本研究中,盐碱胁迫降低了不同土壤(保定和新乡)细菌种群的丰富度和多样性,说明盐碱胁迫程度的加大,引起细菌物种数量的下降,导致细菌群落多样性降低.T1处理的细菌丰富度和多样性最低,表明NaCl、Na2SO4混合钠盐对微生物生长产生较为显著的抑制,降低土壤微生物数量与微生物群落结构多样性.但盐碱胁迫处理显著增加了群落的Simpson指数,Simpson值越大,表示优势度物种越小,亦表明群落均匀度越低.可能是由于随着盐碱胁迫强度增大,低丰度的耐性、抗性群落试图生长,并在构建群落结构中起重要作用.β多样性分析之PCoA分析通过多变量统计学方法显示不同环境样品中微生物进化上的相似性及差异性.结果显示T1与CK之间群落结构差异最大,这是因为T1处理中有效态Cd的含量最高且群落奇异度最低.
在污染土壤中,变形菌门常表现为优势菌群和耐重金属的微生物[33].变形菌门丰度的增加通常有益于土壤健康或表明土壤生物或微生物对有害、有毒物质有较强的抗性.是因为变形菌门含有与土壤铁、硫循环(氧化和还原)相关的类群,如化学营养型酸硫杆菌spp.,这些类群可协助植物获取养分[34].此外,变形菌门中含有多种亲金属细菌,如铜绿假单胞菌,这种细菌不仅在高金属含量的环境中占优势,而且具有生物矿化金属元素的能力[35].因此,属于该门的操作分类单元(OTUs)有可能成为生物修复Cd污染土壤的潜在菌种.盐碱胁迫作用下土壤中该菌门丰度增加,表明随着土壤中Cd的有效性增加,抗性微生物群落在土壤细菌组成中起关键作用.放线菌门是所检测到的另一个重要菌门,该菌门广泛分布于土壤、水和堆肥中,在抑制病原微生物和降解顽固性化合物方面起着重要作用[36].本研究发现,添加不同钠盐处理可显著降低Cd污染土壤中放线菌门的相对丰度.通常放线菌被认为能够降解土壤有机质和有毒无机化合物,而不同钠盐的添加使得放线菌门丰度降低也可能是土壤的Cd毒性增强的一个原因.酸杆菌门的分布通常与土壤pH值密切相关,部分酸杆菌与土壤金属元素形态、元素循环和矿物风化等相关[37].与对照相比,添加钠盐降低了土壤中酸杆菌的相对丰度,这可能与施用钠盐后土壤pH值的变化有关.绿弯菌门是土壤中的贫营养细菌,能够适应恶劣的土壤环境.通过对比Cd污染土壤中施加不同钠盐,发现在有效态Cd含量较高的处理(如T1)中抗性菌群占优势.根据LEFse分析显示,本研究中,不同钠盐的添加显著增加了土壤中耐盐碱性、抗重金属性物种的类群,改变土壤微生物群落结构.不同处理间菌群的差异可能是由于主体阴离子的种类Cl-、SO42-、CO32-、HCO3-不同引起土壤理化性质的变化.
另外,土壤环境因子的变化会引起土壤微生物群落的变化.本研究中,T4处理中细菌群落与pH值呈正相关,因为添加钠盐使土壤pH值升高大于1个单位(表3).由于大多土壤微生物在pH值±1保持稳定,pH值的变化会影响土壤微生物多样性.类似地,本研究中土壤盐碱强度(如ESP、SAR)被证明是影响细菌群落变化的关键因素.
4 结论
4.1 与对照或其他含有CO32-和HCO3-处理相比,在2种土壤(保定、新乡)中,T1处理(仅含有Cl-和SO42-的)显著(<0.05)增加了交换态Cd含量(达27.06%和11.00%).
4.2 盐碱胁迫降低了土壤细菌的丰度和多样性,与对照相比,T1处理中微生物群落均匀度最低.此外,高含量的Cl-和SO42-促进了变形菌门、芽单胞菌门、拟杆菌门的生长,这些菌群与Cd形态变化有一定关联.
4.3 盐碱胁迫提高镉污染土壤中变形菌门、芽单胞菌门、拟杆菌门的丰度,但降低了放线菌门、酸杆菌门、绿弯菌门的丰度.此外,LEFSe分析发现盐碱胁迫显著增加了耐盐碱菌腈基降解菌科、葡萄球菌科、假单胞菌科和对重金属具有较强耐受性的细菌类群芽孢杆菌科.
4.4 土壤pH值、EXC-Cd、SAR和ESP与细菌群落组成变化有显著关联,拟杆菌门、芽单胞菌门和变形菌门的丰度与pH值呈正相关,而酸杆菌门、绿弯菌门的丰度与EXC-Cd、CAB-Cd、SAR呈现显著正相关.
[1] Balkhair K S, M A Ashraf. Field accumulation risks of heavy metals in soil and vegetable crop irrigated with sewage water in western region of Saudi Arabia [J]. Saudi Journal Of Biological Sciences, 2016,23(1): 32-44.
[2] Ma S C, Zhang H B, Ma S T, et al. Effects of mine wastewater irrigation on activities of soil enzymes and physiological properties, heavy metal uptake and grain yield in winter wheat [J]. Ecotoxicology and Environmental Safety, 2015,113:483-490.
[3] 何 俊,王学东,陈世宝,等.典型污灌区土壤中Cd的形态、有效性及其影响因子[J]. 中国环境科学, 2016,36(10):3056-3063.
He J, Wang X D,Chen S B, et al. The forms, bioavailability of Cd in soils of typical sewage irrigation fields in northern China and its control factors [J]. China Environmental Science, 2016,36(10):3056.
[4] Kunhikrishnan A, Bolan N S,Muller K. The Influence of Wastewater Irrigation on the Transformation and Bioavailability of Heavy Metal (Loid) S in Soil [J]. Advances in Agronomy, 2012,115:215-297.
[5] Raiesi F, Razmkhah M, Kiani S. Salinity stress accelerates the effect of cadmium toxicity on soil N dynamics and cycling: does joint effect of these stresses matter?. Ecotoxicology and Environmental Safety, 2018,153:160-167.
[6] Zhao F J, Ma Y, Zhu Y G, et al. Soil contamination in China: Current status and mitigation strategies [J]. Environmental Science & Technology, 2015,49(2):750-759.
[7] Delgado-Baquerizo M, Oliverio A M, Brewer T E, et al. A global atlas of the dominant bacteria found in soil [J]. Science, 2018,359(6373): 320-325.
[8] 丁巧蓓,晁元卿,王诗忠,等.根际微生物群落多样性在重金属土壤修复中的研究[J]. 华南师范大学学报(自然科学版), 2016,48(2):1-12.
Ding Q P, Chao Y Q, Wang S Z, et al. Research on function of rhizosphere microbial diversity in phytoremediation of heavy metal polluted soils [J]. Journal of South China Normal University (Natural Science Edition), 2016,48(2):1-12.
[9] Liu L Z, Gong Z, Zhang Y, et al. Growth, cadmium uptake and accumulation of maize (L.) under the effects of arbuscular mycorrhizal fungi [J]. Ecotoxicology, 2014,23(10):1979-1986.
[10] Barcenas-Moreno G, E Baath, J Rousk. Functional implications of the pH-trait distribution of the microbial community in a re-inoculation experiment across a pH gradient [J]. Soil Biology & Biochemistry, 2016,93:69-78.
[11] 鲁如坤.土壤农业化学分析方法[M]. 北京:中国农业科技出版社, 1999.
Lu R K. Agro-chemical analysis of soil [M]. Beijing: China Agricultural Science and Technology Press, 1999.
[12] 中华人民共和国国家卫生健康委员会.土壤质量铅、镉的测定石墨炉原子吸收分光光度法(GB/T 17141—1997) [S]. 北京:中华人民共和国国家卫生健康委员会, 1998:1-4.
National Health Commission of PRC. Soil quality -determination of lead, cadmium-graphite furnace atomic absorption spectrophotometry (GB / T 17141—1997) [S]. Beijing: National Health Commission of PRC, 1998:1-4.
[13] Manna M C, Zhang H B,Ma S T,et al. Long-term fertilization, manure and liming effects on soil organic matter and crop yields[J]. Soil & Tillage Research, 2007,94(2):397-409.
[14] 王 萌,刘继芳,陈世宝,等.不同纳米修复剂对污染土壤中胡萝卜吸收、转运Cd的影响 [J]. 环境工程学报, 2013,7(7):2738-2744.
Wang M, Chen S B, Han Y, et al. Responses of soil aggregates and bacterial communities to soil-Pb immobilization induced by biofertilizer [J]. Chemosphere, 2019,220:828-836.
[15] 黄昌勇,土壤学[M]. 北京:中国农业出版社, 2000.
Huang C Y. Soil science [M]. Beijing: China Agriculture Press, 2010. [14].
[16] Sorokin D Y, van Pelt S, Tourova T P, et al. Nitriliruptor alkaliphilus gen. nov., sp. nov., a deep-lineage haloalkaliphilic actinobacterium from soda lakes capable of growth on aliphatic nitriles, and proposal of[J]. International Journal of Systematic and Evolutionary Microbiology, 2009,59(2):248-53.
[17] Paul D. Kumbhare S V, Mhatre S S, et al. Exploration of microbial diversity and community structure of Lonar Lake: The only hypersaline meteorite crater lake within basalt rock [J]. Frontiers in Microbiology, 2016,6:1553.
[18] Moreno M L, Piubeli F, Bonfa M R L, et al. Analysis and characterization of cultivable extremophilic hydrolytic bacterial community in heavy-metal-contaminated soils from the Atacama Desert and their biotechnological potentials [J]. Journal of Applied Microbiology, 2012.113(3):550-559.
[19] Kuramshina Z M, Y V Smirnova, R M Khairullin. Increasingtolerance to cadmium stress through endophytic strains of Bacillus subtilis [J]. Russian Journal of Plant Physiology, 2016,63(5): 636-644.
[20] 陈 萍,何文寿.不同盐化土壤理化性质差异研究[J]. 农业科学研究, 2016,37(3):36-39.
Chen P, He W T. Study on the difference of physical and chemical properties of different salinized soils [J]. Journal of Agricultural Sciences, 2016,37(3):36-39.
[21] 李杉杉.镉污染土壤高效钝化-植物阻控效果与机理研究[D]. 北京:中国地质大学(北京), 2019.
Li S S. Effect and mechanism of Cd immobilization in Cd contaminated Farmland [D]. Beijing: China University of Geosciences (Beijing), 2019.
[22] Wang T, Liu W, Xiong L, et al. Influence of pH, ionic strength and humic acid on competitive adsorption of Pb(II), Cd(II) and Cr(III) onto titanate nanotubes [J]. Chemical Engineering Journal, 2013:215-216.
[23] Li S S, Wang M, Zhao Z Q, et al. Alleviation of cadmium phytotoxicity to wheat is associated with Cd re-distribution in soil aggregates as affected by amendments [J]. Rsc Advances, 2018, 8(31):17426-17434.
[24] Malandrino M C, Swarup A, Wanjari R H, et al. Accumulation of heavy metals from contaminated soil to plants and evaluation of soil remediation by vermiculite [J]. Chemosphere, 2011,82(2):169-178.
[25] Hale B, L Evans, R Lambert. Effects of cement or lime on Cd, Co, Cu, Ni, Pb, Sb and Zn mobility in field-contaminated and aged soils [J]. Journal of Hazardous Materials, 2012,199:119-127.
[26] 闫帅成,张克峰,刘 雷,等.土壤中镉的形态及其影响因素研究进展[J]. 中国人口·资源与环境, 2016,26(S2):354-358.
YAN S C, ZHANG K F, LIU L, et al., 2016. Research progress on the forms of cadmium in soil and its influencing factors [J]. China Population·Resources and Environment, 2016,26(S2):354-358.
[27] 颜世红.酸化土壤中镉化学形态特征与钝化研究[D]. 淮南:安徽理工大学, 2013.
Yan S H. Study on the chemical form and passivation of cadmium in acidified soil [D]. Huainan: Anhui University of Science and Technology, 2013.
[28] Wang Z W, Zheng X F, Xiao Y U, et al. Adsorption behaviors of Cd2+on Fe2O3/MnO2and the effects of coexisting ions under alkaline conditions [J]. Chinese Journal of Geochemistry, 2010,29(2):197-203.
[29] 王祖伟,弋良朋,等.碱性土壤盐化过程中阴离子对土壤中镉有效态和植物吸收镉的影响[J]. 生态学报, 2012,32(23):7512-7518.
Wang Z W, Yi L P, Gao W Y, et al. Impact of inorganic anions on the cadmium effective fraction in soil and its phytoavailability during salinization in alkaline soils [J]. Acta Ecologica Sinica, 2012,32(23): 7512-7518.
[30] Tang X J, Li X, Liu X, et al. Effects of inorganic and organic amendments on the uptake of lead and trace elements bygrown in an acidic red soil [J]. Chemosphere, 2015,119: 177-183.
[31] Wan D, Zhang N, Chen W, et al. Organic matter facilitates the binding of Pb to iron oxides in a subtropical contaminated soil [J]. Environmental Science and Pollution Research, 2018,25(32):32130- 32139.
[32] Burkhardt E M, Bischoff S, Akob D M, et al. Heavy metal tolerance of Fe(III)-reducing microbial communities in contaminated creek Bank Soils [J]. Applied and Environmental Microbiology, 2011,77(9):3132- 3136.
[33] Hamamura N, Olson S H, Ward D M, et al. Diversity and functional analysis of bacterial communities associated with natural hydrocarbon seeps in acidic soils at Rainbow Springs, Yellowstone National Park [J]. Applied and Environmental Microbiology, 2005,71(10):5943- 5950.
[34] Ledrich M L, Stemmler S, Laval-Gilly P, et al. Precipitation of silver-thiosulfate complex and immobilization of silver byCH34 [J]. Biometals, 2005,18(6):643-650.
[35] Alvarez A, Benimeli C S, Saez J M, et al. Bacterial bio-resources for remediation of hexachlorocyclohexane [J]. International Journal of Molecular Sciences, 2012,13(11):15086-106.
[36] Wakelin S A, Nelson P N, Armour J D, et al. Bacterial community structure and denitrifier (nir-gene) abundance in soil water and groundwater beneath agricultural land in tropical North Queensland, Australia [J]. Soil Research, 2011,49(1):65-76.
Effect of sodium salt with varied anions on Cd fractions and microbial community in soil.
WANG Li-fu, ZHAO Shu-wen, LI Shan-shan, QIN Lu-yao, SUN Xiao-yi, LEI Xiao-qin, CHEN Shi-bao, WANG Meng*
(Key Laboratory of Plant Nutrition and Fertilizer, Ministry of Agriculture and Rural Affairs, Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081, China)., 2021,41(9):4221~4230
In order to explore the impact of saline-alkaline stress on soil microbial community structures and Cd availability, different Cd-contaminated soils from wastewater-irrigated agricultural land were collected, the actual saline-alkali environment was simulated by adding the neutral and alkaline salts in different proportions. Soil microcosm incubations were conducted, Illumina high-throughput sequencing of 16S rRNA genes was used to estimate microbial community structures, and basic soil physiochemical properties and Cd content were determined. The results showed that salt addition positively affected sodium adsorption ratio (SAR), alkalinity (ESP), but reduced the content of soil organic carbon (SOC), cation exchange capacity (CEC). Increased soil salinity and alkalinity increased the proportion of small soil aggregates (<0.002mm), and promoted Cd translocation from large aggregates into clay/silt size fractions. Treatment T1 (mainly contained ions of SO42-and Cl-) enhanced exchangeable Cd content in both test soils by 27.06% and 11.00%. Soil saline-alkali stress decreased bacterial abundance and diversity, comparatively, soil microbial community in T1 showed the highest difference. Meanwhile, salt addition changed major soil bacterial taxa, for example, increased saline stress enriched saline-alkali tolerant taxaand heavy-metal resistant taxa, microbial structure difference under different treatments probably depended the components of soil anions. For instance, comparatively, the abundance of,andwas significantly enriched in T1treatment. Redundancy analysis (RDA) of the abundant bacterial phyla and soil properties suggested that soil pH, exchangeable Cd content, SAR and ESP were the most influential environmental factors driving the changes in community composition, the abundances of,, andwere positively correlated with pH, and the abundances ofandwere strongly positively correlated with soil exchangeable Cd content, SAR. Therefore, saline-alkali stress increased soil Cd availability, significantly altered soil bacterial community.
wastewater-irrigated soil;cadmium availability;Cd fractions;microbial community
X53,X172
A
1000-6923(2021)09-4221-10
王立夫(1997-),男,河北秦皇岛人,中国农业科学院农业资源与农业区划研究所硕士研究生,主要从事农田土壤重金属污染机制与修复相关研究.
2021-02-14
国家自然科学基金资助项目(41877387);中央级公益性科研院所基本科研业务费专项(1610132021008)
* 责任作者, 副研究员, wangmeng@caas.cn
