阿魏酸对间充质干细胞增殖、分泌 干细胞因子和成管分化的影响
2021-09-22肖慧彭林娟熊武白雪谭梅鑫李叶兰杨莹朱晨鸿邹晓玲
肖慧 彭林娟 熊武 白雪 谭梅鑫 李叶兰 杨莹 朱晨鸿 邹晓玲
〔摘要〕 目的 探討阿魏酸(ferulic acid, FA)对间充质干细胞(mesenchymal stem cells, MSCs)增殖、分泌干细胞因子(stem cell factor, SCF)和定向内皮细胞成管分化的影响。方法 取足月健康新生儿脐带血10 mL,采用密度梯度离心法得到单个细胞,并鉴定人脐带血间充质干细胞(human umbilical cord blood mesenchymal stem cells, hUCBMSCs)分化能力。将hUCBMSCs分别用不同浓度梯度的FA(0、1、2、4、8、16 mg/L)干预以确定FA促hUCBMSCs增殖的最佳浓度。取hUCBMSCs随机分为实验组与对照组,实验组用最佳浓度FA干预,对照组用等体积PBS液处理。分别采用CCK-8细胞增殖试验、Matrigel体外成管试验及ELISA法检测两组hUCBMSCs增殖、成管及分泌SCF的能力;采用免疫荧光法检测hUCBMSCs向内皮细胞分化后CD31、vWF的表达情况。结果 (1)hUCBMSCs能成功诱导分化为骨细胞、软骨细胞、脂肪细胞;(2)FA促进hUCBMSCs增殖的最佳浓度为2 mg/L;(3)与对照组相比,实验组hUCBMSCs增殖、成管及分泌SCF能力显著增强,且FA诱导成管分化后CD31和vWF的表达明显增多(P<0.05)。结论 FA能促进hUCBMSCs增殖及分泌SCF,同时能诱导hUCBMSCs成管分化,进一步证实FA具有促进血管新生的潜能。
〔关键词〕 阿魏酸;间充质干细胞;细胞增殖;干细胞因子;成管分化;血管新生
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.08.005
Effects of Ferulic Acid on the Proliferation, Stem Cell Factor Secretion and Tube
Differentiation of Mesenchymal Stem Cells
XIAO Hui1, PENG Linjuan1, XIONG Wu2, BAI Xue1, TAN Meixin1, LI Yelan1, YANG Ying1, ZHU Chenhong1, ZOU Xiaoling2*
(1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China)
〔Abstract〕 Objective To study the effects of ferulic acid (FA) on the proliferation, the secretion of stem cell factor (SCF) and the differentiation of targeted endothelial cells by mesenchymal stem cells (MSCs). Methods Single nuclear cells were isolated by density gradient centrifugation from cord blood of full-term healthy newborns, and the differentiation ability of human umbilical cord blood mesenchymal stem cells (hUCBMSCs) were identified. hUCBMSCs were intervened with FA with different concentration gradients (0, 1, 2, 4, 8, 16 mg/L) to determine the optimal concentration of FA to promote the proliferation of hUCBMSCs. hUCBMSCs were randomly divided into the experimental group and the control group. The experimental group was intervened with the best concentration of FA, the control group was treated with PBS solution of equal volume. CCK-8 cell proliferation test, Matrigel in vitro tube test and ELISA method were used to detect the proliferation, tube formation and SCF secretion ability of the two groups of hUCBMSCs; immunofluorescence method was used to detect the expression of CD31 and vWF after hUCBMSCs differentiated into endothelial cells. Results (1) hUCBMSCs can successfully induce differentiation into bone cells, chondrocytes and adipocytes. (2) The optimal concentration of FA to promote the proliferation of hUCBMSCs is 2 mg/L. (3) Compared with the control group, the ability of hUCBMSCs in the experimental group to proliferate, form tubes and secrete SCF was significantly enhanced, and the expression of CD31 and vWF increased significantly after FA induced tube differentiation (P<0.05). Conclusion FA can promote the proliferation, the secretion of SCF from hUCBMSCs, and induce the differentiation of hUCBMSCs into tubes, further confirming that FA has the potential to promote angiogenesis.
〔Keywords〕 ferulic acid; mesenchymal stem cell; cell proliferation; stem cell factor; tube differentiation; angiogenesis
间充质干细胞(mesenchymal stem cells, MSCs)是一类具有自我复制、更新和多向分化潜能的多功能细胞,主要来源于中胚层,可在骨髓、外周血、脐血、脂肪组织中分离提取[1]。当局部血管损伤时,MSCs能诱导分化为血管内皮细胞,同时分泌干细胞因子(stem cell factor, SCF)调节体内促血管新生细胞的增殖,使受损部位的血管以“发芽”的形式形成新的血管床,进而促进损伤血管的修复[2]。阿魏酸(ferulic acid, FA)属酚酸类化合物,是中药川芎、当归的主要成分之一,具有抑制血小板聚集、血管保护及抗氧化等作用[3-4],研究[5]发现其具有促进血管新生、保护内皮细胞的作用。本研究将探讨FA对人脐带血间充质干细胞(human umbilical cord blood mesenchy?
mal stem cells, hUCBMSCs)增殖、分泌SCF和成管分化的影响,为活血化瘀药川芎、当归在临床上的应用提供新的理论基础。
1 材料
1.1 药品与试剂
FA(批号:S31399,纯度≥99.0%)、人淋巴细胞分离液(批号:P8610)均购自中国北京索莱宝科技有限公司;胎牛血清(批号:10270-106)、胰酶(批号:15050-057)均购自美国Gibco公司;青霉素-链霉素双抗溶液(批号:KGY002,中国南京凯基生物科技发展有限公司);PBS液(批号:SH30256.01B)、DMEM/F12培养基(批号:SH30023.01B)均购自美国Hyclone公司;hUCBMSCs成骨诱导分化培养基试剂盒(批号:HUXUB-90021)、hUCBMSCs成软骨诱导分化培养基试剂盒(批号:HUXUB-90042)、hUCBMSCs成脂肪诱导分化培养基试剂盒(批号:HUXMA-90031)均购自美国OriCell公司;茜素红染液(批号:130-22-3RT)、油红O染液(批号:O1391-250ML)均購自美国Sigma公司;阿尔新蓝染液(批号:MAS0981,中国MesGen公司);细胞计数试剂盒(批号:C0037,中国碧云天生物技术研究公司);SCF-ELISA试剂盒(批号:KS14694,中国上海江莱生物科技有限公司)。
1.2 实验仪器
CO2培养箱(型号:XD-101,日本SANYO公司);荧光显微镜(型号:BX51,日本OLYMPUS公司);酶联免疫检测仪(型号:MK3,美国Thermo公司);96孔板(型号:3590,美国Corning公司);超净工作台(型号:SW-CJ-1FD,中国苏州净化公司);台式低速离心机(型号:5415R)、4 ℃离心机[型号:5804(R)]均购自德国Eppendorf公司;振荡器(型号:WH-2,中国上海沪西分析仪器厂)。
2 方法
2.1 hUCBMSCs分离与培养
无菌条件下取足月健康新生儿脐带血10 mL,加入20 U/mL肝素室温静置。将人淋巴细胞分离液移入离心管中,加入细胞悬液(将脐带血与PBS液1﹕1稀释混匀)经密度梯度离心后得到单个核细胞,再移入含5%胎牛血清、1%青霉素-链霉素双抗溶液的DMEM/F12培养基中,37 ℃培养箱中培养7 d,传代到第3代冻存。
2.2 hUCBMSCs的诱导分化鉴定
将冻存细胞复苏,当细胞融合到80%左右时,胰酶消化,接种到明胶包被的24孔板,每组设4个复孔,37 ℃、5% CO2培养箱中培养,当细胞融合到60%~70%时,分别按照hUCBMSCs成骨诱导分化培养基试剂盒、hUCBMSCs成软骨诱导分化培养基试剂盒、hUCBMSCs成脂肪诱导分化培养基试剂盒说明书要求,将细胞移入相应培养基中培养[成骨诱导分化完全培养基:含10%胎牛血清、10 mmol/L β-甘油磷酸钠、0.1 μmol/L地塞米松、50 μg/mL抗坏血酸的DMEM/F12培养基;成软骨诱导分化完全培养基:含体积分数为10%胎牛血清、1 mmol/L丙酮酸钠、10 μg/L转化生长因子β、50 g/L ITS(10 μg/L胰岛素、5.5 μg/L转铁蛋白、0.67 μg/L亚硒酸钠)、0.1 μmol/L地塞米松、50 μg/mL抗坏血酸的DMEM/F12培养基;成脂诱导分化培养基:含10%胎牛血清、0.1 μmol/L地塞米松、10 mg/L胰岛素、0.5 mmol/L异丁基黄嘌呤、200 μmol/L消炎痛的DMEM/F12培养基],每3 d更换1次培养基,视细胞形态变化及生长情况,分别用茜素红、阿尔新蓝及油红O染色以确定细胞成骨、成软骨、成脂肪染色效果。在荧光显微镜下观察染色效果并拍照。
2.3 FA促hUCBMSCs增殖的最佳浓度测定
将FA加入DMEM/F12培养基溶解至10 mL,反复吹打至充分溶解,0.22 μm滤过膜滤过,于
-20 ℃保存备用。依据CCK-8细胞计数试剂盒说明书要求,收集对数生长期的hUCBMSCs,离心收集后置于37 ℃、5% CO2培养箱中培养24 h使细胞贴壁。胰酶消化后在96孔板中配制100 μL细胞悬液,每孔1×104个细胞,放置在37 ℃、5% CO2的培养箱预培养24 h,随后加入FA至各DMEM/F12培养基中,分别稀释至FA终浓度为0、1、2、4、8、16 mg/L,培养48 h后加入10 μL CCK-8溶液,孵育4 h,用酶标仪测定在450 nm处的吸光度(OD值)。同时设置对照孔,每组设定3个复孔。
2.4 实验分组及干预方法
将hUCBMSCs随机分为实验组和对照组,每孔1×105个细胞,实验组用最佳浓度FA干预,对照组用等体积的PBS液处理。
2.5 CCK-8测定hUCBMSCs增殖能力
按“2.4”项分组培养各组细胞48 h,收集各组细胞,依据CCK-8细胞计数试剂盒说明书要求,用酶标仪测定各组细胞在450 nm处的OD值。
2.6 ELISA检测hUCBMSCs分泌SCF能力
按“2.4”项分组培养各组细胞48 h,收集各组上清液,参照ELISA试剂盒说明书,测定酶标仪在450 nm的OD值。
2.7 Matrigel体外成管试验检测hUCBMSCs成管能力
Matrigel基质胶4 ℃过夜溶解,枪头盒、EP管、96孔板均4 ℃过夜预冷,次日在冰盒上进行铺胶。当各组细胞融合至80%左右时,胰酶消化,用含10%胎牛血清的DMEM重悬,调整细胞密度至1×105,培养至细胞贴壁时,各组分别加入最适浓度FA及等容量PBS液,37 ℃孵箱孵育24 h,在荧光显微镜下观察并拍照。每孔随机选取4个视野计算小管形成长度,取平均值。
2.8 免疫荧光法检测hUCBMSCs内皮分化能力
在培養板中放置载玻片,玻片上滴加2 mL含有1×106/mL的hUCBMSCs细胞悬液,加入FA对hUCBM?SCs干预48 h后取出并固定30 min,用PBS冲洗。滴加3% H2O2室温孵育10 min,PBS冲洗。用0.5%Triton X-100(PBS配制)室温通透20 min后PBS冲洗并吸干,滴加正常山羊血清,室温封闭30 min;分别滴加1∶50稀释的CD31抗体和1∶250稀释的vWF抗体,湿盒4 ℃孵育过夜后,PBST 浸洗,滴加稀释好的荧光二抗山羊抗小鼠IgG H&L(FITC),湿盒中20~37 ℃孵育1 h,PBST再浸洗;滴加DAPI避光孵育5 min,进行核复染,PBST浸洗;去除液体,加50%甘油,然后荧光显微镜下观察并采集图像,并采用Image J软件进行定量分析。
2.9 统计学分析
采用SPSS 23.0软件进行统计。计量资料以“x±s”表示,检验各组数据的正态性和方差齐性,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
3 结果
3.1 hUCBMSCs的培养情况
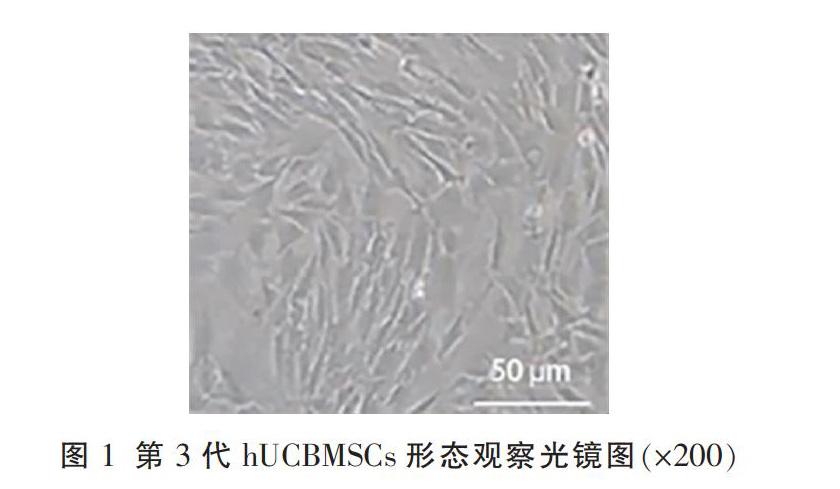
光学显微镜下观察第3代细胞,细胞边缘清晰,形态均一,排列整齐,呈典型的长梭状结构,排列呈漩涡状。见图1。
3.2 hUCBMSCs的鉴定结果
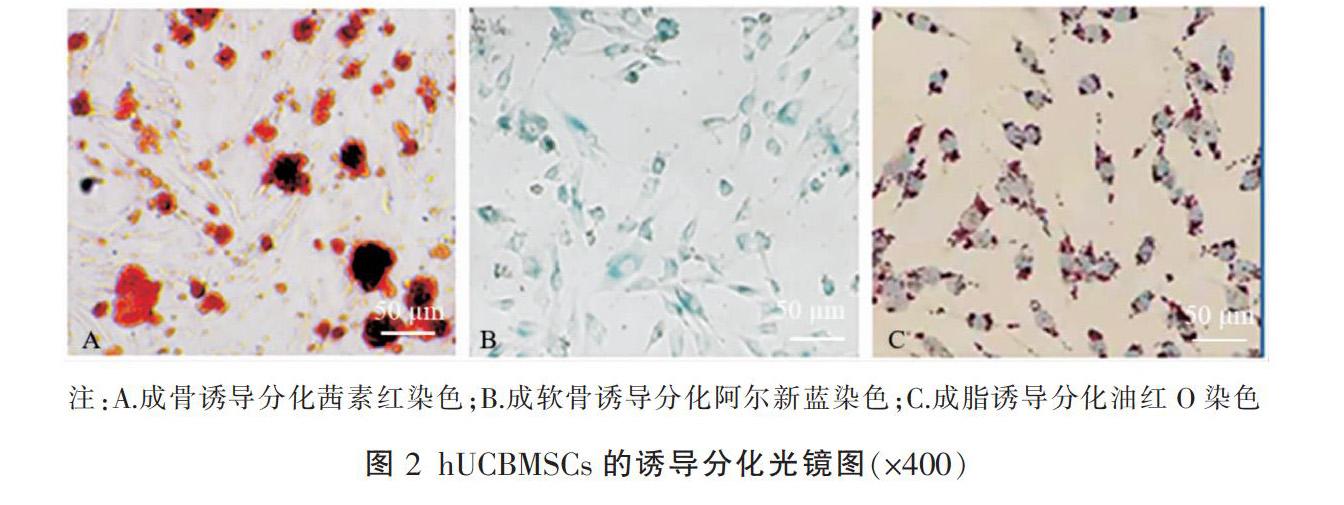
取第4代hUCBMSCs向成骨细胞定向诱导分化:经成骨诱导分化培养基诱导培养4周,茜红素染液染色后,可见钙结节呈红色为阳性,见图2A,表明hUCBMSCs被诱导分化为骨细胞。取第4代hUCBMSCs向成软骨细胞定向诱导分化:经成软骨诱导分化培养基诱导培养21 d,阿尔新蓝染色后,细胞呈蓝色,见图2B,表明hUCBMSCs被诱导分化为软骨细胞。取第4代hUCBMSCs向成脂肪细胞定向诱导分化:经成脂肪诱导分化培养基诱导培养14 d,油红O染液染色后可见空泡状脂滴呈橘红色,见图2C,表明hUCBMSCs被诱导分化为脂肪细胞。
3.3 FA促hUCBMSCs增殖的最佳浓度测定结果
随着FA处理浓度的增加,hUCBMSCs增殖能力逐渐增强;当FA浓度为2 mg/L时,细胞增殖能力最强;随后FA浓度继续增加,hUCBMSCs的增殖能力逐渐减弱。因此,FA促hUCBMSCs增殖的最佳浓度为2 mg/L。见图3。
3.4 FA对hUCBMSCs增殖能力的影响
对照组和实验组的OD值分别为(0.354±0.020)和(0.506±0.022),实验组细胞增殖能力明显强于对照组,差异有统计学意义(P<0.05)。见图4。
3.5 FA对hUCBMSCs分泌SCF的影响
对照组和实验组分泌SCF含量分别为(109.990±3.629) pg/mL和(367.747±36.948) pg/mL。与对照组比较,实验组分泌SCF含量增加,差异有统计学意义(P<0.05)。见图5。
3.6 FA诱导hUCBMSCs体外成管情况
对照组和实验组hUCBMSCs体外形成管网状结构的长度分别为(95.533±6.315) mm和(299.657±28.239) mm,实验组形成的血管长度明显长于对照组,差异有统计学意义(P<0.05)。见图6-7。
3.7 FA诱导hUCBMSCs向内皮分化情况
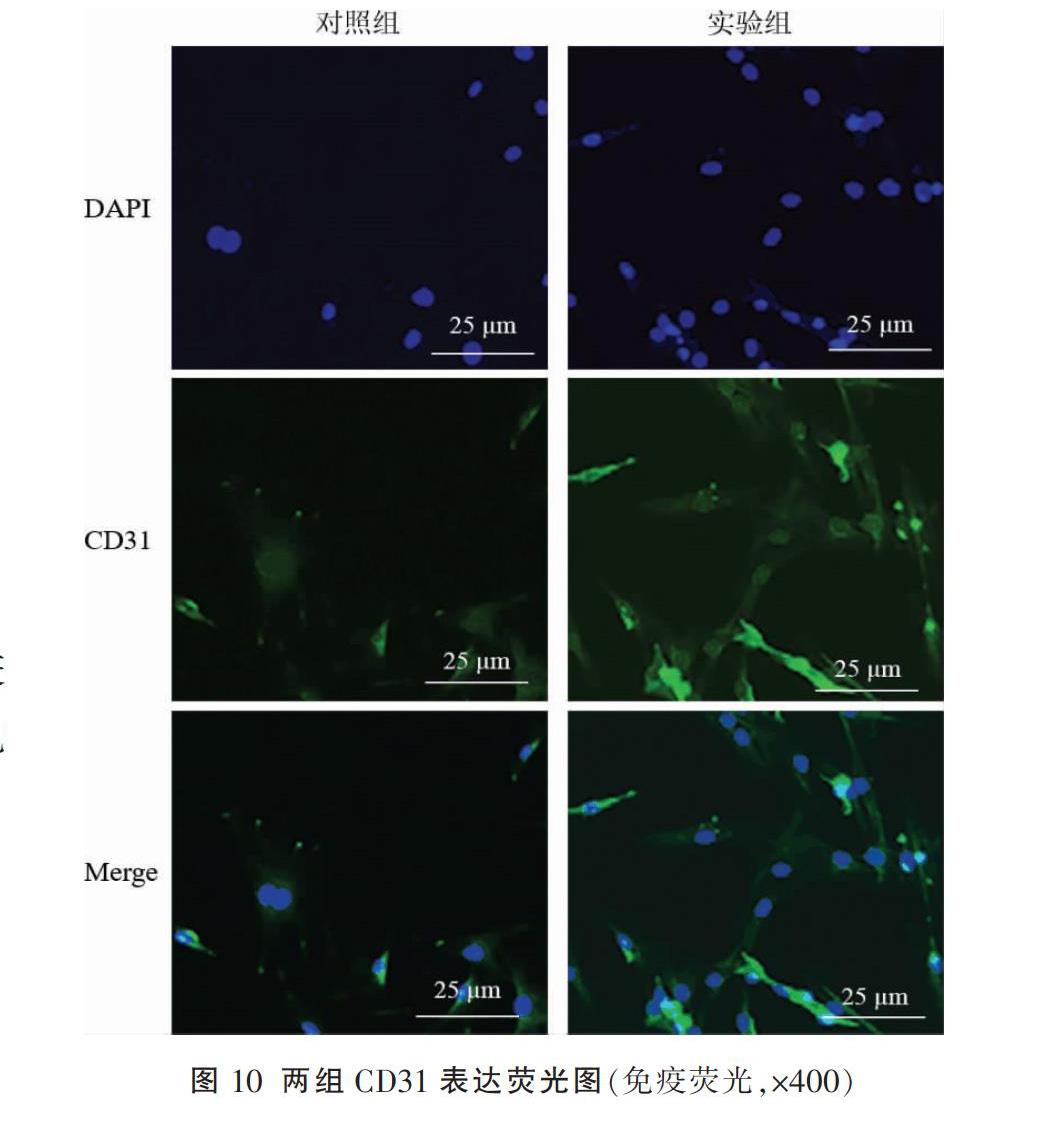
与对照组相比,实验组CD31和vWF蛋白免疫荧光强度显著增高,差异有统计学意义(P<0.05)。见图8-10。
4 讨论
MSCs是一类具有高度增殖、自我更新和多向分化潜能的成体干细胞,广泛存在于机体内,在特定诱导条件下可分化成神经元、心肌细胞、骨细胞、成骨细胞、内皮细胞等多种细胞,移植进入机体可替换损伤组织或产生修复因子促进组织再生[6-7]。因此,MSCs具有广泛的应用前景,极大地推动了再生医学的发展和退行性疾病的治疗。目前,MSCs的获得主要来源于骨髓、外周血、脂肪、脐血中[1]。研究[2,8-10]发现,MSCs旁分泌的SCF是C-Kit原癌基因编码受体的配体蛋白,它参与机体发育中的多种细胞生长的调控,是一种多功能细胞生长因子,在MSCs增殖、分化和迁移过程中发挥重要的调控作用。Cao Z Y团队[11]研究发现,SCF可能通过表达与PI3K/AKT、ERK1/2和STAT3信号通路相关的蛋白质用以维持线粒体功能,从而维持人骨髓MSCs活性。
四物汤是养血活血的基础方剂,由熟地黄、当归、川芎、白芍组成,当归具有补血养肝、活血调经之效,川芎辛散温通,能活血行气止痛。FA作为两药的主要活性成分之一,其化学名是4-羟基-3-甲氧基肉桂酸,现代药理研究[4,12]发现,FA具有抗氧化、抗血栓、抗炎症、抗血脂等作用。石定[13]发现FA能促进内皮细胞增殖、迁移并上调VEGF、PDGF及HIF-1α蛋白的表达,提高创面组织中微血管密度,促进大鼠慢性创面愈合。李玉梅等[14]证实,黄芪甲苷联合FA对氯化钴所致的缺氧人脐静脉内皮细胞具有保护作用,能促进内皮细胞迁移,有利于血管生成,其机制可能与激活JAK-STAT信号通路有关。以上研究均证实FA具有促进血管新生、保护内皮细胞的潜能。娄远蕾等[15]发现,MSCs经阿魏酸钠诱导后向神经细胞分化,诱导分化的细胞能在脑缺血大鼠脑内存活,且主要分布在缺血侧损伤区,并仍保留已分化神经细胞的特性。Qu Q X等[5]研究发现,miRNA-126-3p修饰的hUCBMSCs移植对静脉移植物具有更高的重新内皮化。本研究是基于FA具有血管新生的作用和MSCs在特定条件下能定向分化为内皮细胞的文献报道,而将两者联系在一起展开的研究。
本研究探讨了FA对hUCBMSCs增殖、分泌SCF和定向内皮分化的影响。结果发现,2 mg/L FA为促进hUCBMSCs增殖的最佳浓度,且对hUCBMSCs具有保护作用。随着FA浓度的不断增加,hUCBMSCs增殖能力较正常状态下降,考虑高浓度的FA可能对hUCBMSCs具有毒性。对照组和实验组分泌SCF含量分别为(109.990±3.629) pg/mL和(367.747±36.948) pg/mL,结果表明,与对照组相比,2 mg/L FA能显著促进MSCs增殖及分泌SCF(P<0.05),誘导MSCs向内皮细胞定向分化,促使其体外成管(P<0.05)。其机制可能是FA促进MSCs增殖及分泌大量SCF,SCF作为一种多功能细胞生长因子又能自分泌调控MSCs,促进MSCs向内皮细胞分化,进而促进新的血管床形成,这与石定[13]的研究结果相符合。然其具体作用机制尚不明确,需要进一步实验探究。同时,本实验为离体细胞实验,尚存在一定缺陷,FA介导hUCBMSCs发挥血管新生的具体作用机制及FA在血管新生方面的临床应用价值,有待后续实验研究中进一步挖掘。
参考文献
[1] LV F J, TUAN R S, CHEUNG K M, et al. Concise review: The surface markers and identity of human mesenchymal stem cells[J]. Stem Cells, 2014, 32(6): 1408-1419.
[2] 张筱薇,徐 刚.脂肪间充质干细胞在糖尿病足治疗中的研究进展[J].中国美容医学,2019,28(10):165-170.
[3] 毛文点,庹玲玲,齐文续,等.黄芪-当归不同配伍对其6种主要有效成分溶出的影响[J].湖南中医药大学学报,2021,41(3):350-354.
[4] 李海刚,胡晒平,周 意,等.川芎主要药理活性成分药理研究进展[J].中国临床药理学与治疗学,2018,23(11):1302-1308.
[5] QU Q X, WANG L M, BING W D, et al. miRNA-126-3p carried by human umbilical cord mesenchymal stem cell enhances endothelial function through exosome-mediated mechanisms in vitro and attenuates vein graft neointimal formation in vivo[J]. Stem Cell Research & Therapy, 2020, 11(1): 464.
[6] CORTESINI R. Stem cells, tissue engineering and organogenesis in transplantation[J]. Transplant Immunology, 2005, 15(2): 81-89.
[7] 王鹏珍,陈松生,黄伟光,等.bFGF通过β-catenin信号通路促进大鼠外周血间充质干细胞增殖[J].中国生物化学与分子生物学报, 2020,36(12):1489-1497.
[8] 陈俊秋,黄梁浒.间充质干细胞及其外泌体促血管再生的分子机制研究进展[J].中国实验血液学杂志,2018,26(6):1858-1862.
[9] TERASHIMA T, KOBASHI S, WATANABE Y, et al. Enhancing the therapeutic efficacy of bone marrow-derived mononuclear cells with growth factor-expressing mesenchymal stem cells for ALS in mice[J]. Science, 2020, 23(11): 101764.
[10] LI C H, ZHAO H, WANG B. Mesenchymal stem/stromal cells: Developmental origin, tumorigenesis and translational cancer therapeutics[J]. Translational Oncology, 2021, 14(1): 100948.
[11] CAO Z Y, XIE Y Y, YU L, et al. Hepatocyte growth factor (HGF) and stem cell factor (SCF) maintained the stemness of human bone marrow mesenchymal stem cells (hBMSCs) during long-term expansion by preserving mitochondrial function via the PI3K/AKT, ERK1/2, and STAT3 signaling pathways[J]. Stem Cell Research & Therapy, 2020, 11(1): 329.
[12] PRABHAKAR P K, PRASAD R, ALI S, et al. Synergistic interaction of ferulic acid with commercial hypoglycemic drugs in streptozotocin induced diabetic rats[J]. Phytomedicine, 2013, 20(6): 488-494.
[13] 石 定.阿魏酸促进糖尿病大鼠慢性创面血管化及其作用机制研究[D].西安:第四军医大学,2016:3-66.
[14] 李玉梅,鲍慧玮,王楚盈,等.黄芪甲苷与阿魏酸合用调控JAK-STAT通路促进血管内皮细胞增殖作用的研究[J].中国比较医学杂志,2019,29(1):1-8.
[15] 娄远蕾,涂 伟,汪 泱,等.经阿魏酸钠定向诱导的骨髓间充质干细胞在脑缺血大鼠体内移植研究[J].中国微侵袭神经外科杂志,2010,15(12):558-561.
