基于能量代谢探讨参麦注射液对高血压心衰的干预机制
2021-09-22程彬胡志希李琳钟森杰邱宏
程彬 胡志希 李琳 钟森杰 邱宏

〔摘要〕 目的 研究参麦注射液对高血压心衰大鼠能量代谢的影响,揭示药物干预机制。方法 通过高盐饲料喂养Dah1/SS盐敏感大鼠复制高血压心衰模型,成模大鼠随机分为模型组和参麦注射液组[大鼠腹腔注射参麦注射液6.0 mL/(kg·d)],另设普通饲料喂养的正常组。药物干预15 d,运用心脏彩超检测左室射血分数值(left ventricular ejection fraction, LVEF)与左室短轴缩短率值(left ventricular fractional shortening, LVFS),ELISA法检测血清单磷酸腺苷(adenosine monophosphate, AMP)、二磷酸腺苷(adenosine diphosphate,ADP)、三磷酸腺苷(adenosine diphosphate, ADP)、N端前脑钠肽(N-terminal pro-brain natriuretic peptide, NT-proBNP)含量;透射电镜观察心肌细胞线粒体形态结构变化;Western blot法检测大鼠心肌组织中腺苷酸激活蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)、過氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptorsα, PPARα)、PPARγ 辅激活因子1α(proliferator-activated receptor gamma costimulator 1-α, PGC-1α)的蛋白表达量。结果 与正常组相比,模型组大鼠心肌细胞线粒体排列紊乱、形态扭曲、结构破坏,心功能障碍;血清ATP显著降低(P<0.01)、ADP上升(P<0.05)、AMP上升显著(P<0.01);心肌组织的AMPK表达上升(P<0.01),PPARα、PGC-1α降低(P<0.01)。与模型组相比,参麦注射液组大鼠心肌线粒体排列相对整齐,结构恢复,心功能改善;ATP含量上升(P<0.01)、AMP含量下降(P<0.05);AMPK降低(P<0.01)、PPARα与PGC-1α上升(P<0.01)。结论 参麦注射液通过调控AMPK、PPARα、PGC-1α相关蛋白表达,恢复线粒体结构和功能,促进ATP生成,改善能量代谢障碍,从而优化心功能。
〔关键词〕 慢性心力衰竭;高血压;参麦注射液;线粒体;能量代谢
〔中图分类号〕R256.2;R541.6+1 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.08.007
Intervention Mechanism of Shenmai Injection on Hypertensive Heart Failure
Based on Energy Metabolism
CHENG Bin, HU Zhixi*, LI Lin, ZHONG Senjie, QIU Hong
(Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To study the effect of Shenmai Injection on energy metabolism of hypertensive heart failure rats and reveal the mechanism of drug intervention. Methods The hypertensive heart failure model was established by feeding Dah1/SS salt-sensitive rats with high-salt diet. The model rats were randomly divided into model group and Shenmai Injection group [rats were intraperitoneally with Shenmai Injection 6.0 mL/(kg·d)], and the normal group fed with ordinary diet was additionally set up. After 15 days of drug intervention, left ventricular ejection fraction (LVEF) and left ventricular fractional shortening (LVFS) were detected by cardiac color Doppler ultrasonography. Serum adenosine monophosphate (AMP), adenosine diphosphate (ADP), adenosine triphosphate (ATP) and N-terminal pro-brain natriuretic peptide (NT-proBNP) were detected by ELISA. The morphological and structural changes of mitochondria of myocardial cells were observed by transmission electron microscopy. The protein expression levels of adenosine monophosphate-activated protein kinase (AMPK), peroxisome proliferator activated receptors α (PPARα) and PPARγ coactivator 1α (PGC-1α) in rat cardiac tissue were detected by Western blot. Results Compared with the normal group, the mitochondria in the model group were disordered, distorted and destroyed, and the cardiac function was impaired; serum ATP was significantly decreased (P<0.01), ADP was increased (P<0.05), and AMP was significantly increased (P<0.01); the expression of AMPK in myocardial tissue was increased (P<0.01), while PPARα and PGC-1α were decreased (P<0.01). Compared with model group, the myocardial mitochondria of rats in Shenmai Injection group were arranged relatively neatly, the structure was restored and the cardiac function was improved; ATP content increased (P<0.01), AMP content decreased (P<0.05); AMPK decreased (P<0.01), PPARα and PGC-1α increased (P<0.01). Conclusion By regulating the expression of AMPK, PPARα and PGC-1α-related proteins, Shenmai Injection can restore the structure and function of mitochondria, promote the generation of ATP and improve the energy metabolism disorder, so as to optimize the cardiac function.
〔Keywords〕 chronic heart failure; hypertension; Shenmai Injection; mitochondria; energy metabolism
课题组前期运用高盐饲养Dah1/SS盐敏感大鼠制备高血压心衰大鼠模型,通过“以方测证”方法,发现参麦注射液比参附注射液疗效更优,已确证为慢性心衰心气阴虚证 [1-3]。基于慢性心衰心气阴虚证大鼠模型,进行了血浆代谢组学研究,钟森杰等[4]利用前期研究成果进行了Meta分析,发现参麦注射液能够有效优化心衰的心脏能量供应,认为心衰的发生可能与心脏能量代谢相关。故本研究拟从能量代谢角度出发,以心肌线粒体形态结构,血清三磷酸腺苷(adenosine triphosphate, ATP)、二磷酸腺苷(adenosine diphosphate, ADP)、单磷酸腺苷(adenosine mono?
phosphate, AMP)表达水平,心肌组织腺苷酸激活蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)、过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptorsα,PPARα)、PPARγ 辅激活因子1α(proliferator-activated receptor gamma costimulator 1-α,PGC-1α)蛋白表达为观察指标,揭示参麦注射液干预高血压心衰的作用机制。
1 材料与方法
1.1 动物
6周龄Dahl盐敏感雄性大鼠28只,体质量(230±10) g,由北京维通利华实验动物有限公司提供(合格证编号:1100111911056756),所有大鼠均饲养于湖南中医药大学实验动物中心SPF级实验室内,方案由湖南中医药大学实验动物伦理委员会批准(批准编号:LL20190902402)。
1.2 药物与试剂
大鼠N 端前脑钠肽(N-terminal pro-brain natriu?retic peptide, NT-proBNP)酶联免疫吸附测定法(enzyme-linked immunosorbent assay, ELISA)试剂盒为武汉华美生物工程有限公司产品(货号:CSB-E08752r;产品批号:T06035807);高盐、低盐饲料为北京科澳协力饲料有限公司提供;Gluta固定液(电镜专用,2.5%)为北京索莱宝科技有限公司产品(货号:P1126);参麦注射液(50 mL/瓶)购于正大青春宝药业有限公司,国药准字:Z33020019,产品批号:1909288;灭菌注射用水购于国药集团容生制药有限公司,国药准字:H41024923;ADP检测试剂盒为cloud-clone crop公司产品(产品批号:CEB069Ge 96T); AMP检测试剂盒为cloud-clone crop公司产品(产品批号:CEA003Ge 96T);ATP检测试剂盒为cloud-clone crop公司产品(产品批号:CEA349Ge 96T);AMPK Western blot试剂盒购于英国abcam公司(货号:ab32047);PPARα Western blot试剂盒购于英国abcam公司(货号:ab24509);PGC-1α Western blot试剂盒购于英国abcam公司(货号:ab54481)。
1.3 主要仪器
全自动样品研磨机(上海净信实业发展有限公司,型号:JXFSTPRP-24/32型);小型台式冷冻离心机(湖南湘仪仪器有限公司,型号:H1650R型);彩色多普勒超声诊断仪(深圳开立科技有限公司,型号:SonoScape-S2N型);实验小动物无创血压计(美国Kent Scientific公司,型号:CODA型);透射电子显微镜(日本电子株式会社,型号:JEM1400);精密PH计(上海雷磁仪器厂,型号:E-201-C);切片机(德国Leica Biosystems公司,型号:Leica UC-7);数码相机(德国EMSIS GMBH公司,型号:morada G3型)。
1.4 模型制备
通过高盐饲养Dah1/SS盐敏感雄性大鼠的方式,复制高血压心衰大鼠模型[1]。将28只6周龄Dah1/SS盐敏感雄性大鼠,按照随机数字表法分为正常组(8只)和造模组(20只),先适应性喂养至7周龄。随后造模组予高盐饲料(8%氯化钠浓度)喂养,正常组继续正常饲料喂养,共计20周。观察一般行为及体征,每4周测量血压1次,饲养20周运用SonoScape-S2N型彩色多普勒超声诊断仪进行心脏彩超检测,综合衡量大鼠左室射血分数(left ventricular ejection fraction, LVEF)与左室短轴缩短率(left ventricular fractional shortening, LVFS)。眼眶取血检测血清NT-proBNP,综合衡量,判断成模。
1.5 分组与给药
造模组大鼠死亡3只。将造模成功的17只Dah1/SS盐敏感雄性大鼠按照随机数字表法分为模型组(9只),参麦注射液组(8只)。利用人与动物等效剂量换算(人体质量按照60 kg),参麦注射液组大鼠每天腹腔注射6.0 mL/kg药物,正常组与模型组大鼠每天腹腔注射6.0 mL/kg注射灭菌用水,给药共计15 d。
1.6 ELISA法检测ATP、ADP、AMP含量
用药干预15 d之后,通過腹主动脉取血,离心取得血清,进行ELISA检测ATP、ADP、AMP含量,具体操作按照试剂盒说明进行。
1.7 透射电镜检测心肌线粒体
研究[5]证明高血压心衰导致心脏左室肥厚及左室结构异常,故取大鼠左心室部分,将其泡入电镜固定液中,电镜检测步骤如下:(1)固定。取大约1 mm3组织若干块,先后用2.5%戊二醛、PBS缓冲液以及1%锇酸固定样本。(2)脱水。用30%、50%乙醇脱水各10 min;然后用70%乙醇醋酸铀(包埋前染色)3 h;80%、95%乙醇分别脱水10、15 min;用100%乙醇两次各50 min;最后用环氧丙烷置换乙醇30 min。(3)浸透。先用环氧丙烷与环氧树脂1∶1浸泡1~2 h,再用纯环氧树脂浸泡2~3 h。(4)包埋。纯环氧树脂包埋后入40 ℃烤箱烘烤12 h,再入60 ℃烤箱烘烤48 h。(5)切片。取出包埋块后切片成超薄,用铜网捞片。(6)染色。先进行包埋,再用柠檬酸铅进行染色处理。(7)拍照。先在透射电镜下观察,再用数码相机记录图像。
1.8 Western blot法检测AMPK、PPARα、PGC-1α蛋白表达量
用药干预15 d之后,通过取材获得大鼠左心室部分心肌组织,采用Western blot法检测AMPK、PPARα、PGC-1α蛋白表达量,具体步骤如下:取约0.02 g心肌组织置于EP管中,加入300 μL RIPA裂解液于生物样品均质仪中反复研磨,直至肉眼不可见组织块,将研磨好的液体转至1.5 mL离心管中,并置冰上充分裂解10 min。置于4 ℃低温高速离心机离心,转速为12 000 r/min,离心15 min。最后将离心后的蛋白上清转移至另一支干净的1.5 mL离心管中,并测定蛋白浓度。SDS-PAGE电泳法进行蛋白质分离后经转膜,用1×PBST配制的5%脱脂奶粉封闭,滴加一抗工作液4 ℃孵育过夜,各指标的一抗稀释比例分别为AMPK(1∶3 000),PPARα(4 μg/mL),PGC-1α(1:1 000)。一抗孵育结束后,用1×PBST洗3次,每次15 min。用1×PBST稀释HRP标记的二抗,将稀释后的二抗与膜共同室溫孵育60 min,孵育结束后,用1×PBST洗3次,每次10 min。最后使用ECL化学发光液与膜孵育1 min,用滤纸吸尽液体,塑封膜将膜包裹杂交膜,在暗盒内与X胶片曝光1~120 min;显影冲洗,将曝光后的底片扫描,并用Quantity-One专业灰度分析软件进行分析。
1.9 统计学分析
本研究采用SPSS 22.0软件分析。计量资料若满足正态性和方差齐性,采用“x±s”表示,两组间采用成组t检验,不满足方差齐性,则采用t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 高血压心衰大鼠模型制备与验证
与正常组相比,造模组大鼠精神亢奋,性格暴躁,出现不同程度的毛色晦暗无光泽、掉毛严重、精神萎靡、喜蜷卧、懒动、步态摇摆等现象。血压值检测发现,造模组大鼠血压明显高于正常组,基本稳定在200 mm Hg以上,高血压模型成功建立。造模20周后,与正常组相比,造模组血清NT-proBNP含量显著升高(P<0.01);LVEF与LVFS明显降低(P<0.01)。见表1。
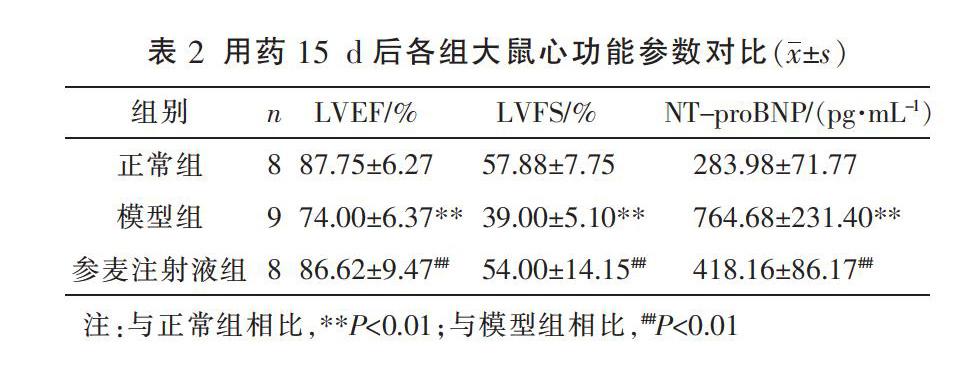
2.2 参麦注射液对高血压心衰大鼠心功能主要参数的影响
用药15 d,与正常组相比,模型组LVEF值与LVFS值降低明显(P<0.01),NT-proBNP明显上升(P<0.01);与模型组相比,参麦注射液组LVEF值和LVFS值均明显上升(P<0.01),NT-proBNP显著下降(P<0.01)。见表2。
2.3 参麦注射液对高血压心衰大鼠心肌线粒体结构影响
给药后透射电镜观察各组大鼠心肌线粒体的变化,结果发现:正常组大鼠心肌线粒体数量较多,排列紧密,内外膜完整,内部嵴结构清晰;模型组大鼠心肌线粒体排列紊乱,呈肿胀、扭曲状,线粒体内膜或外膜破裂,线粒体嵴模糊不清,部分线粒体出现了内部组织缺失的空泡化现象;参麦注射液组大鼠心肌线粒体排列整齐,内外膜相对完整,嵴结构更加清晰完整,空泡化程度降低。见图1。
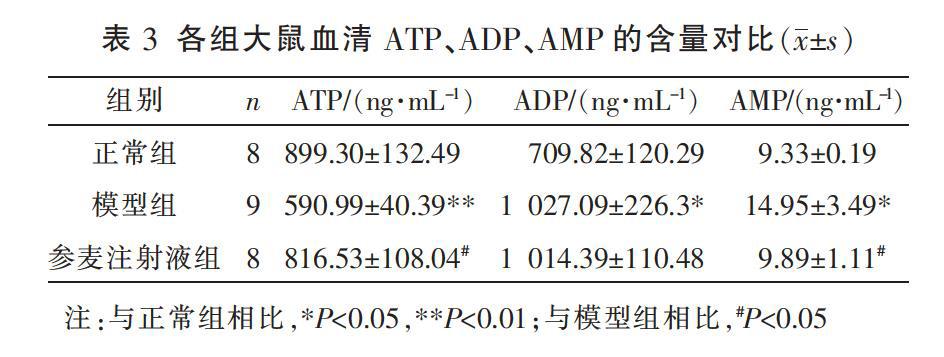
2.4 参麦注射液对高血压心衰大鼠ATP、ADP、AMP含量的影响
与正常组相比,模型组大鼠ATP含量显著降低(P<0.01),ADP和AMP含量上升(P<0.05);与模型组大鼠相比,参麦注射液组大鼠ATP含量上升(P<0.05),AMP含量降低(P<0.05),ADP含量比较差异无统计学意义(P>0.05)。见表3。
2.5 参麦注射液对高血压心衰大鼠AMPK、PPARα、PGC-1α蛋白表达量影响
与正常组相比,模型组AMPK明显上升,PPARα、PGC-1α明显降低,差异有统计学意义(P<0.01)。与模型组相比,参麦注射液组AMPK明显降低,PPARα、PGC-1α明显上升,差异有统计学意义(P<0.01)。见表4、图2。
3 讨论
慢性心衰是各类心血管疾病的最终阶段,是由于心脏结构或功能异常导致心室充盈或射血能力受损的一组复杂临床综合征[6-7]。慢性心衰作为21世纪主要重大疾病之一,也是现代医学研究的重点与难点。高血压患者由于心肌细胞肥大、心肌纤维化以及周围血管硬化等多种因素,导致心脏代偿功能失调,出现左室肥厚,引起心脏能量代谢的变化,心脏供能不足,最终导致心衰[8]。本实验是基于能量代谢,研究参麦注射液对高血压诱导的射血分数保留性心衰的治疗作用。现代医家一般将心衰常见证型分为心肺气虚证、气阴两虚证、心肾阳虚证、气虚血瘀证、痰饮阻肺证、阳虚水泛证、阴竭阳脱证等7类[9]。其中心气阴两虚证作为心衰临床常见证型之一,前期研究成果显著。本实验选用的参麦注射液由元代名医朱震亨的生脉散发展而来,主要包含红参与麦冬两种主要成分[10],能够补气养阴以生津,有效改善心衰末期患者出现的短气乏力、四肢倦怠、汗出口渴等症状,临床推广效果较好,特别是应用于慢性心衰心气阴虚证患者。
实验发现与正常组相比,模型组心衰大鼠心肌细胞线粒体排列紊乱,形态不规则,呈肿胀、扭曲状。经参麦注射液治疗后,心肌线粒体排列恢复,形状相对规则,扭曲肿胀等情况改善,内外膜相对完整,表明参麦注射液可有效恢复心肌细胞中的线粒体结构。同时,AMPK明显降低,PPARα、PGC-1α明显上升(P<0.01),ATP含量上升、AMP含量下降(P<0.05),心肌细胞能量代谢逐渐恢复。上述结果反映,参麦注射液干预可有效恢复衰竭心脏的能量供应,从而改善心功能。
心脏正常的能量代谢是维持人体基本生理活动的基础[11],线粒体是细胞提供能量的主要部位,又被称为“动力室”[12]。线粒体不仅能够通过控制细胞内氧化磷酸化以及线粒体酶的水平来调节能量代谢,还能够储存钙离子,调节细胞凋亡[13]。心衰发生时,线粒体呼吸链受损使得活性氧大量产生,对线粒体产生冲击,加重线粒体结构的损伤。同时,活性氧还使钙离子运转机制异常,大量钙离子超容量地进入到线粒体中,导致线粒体形态上出现了肿胀扭曲,不仅结构受损,数量减少,功能更是被破坏[14-15],这一点与本实验结果一致。正常的心肌能量代谢,心肌细胞主要利用线粒体上的ATP进行直接供能,另外肌酸激酶能够催化磷酸肌酸,使其快速将磷酸这一种物质转移给ADP,由此途径生成ATP,从而促进ATP高水平的恢复,给心脏供能[16-17]。由此可见,在心脏能量产生以及利用的过程中,ATP等能量物质发挥着巨大的作用。当慢性心衰发生时,心肌细胞内的线粒体出现形态结构被破坏,线粒体内的ATP明显降低,供能量显著下降。此时体内的ADP与AMP通过氧化磷酸化的途径加快转化为ATP,企图逆转心脏的失代偿状态,本次研究结果亦印证这一结论。
AMPK是一种可以调节线粒体能量代谢的酶类,当细胞能量不够供应机体活动时被激活,而能量过剩时被抑制[18-20],是调节机体能量不足的重要手段。心脏能够适应性地利用所有各种类型的底物来满足高能量的需求,并根据环境变化严格调节底物的利用,是AMPK能对心衰能量代謝起到调节作用的基础[21]。当心衰发生时,受损的心肌产生的ATP不足以为机体提供所需的能量,此时AMP的含量以及AMP/ATP的值会上升,促使AMPK通路被激活。PPARα是AMPK下游靶分子,受AMPK的调控。心衰时,AMPK能够激活大量的酶抑制PPARα的合成,提高心肌对葡萄糖的利用率,为衰竭的心肌细胞增加能量的供应。PPARα同时还能通过增加线粒体的脂肪酶活性,促进ATP的产生,提高脂肪酸的利用率,起到抑制心衰的作用[22]。AMPK调节心肌能量代谢的途径,还包括通过调控PGC-1α实现。PGC-1α是一种转录调节辅激活因子,能够调节与线粒体有关的调节因子的表达,并且抑制葡萄糖氧化,增加心肌细胞对葡萄糖摄取,增加ATP的含量以调节心衰[23]。
综上所述,高血压心衰病理过程中伴有线粒体结构损伤和能量代谢障碍。参麦注射液可能是通过下调AMPK的蛋白表达,上调PPARα和PGC-1α的水平,改善能量代谢相关指标,有效恢复心肌细胞线粒体形态结构,为衰竭心脏供给更多能量,从而改善心功能。本研究从能量代谢角度初步揭示参麦注射液对高血压心衰的干预机制,在下一步研究中拟选取相关能量信号通路进行研究,通过研究能量相关路径的传导机制,从而寻找参麦注射液治疗高血压心衰的新靶点。
参考文献
[1] 李欣春,梁 昊,胡志希,等.高血压心衰大鼠证候本质及药物干预研究[J].湖南中医药大学学报,2018,38(8):853-857.
[2] 姚 涛.基于“心肾相关”理论探讨高血压心衰肾纤维化机制及以方测证干预研究[D].长沙:湖南中医药大学,2020.
[3] 周 瑶.基于TGF-β/Smad通路探讨高血压心衰心肌纤维化机制及“以方测证”干预[D].长沙:湖南中医药大学,2019.
[4] 钟森杰,李 静,李 琳,等.基于生物信息学探讨参麦注射液对高血压心力衰竭的干预机制[J].中医学报,2021,36(1):160-164.
[5] CHRISTOFARO D G D, CASONATTO J, VANDERLEI L C M,et al. Relationship between resting heart rate, blood pressure and pulse pressure in adolescents[J]. Arquivos brasileiros de cardiologia, 2017, 108(5): 405-410.
[6] 2014版《心衰诊疗指南》肯定NT-proBNP临床应用价值[J].中国心血管杂志,2014,19(4):320.
[7] MEIJERS W C, VELDE A R, BOER R A. Biomarkers in heart failure with preserved ejection fraction[J]. Netherlands Heart Journal, 2016, 24(4): 252-258.
[8] 卢永昕.高血压:从左室肥厚到心力衰竭[J].中华高血压杂志,2007,15(3):189-191.
[9] 王梦之,姚成增,贾美君,等.慢性心衰中医证候演变研究进展[J].光明中医,2016,31(19):2894-2897.
[10] 赵新先.中药注射剂学[M].广州:广东科技出版社,2000:583,635.
[11] BILSEN MVAN, SMEETS P J, GILDE A J, et al. Metabolic remodelling of the failing heart: The cardiac burn-out syndrome?[J]. Cardiovascular Research, 2004, 61(2): 218-226.
[12] MARRACHE S, DHAR S. The energy blocker inside the power house: Mitochondria targeted delivery of 3-bromopyruvate[J]. Chemical Science, 2015, 6(3): 1832-1845.
[13] SERASINGHE M N, CHIPUK J E. Mitochondrial fission in human diseases[J]. Handbook of Experimental Pharmacology, 2017, 240: 159-188.
[14] 向 阳,杨海燕,赵春生,等.基于线粒体心肌能量代谢探讨从“气”治疗慢性心力衰竭[J].中国民族民间医药,2021,30(2):5-8.
[15] MAACK C, B?HM M. Targeting mitochondrial oxidative stress in heart failure throttling the afterburner[J]. Journal of the American College of Cardiology, 2011, 58(1): 83-86.
[16] SPINDLER M, NIEBLER R, REMKES H, et al. Mitochondrial creatine kinase is critically necessary for normal myocardial high-energy phosphate metabolism[J]. American Journal of Physiology Heart and Circulatory Physiology, 2002, 283(2): H680-H687.
[17] 张勤芹,高 想,於 悦.中医药干预慢性心力衰竭能量代谢重构的研究进展[J].吉林中医药,2017,37(1):99-103.
[18] MENG R S, PEI Z H, ZHANG A X, et al. AMPK activation enhances PPARα activity to inhibit cardiac hypertrophy via ERK1/2 MAPK signaling pathway[J]. Archives of Biochemistry and Biophysics, 2011, 511(1/2): 1-7.
[19] KIM A S, MILLER E J, YOUNG L H. AMP-activated protein kinase: A core signalling pathway in the heart[J]. Acta Physiologica, 2009, 196(1): 37-53.
[20] LUO Z J, ZANG M W, GUO W. AMPK as a metabolic tumor suppressor: Control of metabolism and cell growth[J]. Future Oncology (London, England), 2010, 6(3): 457-470.
[21] SHAO D, TIAN R. Glucose transporters in cardiac metabolism and hypertrophy[J]. Comprehensive Physiology, 2015, 6(1): 331-351.
[22] 何遠利,安祯祥,杨蕊琳,等.心衰宁合剂对慢性心力衰竭大鼠心肌AMPK和PPARα的影响[J].中药新药与临床药理,2020,31(3): 287-293.
[23] 胡小磊,石建华,项 平.PGC-1α和能量代谢的关系[J].蚌埠医学院学报,2008,33(2):248-251.
