胃饥饿素在妊娠糖尿病患者外周血与脐带血中的表达及其对高糖所致胰岛B细胞凋亡及功能损伤的影响▲
2021-09-22勾宪飞陈晓燕许志新
曾 燕 勾宪飞 陈晓燕 许志新
(1 重庆市第七人民医院妇产科,重庆市 400069,电子邮箱:demeterpow@163.com;2 重庆市涪陵区妇幼保健院产科,重庆市 408000;3 重庆市中医院妇科,重庆市 400000;4 重庆医科大学基础医学院,重庆市 400016)
妊娠糖尿病(gestational diabetes mellitus,GDM)是一种常见的妊娠期并发症,影响全球约25%的孕妇[1-2]。GDM严重影响母婴健康,其不仅是胎儿致死率、致残率增高的重要原因,还增加孕妇发生子痫、产后大出血及难产等并发症或不良预后的风险[3]。此外,GDM患者及其子代远期更易发生2型糖尿病或肥胖等代谢紊乱疾病[4]。而在妊娠期间母体对胰岛素的敏感性会随着妊娠进展而逐渐降低,为维持正常的血糖水平,机体对胰岛素的需求量将显著增加[5],故母体的胰岛B细胞数量增多及功能增强,以分泌更多的胰岛素应对母体升高的血糖浓度[6-7]。因此,大量学者认为胰岛B细胞的数量减少及功能障碍与GDM的发生和发展密切相关[3,6-7]。
胃饥饿素是胃黏膜层α细胞分泌的一种内源性活性肽,由28个氨基酸组成,相对分子量为33 000,其作为生长激素促分泌素的内源性配体,能够显著刺激生长激素促分泌激素的释放[8]。既往大量研究证实,GDM患者体内的胃饥饿素表达显著降低,其可能与母体胰岛素抵抗的发生具有相关性[9-11],但胃饥饿素在GDM患者胎儿体内的表达情况及其对胰岛B细胞功能的影响却尚未明确。因此本研究通过观察胃饥饿素在GDM患者与正常妊娠孕产妇血清及其脐带血中的表达差异,分析胃饥饿素水平与GDM患者血糖、胰岛素代谢指标的相关性,并进一步探讨胃饥饿素对胰岛B细胞功能的影响,为阐明GDM及相关代谢疾病的发生和发展提供新的理论基础及实验室依据。
1 资料与方法
1.1 临床标本来源 选取2018年4月至2019年4月于重庆市第七人民医院妇产科住院分娩的50例GDM孕产妇(GDM组),并选取同时期正常妊娠的50例孕产妇作为对照组。GDM的诊断符合第9版《妇产科学》[12]中的相关标准,即在妊娠第24~28周空腹口服75 g葡萄糖进行OGTT,达到空腹血糖≥5.1 mmol/L、服糖后2 h血糖≥10.0 mmol/L、服糖后3 h血糖≥8.5 mmol/L中任意一项即可诊断为GDM。所有孕产妇均为单胎妊娠且经阴道分娩。排除合并心脑血管、肺、肝、肾等疾病者,合并甲状腺等内分泌疾病者及妊娠前确诊为糖尿病者。所有研究对象均签署知情同意书,本研究已通过我院医学伦理委员会审批。
1.2 细胞系及主要试剂 胰岛B细胞MIN6购自中国科学院上海细胞库。RPMI-1640、胎牛血清购自美国HyClone公司(批号:AD15505803、AD14201137);β-巯基乙醇、L-谷氨酰胺、青链霉素混合液均为100 U/mL购自美国Sigma公司(批号:EZ1300F509、EZ0415D216、EZ419F107);细胞计数检测(cell counting kit-8,CCK-8)试剂盒、膜联蛋白V-异硫氰酸荧光素(Annexin V-fluorescein isothiocyanate,Annexin V-FITC)/碘化丙啶凋亡检测试剂盒购自江苏碧云天(批号:D77041、D253071);大鼠抗小鼠胃饥饿素单克隆抗体、大鼠抗小鼠B细胞淋巴瘤-2相关X蛋白(B-cell lymphoma-2 associated X protein,Bax)单克隆抗体、人胃饥饿素酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒购自美国Abcam公司(批号:ab10953、ab07409、ab50121);兔抗小鼠活化型合半胱氨酸的天冬氨酸蛋白水解酶(cleaved cysteinyl aspartate specific proteinase,Cleaved-Caspase-3)单克隆抗体、大鼠抗小鼠甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)购自美国CST公司(批号:40718T、20933T);兔抗小鼠蛋白激酶B(protein kinase B,Akt)多克隆抗体,兔抗小鼠磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)多克隆抗体购自美国Selleckchem公司(批号:S1104、S1219);辣根过氧化物酶(hoseradish peroxidase,HRP)标记的山羊抗兔或抗大鼠IgG二抗购自武汉博士德(批号:AR1075);SYBR Premix Ex Taq试剂盒购自日本TaKaRa公司(批号:RR309AB);Opti-MEM购自美国Gibco公司(批号:30152-D417);TRIzol、二喹啉甲酸蛋白定量试剂盒购自美国Invitrogen公司(批号:129340、746286);小鼠胰岛素ELISA试剂盒(美国Andygene公司,批号:043-S5261B);其他试剂均为国产分析纯;胃饥饿素过表达慢病毒载体(LV-胃饥饿素)和阴性对照慢病毒载体(LV-NC)由上海凯基生物科技有限公司构建;PCR引物合成由生工生物工程(上海)股份有限公司完成。
1.3 实验方法
1.3.1 样本采集及血糖检测:所有研究对象均禁食8~10 h,于次日采集其肘静脉血5 mL,并于胎儿娩出且断脐后采集脐带血3 mL。将收集到的外周静脉血与脐带血于室温下2 200 r/min离心5 min,取上层血清,采用葡萄糖氧化酶法检测空腹血糖及脐带血葡萄糖水平,应用放射免疫法测定空腹胰岛素(fasting insulin,FINS)及脐带血胰岛素水平。计算稳态模型胰岛素抵抗(homeostasis model assessment of insulin resistance,HOMA-IR)指数,HOMA-IR指数=(空腹血糖×FINS)/22.5。常规测量两组研究对象产前身高及体重,并计算其体质指数,体质指数=体重(kg)/身高2(m2)。
1.3.2 外周血及脐带血胃饥饿素水平检测:按照ELISA试剂盒使用说明方法检测两组孕产妇外周血及脐带血血清中胃饥饿素表达水平。实验单独重复3次。
1.3.3 细胞培养、分组及慢病毒转染:(1)细胞培养。常规复苏胰岛B细胞MIN6后,使用含10%胎牛血清、1%青链霉素、100 μg/mL L-谷氨酰胺及5 μL/mL β-巯基乙醇的RPMI-1640培养液于37℃、5% CO2恒温培养箱进行培养。待MIN6细胞贴壁生长融合至80%时,使用0.25%的胰酶进行消化传代。(2)分组方法。将细胞分为7组进行实验。对照组,即正常培养且无任何特殊处理的MIN6细胞;LV-NC组,即正常培养的转染LV-NC的MIN6细胞(RPMI-1640葡萄糖浓度为5.0 mmol/L);LV-胃饥饿素组,即正常培养的转染LV-胃饥饿素的MIN6细胞(RPMI-1640葡萄糖浓度为5.0 mmol/L);高糖组,即采用葡萄糖浓度为20.0 mmol/L的培养液进行培养的MIN6细胞;高糖+LV-NC组,即采用高糖(葡萄糖浓度为20.0 mmol/L)培养液进行培养的转染LV-NC 24 h后的MIN6细胞;高糖+LV-胃饥饿素组,即采用高糖(葡萄糖浓度为20.0 mmol/L)培养液进行培养的感染LV-胃饥饿素慢病毒24 h后的MIN6细胞;高糖+LY294002组,即应用终浓度为25 μmol/L的磷脂酰基醇3-激酶(phosphoinositide 3-kinase,PI3K)抑制剂LY294002(美国Sigma公司,批号:EZ1018D031)10 μM进行预处理30 min后再经高糖(葡萄糖浓度为20.0 mmol/L)培养液培养的MIN6细胞。上述各组细胞置于37℃、5% CO2恒温培养箱中培养24 h后用于后续实验。(3)转染方法。转染前24 h,取处于对数生长期的MIN6细胞进行常规消化后计数,按1×105个/mL的细胞密度接种至6孔板中,并加入200 μL预先使用Opti-MEM稀释的慢病毒液(感染复数=30),同时加入12.5 μg终质量浓度为5 μg/mL的Polybrene(美国Sigma公司,批号:EZ7409A231),充分混匀后于37℃、5% CO2恒温培养箱中培养24 h,弃除原培养液,更换为上述新鲜培养液,继续原条件培养72 h后,用4 μg/mL的嘌呤霉素进行筛选10 d,取稳定感染后的细胞采用实时荧光PCR及蛋白质印迹法分别检测胃饥饿素mRNA及蛋白的表达。
1.3.4 CCK-8法检测细胞增殖能力:收集生长状态良好的待测MIN6细胞,常规消化细胞后接种至96孔板中,调整细胞密度至2×104个/孔,并向每孔加入200 μL含10%胎牛血清的RPMI-1640培养液,置于37℃、5% CO2恒温培养箱培养,分别于12 h、24 h、36 h、48 h时向每孔加入10 μL CCK-8试剂后继续原条件培养2 h,用酶标仪(美国Bio-Rad公司,型号:HBS-1101)检测每孔于490 nm处的吸光度值,每个时间点每组设置5个复孔,绘制细胞的生长曲线。
1.3.5 Annexin V-FITC法检测细胞凋亡情况:收集生长状态良好的待测MIN6细胞,2 200 r/min离心5 min,弃上清,使用4℃预冷的磷酸缓冲盐溶液洗涤细胞2次,2 min/次,按上述方法离心后收集细胞沉淀,用195 μL Annexin V-FITC结合液重悬细胞,并调整细胞密度至7×105个/mL。依次加入5 μL Annexin V-FITC及10 μL碘化丙啶染色液,轻轻摇晃离心管以充分混匀后,室温下避光孵育30 min。300目滤膜过滤细胞团块后,进行流式细胞仪(美国BD Bioscience公司,型号:FACSCalibur)检测细胞凋亡情况。实验单独重复3次。
1.3.6 胰岛素释放试验:取生长状态良好的对照组、LV-NC组与LV-胃饥饿素组的MIN6细胞,使用含低糖(3.3 mmol/L)或高糖(16.7 mmol/L)的RPMI-1640培养基于37℃、5% CO2细胞培养箱中分别进行处理1 h。取细胞培养上清液,3 400 r/min离心10 min后按照胰岛素ELISA试剂盒说明书检测上清液中的胰岛素含量。实验单独重复3次。
1.3.7 实时荧光定量PCR:取LV-胃饥饿素组、LV-NC组及对照组MIN6细胞,采用TRIzol法提取待测细胞总RNA,分光光度计检测纯度与浓度后,根据反转录试剂盒(美国Thermo公司,批号:01116837)说明书反转录为cDNA,反应体系:0.5 μg RNA模板,1 μL引物,4 μL 5×反应缓释液,1 μL RiboLock RNase抑制剂,2 μL 10 mM dNTP Mix,1 μL RevertAid M-MuLVRT,无RNA酶水补充至20 μL。再按照实时荧光PCR试剂说明书及预实验确定的反应时间与温度进行实时定量PCR,反应体系为:10 pmol引物、10 μL 2×Taq Master Mix、3 μL的cDNA模板和10 μL ddH2O,共25 μL体系。反应条件为95℃(10 min)预变性后,变性95℃(7 s)→退火60℃(20 s)→72℃(38 s),40个循环周期。胃饥饿素上游引物:5′-GCAGCAGCGGCTTCACA-3′,下游引物:5′-ACATCCAAACAGGAGCGTCAT-3′;GAPDH上游引物:5′-AGAAGGCTGGGGCTCATTTG-3′,下游引物:5′-AGGGGCCATCCACAGTCTTC-3′。 以GAPDH为内参,采用2-ΔΔCt法计算胃饥饿素 mRNA的相对表达水平。
1.3.8 蛋白质印迹实验:取方法1.3.3中的各组MIN6细胞,使用4℃预冷的磷酸缓冲盐溶液洗涤细胞3次,2 min/次,加入RIPA细胞裂解液及蛋白酶抑制剂提取细胞中总蛋白。采用二喹啉甲酸法进行蛋白定量,将蛋白样品加入5×上样缓冲液(体积比为1 ∶4),并于沸水中加热变性10 min。取30 μg的蛋白进行聚丙烯酰胺凝胶电泳以分离蛋白,采用湿转法将分离的蛋白转至聚偏二氟乙烯膜上,5%的脱脂奶粉于室温下封闭2 h后,分别加入Akt(1 ∶500)、p-Akt(1 ∶300)、Bax(1 ∶800)、Cleaved-Caspase-3(1 ∶800)、胃饥饿素(1 ∶500)、GAPDH(1 ∶1 500)一抗,4℃摇床孵育过夜。洗涤缓冲液清洗3次,5 min/次,以HRP标记的二抗(1 ∶5 000)室温孵育1 h,以洗涤缓冲液清洗3次,5 min/次。最后均匀滴加化学发光液发光液后,使用凝胶成像仪进行曝光拍照,Image J软件测定条带灰度值,以目标蛋白与内参GAPDH的比值作为其相对含量。以上实验单独重复3次。
1.4 统计学分析 采用SPSS 19.0和GraphPad Prism 5.0进行统计学分析,计量资料以(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;计数资料以例数或百分比表示,比较采用χ2检验。采用Spearman法分析胃饥饿素水平与相关检测指标间的相关性。以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组孕产妇的临床资料比较 两组孕产妇的年龄、分娩时孕周、产前血压、产前体质指数、胎盘质量、新生儿体重、新生儿性别比较,差异均无统计学意义(均P>0.05),而GDM组孕产妇的空腹血糖、FINS、HOMA-IR指数、脐带血葡萄糖、脐带血胰岛素、脐带血 HOMA-IR指数均高于对照组(均P<0.05),见表1。
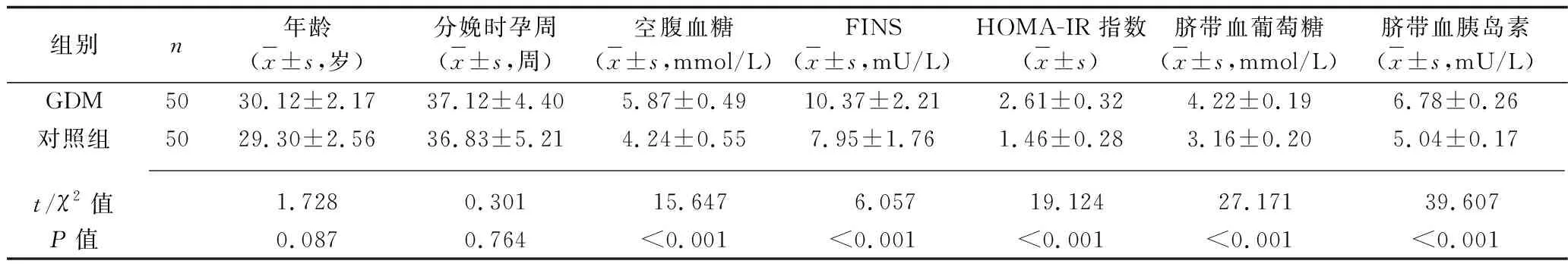
表1 两组孕产妇临床资料的比较
2.2 两组孕产妇外周血和脐带血胃饥饿素水平 GDM组外周血和脐带血胃饥饿素表达水平均低于对照组(P<0.05)。见表2。Spearman相关分析显示,对照组、GDM组孕产妇外周血胃饥饿素表达水平均与脐带血胃饥饿素表达水平呈正相关(rs=0.434,P<0.001;rs=0.628,P<0.001)。

表2 两组孕产妇外周血及脐带血胃饥饿素水平的比较(x±s,pg/mL)
2.3 GDM孕产妇外周血及脐带血胃饥饿素水平与糖代谢相关指标之间的相关性分析 Spearman相关分析显示,GDM孕产妇外周血胃饥饿素水平与空腹血糖、FINS及HOMA-IR指数均呈负相关(rs=-0.481,P<0.001;rs=-0.352,P=0.036;rs=-0.412,P<0.001),脐带血胃饥饿素水平亦与空腹血糖、FINS及HOMA-IR均呈负相关(rs=-0.602,P<0.001;rs=-0.317,P<0.001;rs=-0.289,P<0.001)。
2.4 慢病毒感染后胰岛B细胞胃饥饿素mRNA及蛋白的表达 与对照组相比,LV-胃饥饿素组细胞的胃饥饿素 mRNA与蛋白相对表达水平均增加(均P<0.05),而LV-NC组细胞的胃饥饿素mRNA与蛋白相对表达水平的变化均无统计学意义(均P>0.05),见表3及图1。
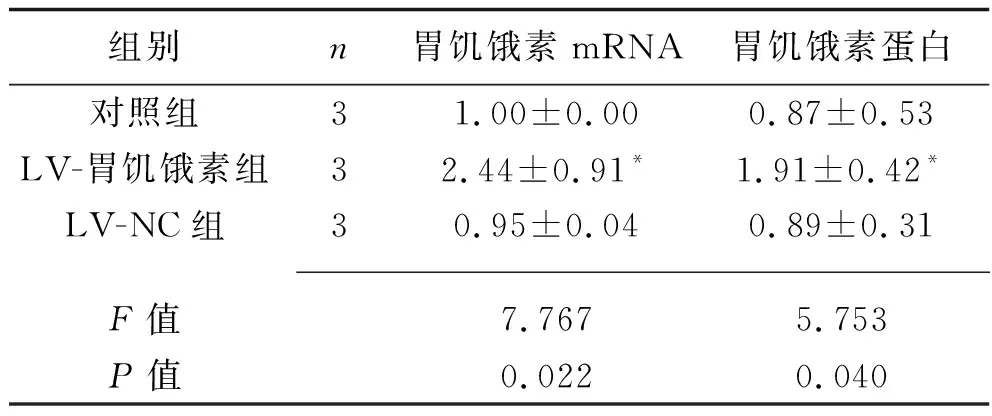
表3 3组胰岛B细胞胃饥饿素mRNA及蛋白的相对表达水平(x±s)
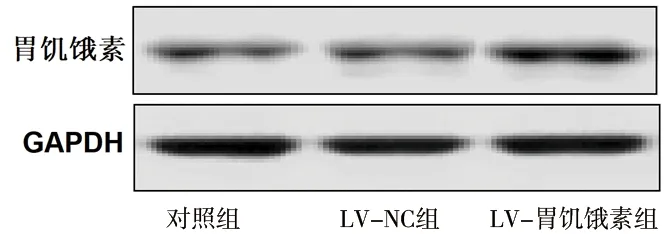
图1 3组胰岛B细胞中胃饥饿素蛋白的表达情况
2.5 过表达胃饥饿素对高糖诱导的胰岛B细胞增殖的影响 培养48 h时,与对照组相比,高糖组、高糖+LV-NC组及高糖+LV-胃饥饿素组胰岛B细胞增殖能力均降低(P<0.05);而与高糖组相比,高糖+LV-胃饥饿素组胰岛B细胞增殖能力增强(P<0.05),高糖+LV-NC组的细胞增殖能力变化无统计学意义(P>0.05)。见表4。
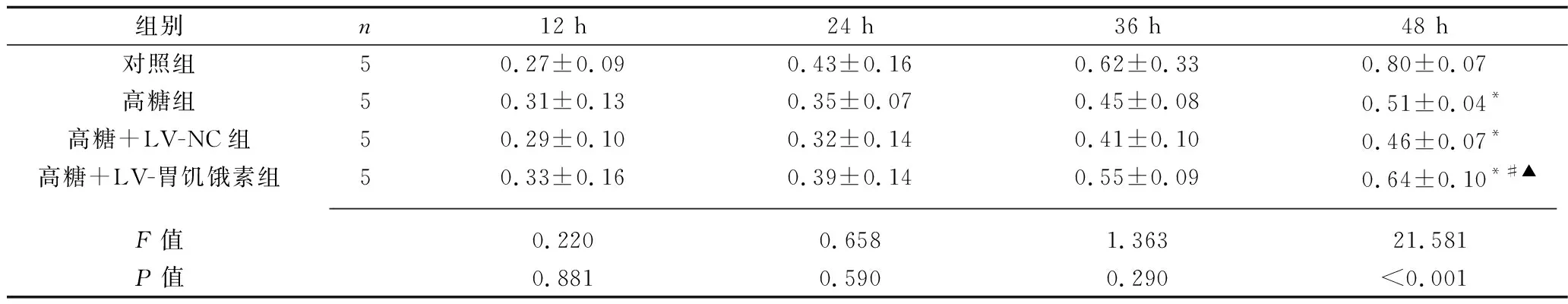
表4 4组胰岛B细胞增殖能力的比较(x±s,吸光度值)
2.6 过表达胃饥饿素对高糖诱导的胰岛B细胞凋亡的影响 与对照组相比,高糖组、高糖+LV-NC组及高糖+LV-胃饥饿素组胰岛B细胞的凋亡率均降低(P<0.05);而与高糖组相比,高糖+LV-胃饥饿素组胰岛B细胞的凋亡率降低(P<0.05),高糖+LV-NC组的细胞凋亡率变化无统计学意义(P>0.05),见表5及图2。

表5 4组胰岛B细胞凋亡率的比较(x±s,%)
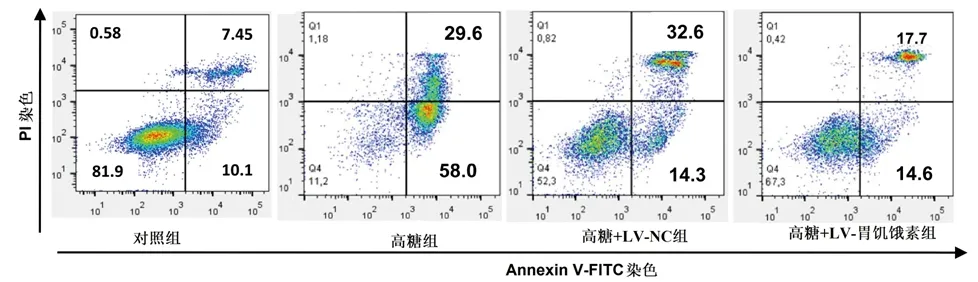
图2 4组胰岛B细胞的凋亡情况
2.7 过表达胃饥饿素对胰岛B细胞胰岛素分泌功能的影响 在低糖的条件下,低糖+LV-胃饥饿素组的胰岛素释放能力较低糖组明显增加(P<0.05),而低糖+LV-NC组无明显改变(P>0.05);在高糖的条件下,高糖+LV-胃饥饿素组的胰岛素释放能力亦较高糖组明显增加(P<0.05),而高糖+LV-NC组与高糖组差异无统计学意义(P>0.05),见表6。

表6 各组胰岛B细胞胰岛素含量(x±s,μg/mL)
2.8 过表达胃饥饿素对高糖条件下胰岛B细胞中PI3K/Akt信号通路表达的影响 与对照组相比,高糖组、高糖+LV-NC组、高糖+LV-胃饥饿素组及高糖+LY294002组胰岛B细胞的p-Akt/Akt蛋白比值(Akt磷酸化水平)降低,而Bax及Cleaved-Caspase-3蛋白相对表达水平增加(P<0.05);与高糖组、高糖+LV-NC组和高糖+LY294002组相比,高糖+LV-胃饥饿素组胰岛B细胞的Akt磷酸化水平增加,Bax及Cleaved-Caspase-3蛋白相对表达水平降低(P<0.05),见表7及图3。
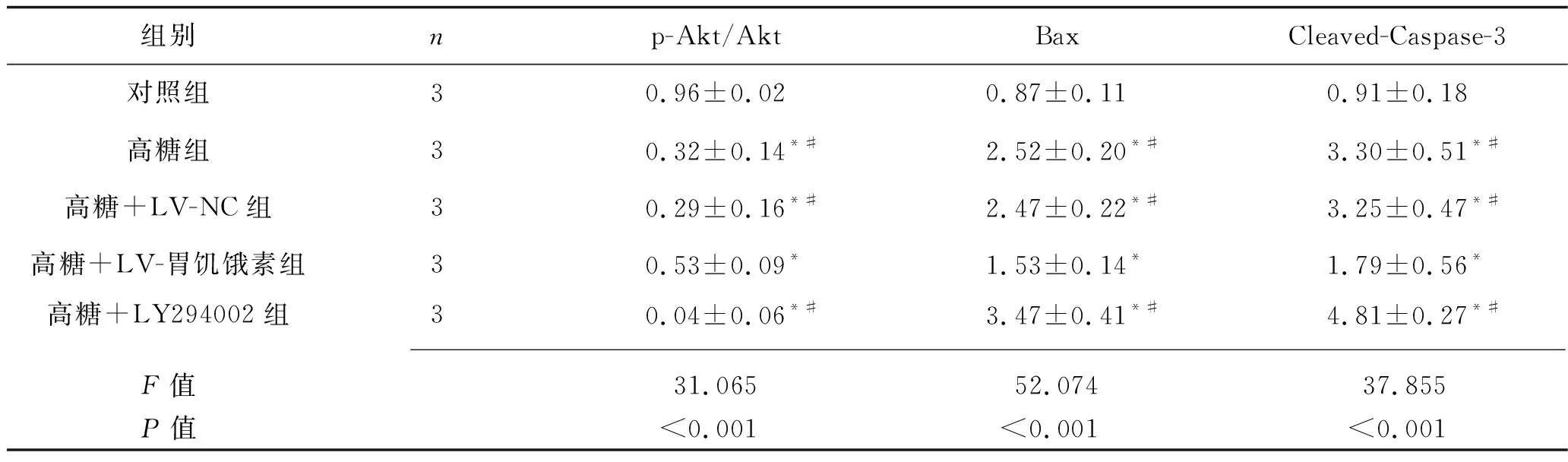
表7 胰岛B细胞PI3K/Akt信号通路相关蛋白相对表达水平的比较(x±s)
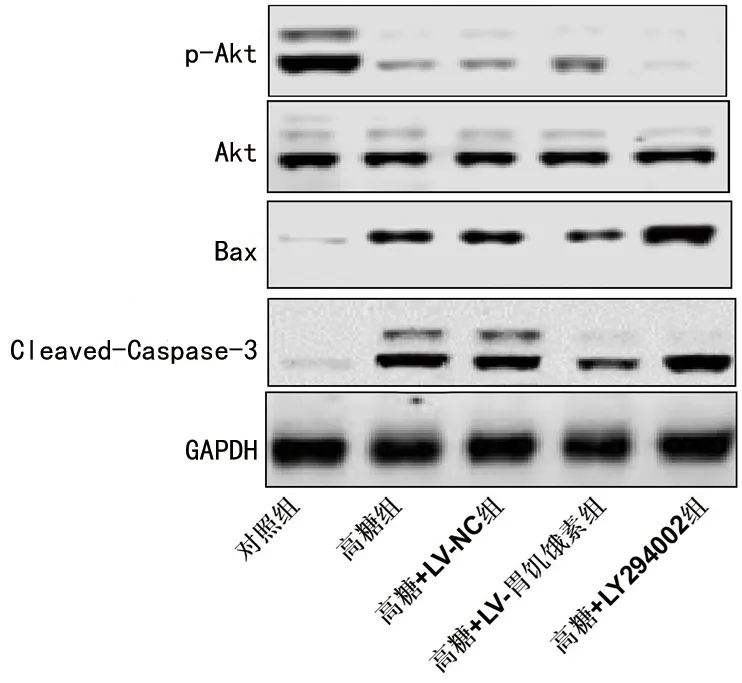
图3 各组胰岛B细胞PI3K/Akt信号通路相关蛋白的表达情况
3 讨 论
近年来,胃饥饿素作为既往具有GDM病史患者发生2型糖尿病的重要危险因素而逐渐得到重视[13]。胃饥饿素是主要由人体胃肠消化系统分泌的一种生物性多肽,其在下丘脑、心脏、胰腺细胞、肺及胎盘组织等其他组织中也有少量表达[14-16]。在体内,胃饥饿素作为一种促进食欲的多肽,不仅能够促进食物的摄入和体重的增加,还能控制能量的代谢和胰岛素的分泌,因此胃饥饿素在胰岛素抵抗、肥胖及糖尿病等胰岛素相关疾病的发生中具有重要作用[17-18]。而关于胃饥饿素与GDM的关系,既往大量研究已证实,GDM患者血清及胎盘组织中胃饥饿素的表达显著降低,且胃饥饿素水平与GDM患者的血糖、三酰甘油等糖脂代谢指标及HOMA-IR指数呈负相关[9-11],但目前关于胃饥饿素在GDM患者脐带血中表达的研究甚少。
本研究结果显示,GDM组外周血、脐带血胃饥饿素表达水平均低于对照组(P<0.05),提示胃饥饿素可能参与GDM的发生,这与既往研究结果[10-11,19]相似。此外,对照组、GDM组孕产妇外周血胃饥饿素表达水平均与脐带血胃饥饿素表达水平呈正相关(P<0.05),这说明妊娠母体胃饥饿素水平变化可能影响胎儿体内胃饥饿素的表达。进一步分析胃饥饿素与糖代谢指标的相关性,结果显示GDM孕产妇外周血、脐带血中的胃饥饿素表达水平均与其空腹血糖水平、胰岛素水平及HOMA-IR指数呈负相关(P<0.05),这表明胃饥饿素可能参与GDM患者及其胎儿的胰岛素抵抗,且能影响两者的血糖代谢过程。
研究显示,胰岛B细胞的数量减少及功能障碍与胰岛素抵抗、GDM、糖尿病等代谢相关性疾病的发生和发展具有密切关系[3,6-7]。因此,本研究通过体外培养胰岛B细胞MIN6,并通过慢病毒载体转染以过表达胃饥饿素,从而进一步明确高糖环境下过表达胃饥饿素对胰岛B细胞功能的影响。结果显示,与对照组相比,LV-胃饥饿素组细胞的胃饥饿素mRNA与蛋白表达水平均增加(P<0.05),说明成功建立了过表达胃饥饿素的胰岛B细胞系。经高糖干预,高糖组的细胞增殖受到抑制,而凋亡率升高(P<0.05);但与高糖组相比,高糖+LV-胃饥饿素组胰岛B细胞增殖能力增强,凋亡率降低(P<0.05)。这提示过表达胃饥饿素能够明显减轻高糖对胰岛B细胞增殖能力的抑制及促凋亡作用。此外,ELISA检测显示,在低糖或高糖条件下,过表达胃饥饿素的细胞的胰岛素释放能力均较低糖组或高糖组明显增加(P<0.05),提示无论在低糖或高糖环境中,过表达胃饥饿素均能促进胰岛B细胞分泌胰岛素。上述实验结果表明,过表达胃饥饿素能够改善高糖环境对胰岛B细胞的功能损伤。
PI3K/Akt信号通路是与糖代谢密切相关的信号传导途径之一,该信号通路在胰岛B细胞的生长、代谢、增殖、凋亡等过程中发挥重要的作用[20-21]。Akt是表达于多种组织及细胞中的一种丝/苏氨酸激酶,有研究显示Akt经磷酸化激活后有助于胰岛B细胞抵抗糖脂毒性的损伤[22]。此外,有学者发现,脂肪酸能够通过抑制Akt的磷酸化水平诱导胰岛B细胞发生凋亡[23]。Bax是分布于细胞质的重要促凋亡蛋白,其在接受上游传导的凋亡信号后被激活并发生分子构象的改变,随即诱发细胞的一系列改变,促进细胞凋亡。凋亡蛋白酶Caspase-3是各种凋亡途径的枢纽分子,也是细胞凋亡的指示剂,它的激活提示细胞已进入凋亡早期并最终发生细胞死亡[24]。本研究结果显示,与高糖组与高糖+LV-NC组、高糖+LY294002X组相比,高糖+LV-胃饥饿素组胰岛B细胞的Akt磷酸化水平增高,Bax及Cleaved-Caspase-3蛋白表达水平降低(P<0.05),提示过表达胃饥饿素能够显著促进高糖环境中胰岛B细胞的Akt磷酸化水平,并下调凋亡相关蛋白Bax与Cleaved-Caspase-3的表达;而预先使用LY294002处理细胞后,胰岛B细胞中Akt磷酸化水平的抑制作用更为显著,故凋亡相关蛋白Bax及Cleaved-Caspase-3蛋白表达水平出现明显升高,这进一步提示促进PI3K/Akt信号通路的表达能有效保护胰岛B细胞。
综上所述,在GDM患者外周血及脐带血中胃饥饿素表达均降低,且其与血糖水平和胰岛素抵抗密切相关。过表达胃饥饿素能够通过促进PI3K/Akt信号通路的活化来改善高糖所致的胰岛B细胞损伤及功能障碍。
