冠状动脉粥样硬化性心脏病患者心外膜脂肪组织和皮下脂肪组织之间差异表达基因的生物信息学分析▲
2021-09-22刘雪玲莫秋艳王金花王庆高傅叶叶苏虹月
连 溯 刘雪玲 莫秋艳 王金花 王庆高 傅叶叶 苏虹月
(广西中医药大学第一附属医院超声科,南宁市 530023,电子邮箱:271857173@qq.com)
冠状动脉粥样硬化性心脏病(coronary atherosclerotic heart disease,CAD)是全球最常见的心脏病之一,以进行性冠状动脉粥样硬化闭塞为特征,患者心肌供需不匹配,严重时可出现心肌梗死、心力衰竭,甚至死亡[1]。脂肪由脂肪源性干细胞、前脂肪细胞、内皮细胞和白细胞组成,可分泌上百种生物活性成分,包括瘦素、脂联素、脂肪酶、补体或细胞因子(例如肿瘤坏死因子、趋化因子等)[2-3]。根据旁分泌特征不同可将脂肪分为皮下脂肪和内脏脂肪两类。心外膜脂肪组织(epicardial adipose tissue,EAT)是内脏脂肪的一种,位于心肌和心包脏层之间,与心肌直接接触,由冠状动脉分支供血,并围绕冠状动脉下行至心尖,参与小血管和微血管管壁的构成。EAT与心肌或冠状动脉壁可通过细胞、代谢物或信号分子直接进行串扰[4]。EAT可以防止高水平的循环游离脂肪酸对心肌和冠状动脉产生毒性作用,也可以促进心肌和冠状血管的局部炎症反应[5]。相较于被心肌包围的节段(中部分支和心肌桥下),冠状动脉粥样硬化更可能发生在被 EAT 包围的节段中[6]。有学者发现,实验性去除血管周围的EAT,可阻止猪冠状动脉粥样硬化的进一步发展[7]。还有研究显示,EAT炎症与冠状动脉痉挛之间存在明显的关联,提示冠状动脉与EAT之间具有潜在的相互作用[8]。但目前关于EAT参与CAD的机制尚未完全明确。本研究基于两个独立的微阵列数据库对EAT和皮下脂肪组织的差异表达基因进行分析,探讨EAT参与CAD发展的分子机制,为寻找新的CAD生物标志物及制定新的治疗策略提供参考。
1 材料与方法
1.1 数据来源 通过GEO数据库(https://www.ncbi.nlm.nih.gov/geo/),查找并筛选出已接受冠状动脉旁路移植术的CAD患者,同时具有EAT和皮下脂肪组织的转录组测序数据及表达矩阵的2个数据集:GSE24425和GSE64554。GSE24425使用Illumina Human WG-6 V3.0芯片,包含6个成对的EAT和皮下脂肪组织样本。GSE64554使用Illumina Human HT-12 V3.0芯片,包含13个成对的EAT和皮下脂肪组织样本。需要使用R语言软件(http://www.r-project.org/)对数据进行归一化的线性处理,以确保数据集的完整性和可比性。
1.2 差异表达基因的筛选 应用R语言环境的“edgeR”包对数据集GSE24425、GSE64554中CAD患者EAT与皮下脂肪组织之间的差异表达基因进行筛选。差异表达基因需同时满足以下条件:(1)∣log2倍数变化∣>2;(2)P<0.05。
1.3 差异表达基因的生物信息学分析 采用Metascape在线数据库(https://metascape.org)对差异表达基因进行基因本体论(Gene Ontology,GO)分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。最小富集度设定为1.5,P<0.05,最小计数为3。
1.4 差异表达基因的相互作用分析 将差异表达基因导入在线数据库Metascape,数据库内置STRING6(http://www.stringdb.org/)、BioGrid7(http://thebiogrid.org/)、OmniPath8(http://omnipathdb.org/)和InWeb/u IM9(http://www.inweb.org.br/),构建CAD患者心包脂肪差异表达基因蛋白-蛋白相互作用(protein-protein interaction,PPI)网络,设定条件为STRING的物理相互作用评分>0.187。结果网络中差异表达基因两两之间的联系节点≥1。运用Cytoscape 3.1.2软件进行可视化分析,使用软件中的插入式分子复合物检测(MCODE插件,使用默认参数,最小网络节点设置为3)筛选出PPI网络中的枢纽模块和关键基因,然后对关键基因进行GO分析。
1.5 与关键基因相关的微小RNA的预测 利用在线预测工具微小RNA(microRNA,miRNA)数据集成门户网站mirDIP(http://ophid.utoronto.ca/)对潜在的miRNA进行靶向预测。提交筛选出的关键基因,选择每种基因的前3个预测miRNA,同时,采用miRBase数据库(http://www.mirbase.org)验证关键模块基因与预测miRNA的相关性。
2 结 果
2.1 差异表达基因的筛选结果 对数据集GSE24425、GSE64554进行筛选,共得到179个差异表达基因,其中,下调基因92个,上调基因87个。取两个数据集的交集后,得到76个差异表达基因,其中上调基因41个,下调基因35个。见图1、图2。

图1 差异表达基因的分布火山图

图2 数据集GSE24425、GSE64554的交集基因
2.2 差异表达基因的GO富集分析 41个上调基因主要与嗜酸性粒细胞(eosinophil,EOS)趋化性、细胞对脂质的反应、后脑发育、细胞外基质等生物学过程有关;而35个下调基因主要与胚胎骨骼系统发育、细胞外基质、上皮管形态发生、上皮细胞分化等生物学过程有关,见表1。

表1 差异表达基因的GO富集过程图
2.3 差异表达基因KEGG富集分析 76个差异表达基因主要参与细胞因子-细胞因子受体相互作用、朊病毒病、精氨酸和脯氨酸代谢信号通路,见表2。
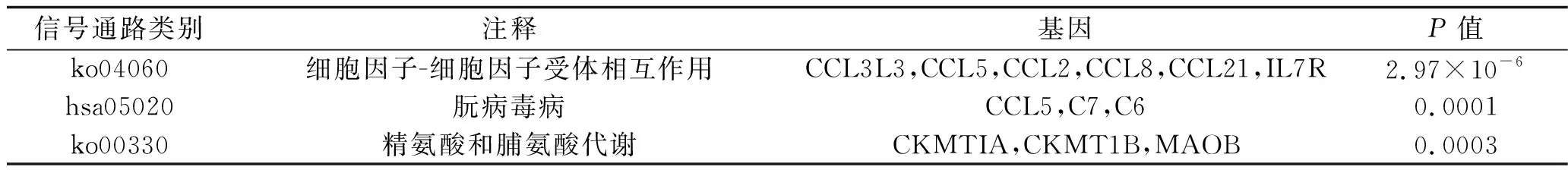
表2 差异表达基因的通路注释结果
2.4 差异表达基因PPI网络的构建与分析 采用Metascape在线工具内置的STRING构建PPI网络,采用Cytoscape 3.1.2软件进行可视化分析,结果如图3、图4所示。采用MCODE插件分析获得的最显著的相互作用模块,结果共得出10个关键基因,其中,上调基因中的关键基因有CC基序趋化因子配体(C-C motif chemokine ligand,CCL)2、CCL5、CCL8、CCL21、早期生长反应蛋白2(early growth response 2,EGR2)和白细胞介素7受体(interleukin 7 receptor,IL-7R),见图5;下调基因中的关键模块基因有同源异型盒(homeobox,HOX)A5、HOXB5、HOXB7、HOXC8,见图6。关键上调基因与EOS趋化性、EOS迁移和趋化因子受体结合生物学过程相关;关键下调基因与胚胎骨骼系统形态发生、胚胎骨骼系统发育和前/后模式规范生物学过程相关,见表3。
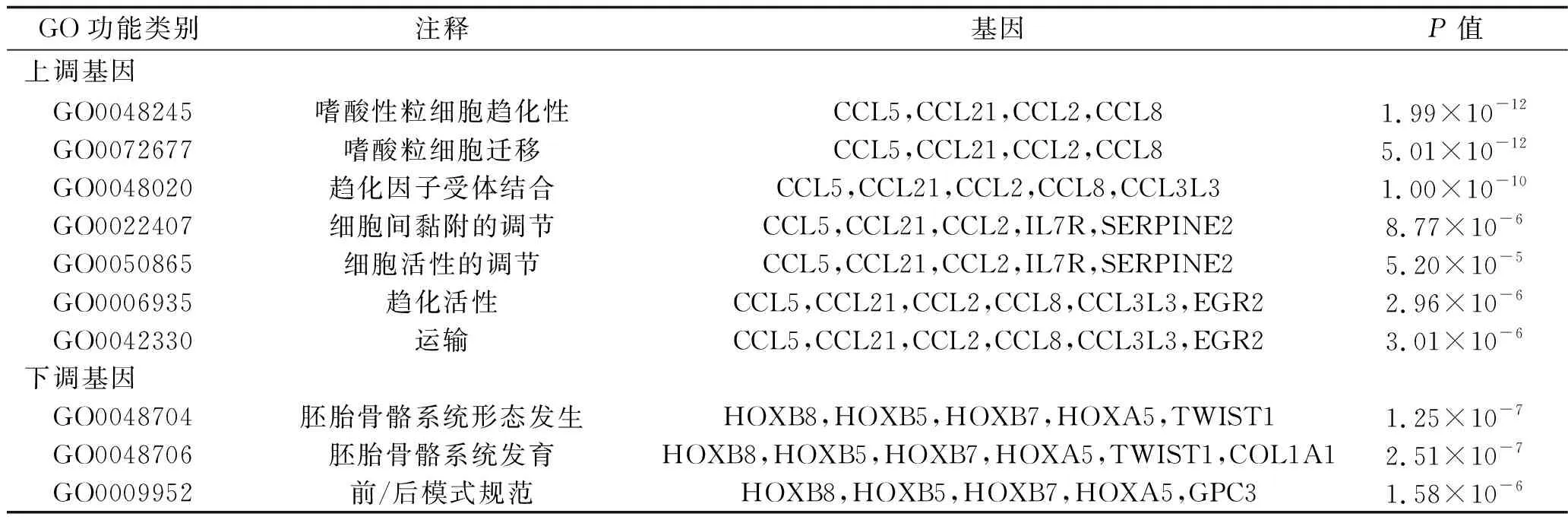
表3 关键基因GO富集

图3 上调基因PPI网络图 图4 下调基因PPI网络图
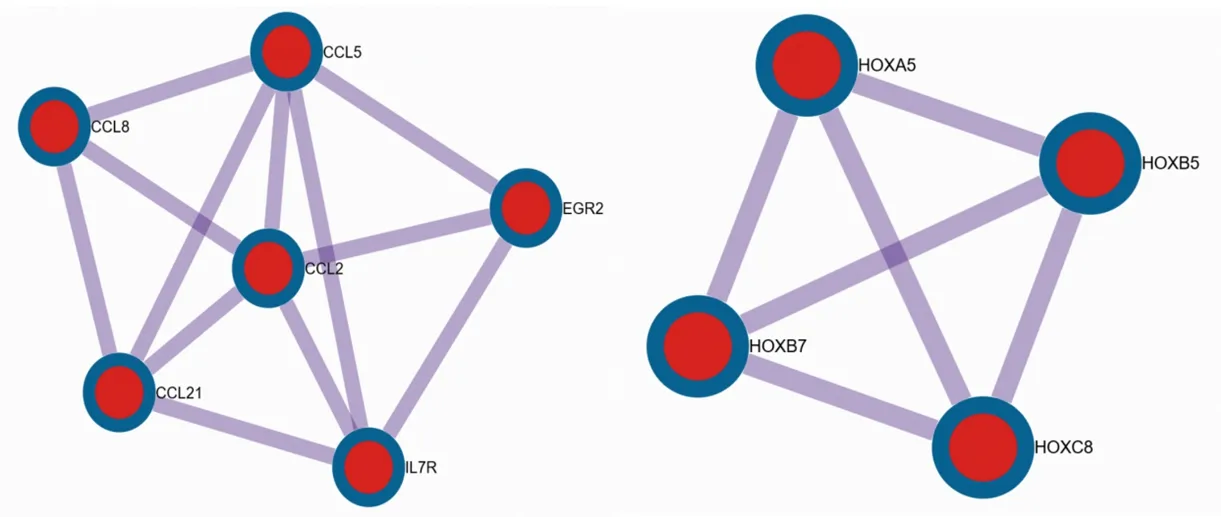
图5 上调基因关键模块图 图6 下调基因关键模块图
2.5 miRNA预测结果 hsa-miRNA-196a-5p和hsa-miRNA-196b-5p均与HOXA5、HOXB7、HOXC8高度相关。见表4。

表4 关键基因的前3个预测miRNA
3 讨 论
本研究通过生物信息学分析方法,从GSE24425、GSE64554芯片中筛选出CAD患者的心包脂肪组织和皮下脂肪组织之间的差异表达基因共179个,取两个数据集的交集后,获得上调基因41个,下调基因35个。通过构建PPI网络,获得2个关键模块共10个关键基因:CCL2、CCL5、CCL8、CCL21、EGR2、IL-7R、HOXA5、HOXB5、HOXB7、HOXC8。通过预测与关键基因相关的miRNA,发现hsa-miR-196a-5p和hsa-miR-196b-5p均与HOXA5、HOXB7、HOXC8高度相关。
CAD的发生是多因素共同作用的复杂过程,包括动脉粥样硬化、血栓形成、冠状动脉痉挛等,其最重要的病理基础为动脉粥样硬化。动脉粥样硬化以动脉壁内的慢性炎症性反应为特征,表现为脂质、细胞外基质和细胞的聚集并浸润血管壁。趋化因子是相对分子量介于8 000~12 000之间的蛋白质,介导细胞运动(趋化性)、白细胞脱粒和血管生成[9]。趋化因子序列高度保守,具有相似的结构,一般由N端Loop区、3个反向平行的β折叠和1个碳端α螺旋组成[10]。根据N端半胱氨酸残基的数量和位置,将其分为4个趋化因子亚家族:C、CC、CXC和CX3C。CCL2、CCL5、CCL8和CCL21均属于趋化因子CC亚家族。一种趋化因子可以结合多种趋化因子受体,反之亦然,它们相互作用构成了复杂的趋化因子调控网络,趋化因子及其受体协调免疫细胞的活化、募集和浸润,以及随后的炎症表型变化。因此,在CAD发生和发展的各个阶段中,趋化因子及其受体是以网络形式而不是单个细胞因子形式起作用。本研究中,GO富集结果显示,上调基因CCL2、CCL5、CCL8和CCL21大量存在于细胞外基质中,这或可增强嗜酸性粒细胞趋化性,介导嗜酸性粒细胞的迁移,并通过趋化因子-趋化因子受体结合作用参与CAD。
CCL2可与CC趋化因子受体(C-C motif chemokine receptor,CCR)1结合,与慢性促炎状态相关[11-12]。CCL2还可刺激内皮细胞与CCR的相互作用[13],并在动脉粥样硬化斑块中大量表达[14]。有学者发现,动脉粥样硬化患者的血清CCL2水平与冠状动脉钙化有关[15];与CCL2低水平表达的患者相比,血清CCL2高水平表达的CAD患者的冠状动脉斑块更不稳定,因此CCL2水平是预测高危冠状动脉斑块的血清学指标[16]。最近有研究显示, CCL2 被以昼夜节律方式振荡的髓样细胞有节奏地释放到动脉内皮中[17],基于该研究结果提出的 “慢性药理学治疗策略”,针对动脉粥样硬化性髓样细胞作用的峰值,强调将复杂的手术安排在CCL2释放量较少的时间进行。
CCL5能结合CCR1、CCR3和CCR5等多种受体[18]。研究显示,血小板衍生的CCL5沉积在活化的内皮细胞上可引起单核细胞停滞,从而在动脉粥样硬化病变的发展中具有关键作用[19];其还可促进单核细胞在内皮上停滞以及免疫细胞浸润到病变中,从而促进动脉粥样硬化的形成[20-21]。CCL5水平升高与较大的动脉粥样硬化病变有关[22-23]。尽管CCL5在动脉粥样硬化斑块的形成和失稳过程中具有重要作用,但其在CAD发生、发展中的作用仍存在争议。例如,在Versteylen等[22]的研究结果显示,与狭窄程度小于50%的患者相比,阻塞性CAD患者的CCL5显著升高。Kong等[23]的研究却表明,动脉粥样硬化病变进展较轻的CAD患者的CCL5浓度更高。
CCL8主要来源于巨噬细胞,主要与CCR1、CCR2、CCR3、CCR5和CCR8结合发挥作用[24]。目前关于CCL8在心脏疾病中的作用研究较少。Dai等[25]的体外细胞实验表明,经血小板衍生生长因子-BB刺激后人主动脉平滑肌细胞(human aortic smooth muscle cell,HASMC)中CCL8的表达上调,表达上调的CCL8又可促进血小板衍生生长因子-BB增殖和迁移,并通过调节HASMC中关键分子的表达来加速细胞周期和表型的转换,将正常静止状态下的收缩表型转变成为具有强大增殖和迁移能力的促炎表型,而沉默CCL8具有相反的作用,这表明CCL8可能是动脉粥样硬化的治疗靶标。
CCL21和CCL19共享相同的受体CCR7,与正常人相比,颈动脉粥样硬化患者血浆中的CCL19和CCL21水平上调[26]。体外实验表明,CCL21具有促进巨噬细胞脂质蓄积的作用,或可直接促进动脉粥样硬化的发展[27]。急性心肌梗死动物模型的循环CCL21水平和心脏CCR7的水平升高,通过静脉注射抗CCL21单克隆抗体中和CCL21可减少急性心肌梗死后的梗死面积,降低急性心肌梗死后血清中性粒细胞和单核细胞化学引诱剂的水平,抑制梗死心肌中中性粒细胞和巨噬细胞的募集,且抗CCL21治疗也可缓解心脏扩大并改善左心室功能,由此推测CCL21参与了急性心肌梗死后的心脏重塑[28]。
针对CAD中趋化因子及其受体作用机制的研究绝大多数定位于巨噬细胞、中性粒细胞和淋巴细胞介导的经典炎症途径,而探讨EOS介导的过敏性炎症途径的研究较少。既往研究表明EOS可能具有促炎和促凝血的功能[29],其能够产生活性氧,诱导内皮损伤和血小板活化,从而促进血栓形成,并增强冠状动脉血管收缩[30]。血清EOS浓度升高可能与心壁血栓和栓塞事件有关[31],是冠状动脉疾病患者危险分层的新生物标志物[32]。此外,嗜酸性粒细胞阳离子蛋白(eosinophil cationic protein,ECP)是EOS的活化标志物,较高的血清ECP水平与置入药物洗脱支架和裸金属支架患者的不良预后有关[33]。而有研究显示,药物洗脱支架的EOS浸润浓度比裸金属支架更高,且药物洗脱支架植入后6周的EOS总数是支架内再狭窄发生的唯一预测因子,这表明经皮冠状动脉介入术治疗后患者对药物洗脱支架的免疫敏感性反应与支架内再狭窄的发生存在关联[34]。因此,EOS介导的过敏性炎症途径在CAD发生、发展中的作用值得进一步探讨。结合本研究结果,CAD患者EAT中的CCL2、CCL5、CCL8和CCL21表达上调,其通过与CCR结合增强细胞对脂质的反应,并可能通过促进免疫细胞激活和聚集,参与粥样硬化斑块的形成;同时,这些因子可增强嗜酸性粒细胞的迁移和趋化,通过过敏性炎症途径,增强冠状动脉收缩,促进血栓生成,参与CAD的发展并影响治疗后的转归。
白细胞介素7受体(interleukin 7 receptor,IL-7R)的生物学效应主要通过与白细胞介素7(interleukin 7,IL-7)相结合来完成。IL-7/IL-7R 对骨髓、胸腺的中枢性T淋巴细胞、B淋巴细胞的发育和成熟具有重要作用,并可上调抗凋亡蛋白,下调促凋亡蛋白,抑制已分化和激活的T淋巴细胞凋亡[35]。结合本研究关键基因的富集分析结果,IL-7R与细胞间黏附的调节和细胞活性的调节相关,因此,IL-7R可能通过调节淋巴细胞的黏附和免疫活性来参与CAD的发生、发展。EGR2是EGR家族中的一员,目前,人们对于EGR家族的认识主要集中在调控神经功能可塑性方面。EGR2可反式调控细胞的增殖、分化、凋亡及转移等生物学行为[36],在周围神经髓鞘形成、T淋巴细胞成熟、后脑分割和脂质生物合成中起重要作用[37]。本研究的关键基因富集结果提示EGR2具有运输和趋化作用,因此我们认为,EGR2可能是趋化因子的活性调节和定向黏附基因。尽管关于IL-7及其受体信号途径在病毒感染、骨髓移植、免疫重建中作用的研究,以及EGR2在大脑神经发育等领域中的研究均较多,但两者在心脏领域中的研究几乎均为空白,今后需开展相关研究探讨两者在心脏领域中的作用。
HOX由180个核苷酸构成,其碱基顺序和在染色体中的位置高度保守,通过其同源域识别并结合特异的DNA序列[38-39]。HOX基因在不同的染色体上成簇排列又称HOX基因簇。哺乳动物共有39个HOX基因,按结构划分为4簇,即HOXA、HOXB、HOXC、HOXD;根据序列同源性及其在簇中的相对位置,HOX又分为13个旁系同源基因组,它们在蛋白质结构和表达模式上具有相似性[40]。 HOX基因编码的转录因子可以调节目标基因的表达,以及早期胚胎发育过程中脂肪组织和心血管系统等多种结构和器官的形成和发育;出生后HOX基因仍持续表达,参与维持血管壁的完整性、体内平衡和破坏后的血管重塑。研究表明,在正常人群中,与皮下脂肪相比,内脏脂肪中HOXA5高表达[41]。有学者发现在高脂饮食诱导的肥胖小鼠脂肪组织中HOXA5的表达降低[42]。还有类似的研究表明,高脂饮食小鼠脂肪组织中的HOXA5基因高度甲基化,使HOXA5 mRNA和蛋白表达下调,而恢复标准饮食两个月后,小鼠体重减轻,HOXA5甲基化和mRNA水平几乎完全恢复正常[43]。本研究中,HOXA5在CAD患者EAT中呈低表达,与肥胖状态下内脏脂肪组织的HOXA5的表达类似[44]。肥胖是公认的CAD的危险因素之一,因此,我们认为CAD患者保持健康的生活方式并关注其肥胖程度,可能有助于HOXA5表达恢复正常水平,但这需要进一步研究。同时,HOX基因参与维持血管壁的完整性、体内平衡,以及破坏后的血管重塑,在血管床的不同部位其表达有所不同。HOX基因可通过表观遗传机制调节血管壁干细胞向血管平滑肌细胞分化,而血管壁干细胞的失调在动脉粥样硬化和新内膜斑块形成中起重要作用[45-46]。这可能是某些部位更容易发生粥样硬化的原因之一。
此外,较高的生理性剪切应力具有保护性,在动脉的分支和弯曲处,容易出现血流紊乱的血流模式进而产生低剪切应力。研究表明,在血流紊乱的情况下,HOXA5的启动子在小鼠主动脉中高度甲基化(即转录被抑制),这种HOXA5过度甲基化可激活血管内皮细胞炎症表型从而导致炎症增加[47]。Jiang等[48]的研究结果也显示,HOXA5在猪主动脉的紊流区域中被甲基化。有学者指出,HOX基因在主动脉中的表达模式是由胚胎模式中建立的“HOX代码”决定,具有指定位置同一性的保守特点,“HOX代码”失调时,会促进动脉粥样硬化的发展[49]。本研究中,除HOXA5基因外,HOXB5、HOXB7和HOXC8这3个关键基因在CAD的EAT中表达下调。既往研究中,上述基因被证实是预测癌症预后的生物标志物和治疗靶标,包括胰腺癌[50]、皮肤鳞状细胞癌[51]、卵巢癌[52]等,但其在CAD中的作用却少有研究。然而,由于 HOX 在调节Wnt信号通路、抑制转化生长因子、丝裂原活化蛋白激酶、磷脂酰肌醇3-激酶/蛋白激酶B、核因子κB、Notch、缺氧诱导因子1、扭体家族bHLH转录因子1等多种信号通路中具有重要功能[46]。因此,我们认为HOX基因的下调可以抑制保护性脂肪细胞因子的转录、促发成年人动脉振荡血流区域的动脉粥样硬化,进而在CAD的病理生理过程中发挥重要作用。
本研究采用在线工具预测与关键模块基因相关的miRNA,在这些 miRNA 中,hsa-miRNA-196a-5p和hsa-miRNA-196b-5p与下调关键基因HOXA5、HOXB7和HOXC8均高度相关。目前有研究表明,hsa-miRNA-196a/b可直接或间接调控人臀部脂肪组织中HOX基因的表达,HOXA5在hsa-miRNA-196a的调节下抑制胃癌的肿瘤生长[53],hsa-miRNA-196a通过靶向促进骨肉瘤中HOXA5 mRNA的3′-非翻译区来促进细胞迁移、侵袭和上皮-间质转化[54]。但是,这两个 miRNA 在 CAD中的作用如何,仍需进行更多的探索。
综上所述,CCL2、CCL5、CCL8、CCL21、EGR2、IL-7R、HOXA5、HOXB5、HOXB7和HOXC8在CAD患者EAT中表达失调,EAT可能通过HOX基因、hsa-miRNA-196/HOX信号通路及CCL促炎基因,以旁分泌的方式,通过趋化免疫细胞聚集,抑制保护性脂肪细胞因子转录、改变冠状动脉动脉血管表型参与到CAD的病理机制中。
