抗逆转录病毒治疗对HIV-1感染者外周血CD19+B淋巴细胞的活化与凋亡的影响▲
2021-09-22李建明熊润松彭丽珊王登嵘伍月榕梁镕伊梁淑家
李建明 熊润松 彭丽珊 王登嵘 杨 洋 刘 显 伍月榕 梁镕伊 梁淑家 肖 健,5
(广西中医药大学1 免疫学教研室,2 公共管理学院,南宁市 530020,电子邮箱:747110356@qq.com;3 重庆市武隆区疾病预防控制中心地方病与慢性病健康教育科,重庆市 408500;4 广西壮族自治区疾病预防控制中心艾滋病防制科,南宁市 530000;5 广西中医药大学广西高发传染病中西医结合转化医学重点实验室,南宁市 53022)
AIDS是由HIV-1感染所致,HIV-1入侵宿主后导致CD4+T淋巴细胞、单核巨噬细胞和B淋巴细胞等多种细胞的免疫应答失调[1-3],且能在外周血和淋巴组织中检测到这些异常应答。HIV-1直接或间接地作用于免疫系统,进行性破坏免疫系统[4],使得CD4+T淋巴细胞数量降低、功能缺陷,进而影响B淋巴细胞的活化及抗体的分泌,导致免疫系统功能失调[5]。HIV-1为逆转录病毒,因此抗逆转录病毒治疗(antiretroviral therapy,ART)可极大程度地抑制HIV的复制,同时抗逆转录病毒药物的联用也对HIV的复制造成多重的障碍。CD19广泛表达于大多数B淋巴细胞,是B淋巴细胞受体识别抗原中关键的信号传递分子,也是B淋巴细胞表面的特异性标志,是参与B淋巴细胞活化、增殖、分化及抗体产生的重要膜抗原。目前,探讨外周血CD19+B淋巴细胞的免疫活化和耗竭与HIV-1感染进程相关性的研究较少。本研究应用流式细胞术检测CD19+B淋巴细胞活化指标CD38、耗竭指标CD95和程序性死亡受体1(programmed cell death 1,PD-1)的表达情况,分析在HIV-1感染过程中CD19+B淋巴细胞的活化和耗竭情况,探讨ART对HIV-1感染者CD19+B淋巴细胞水平及其CD38、CD95和PD-1水平的影响。
1 资料与方法
1.1 临床资料 纳入2016~2018年在广西疾病预防控制中心就诊的101例HIV-1感染者为研究对象,年龄7~86岁,中位年龄39岁,其中男性78例、女性23例。纳入标准:感染至纳入研究时间不超过10年,CD4+T淋巴细胞计数<350个/μL。排除合并HBV、HCV感染。根据是否进行过ART,分为未治疗组73例(无特殊病史,体检显示无其他异常)和治疗组28例。未治疗组中男性61例、女性12例,年龄(37.45±15.65)岁;治疗组中男性17例、女性11例,年龄(33.39±15.38)岁。另设健康对照组30例,纳入标准:HIV-1阴性,身体健康,无疾病史、过敏史及免疫治疗史。排除合并HBV、HCV感染。其中男性12例、女性18例,年龄12~80(31.43±12.40)岁。3组研究对象的年龄和性别构成等一般资料比较,差异均无统计学意义(均P>0.05),具有可比性。本研究获得广西中医药大学医学伦理学委员会批准,所有研究对象均对本研究知情并签署知情同意书。
1.2 主要仪器和试剂 流式细胞仪购自美国BD公司(型号:CytoFLEX),台式水平离心机购自德国Eppendorf公司(型号:AG5453)。人淋巴细胞分离液购自Solarbio公司(生产批号:P8610),RPMI-1640培养基购自Solarbio公司(生产批号:11875),磷酸缓冲盐溶液购自Solarbio公司(生产批号:1020),流式抗体Anti-Human CD19 APC-Cy7(生产批号:557791),Anti-Human CD38-PerCP-Cy5.5(生产批号:551400)、Anti-Human CD95 PE-Cy7(生产批号:555674)、Anti-Human PD-1 APC(生产批号:558694)均购自美国BD公司,4%多聚甲醛购自BioSharp公司(生产批号:BL539A)。
1.3 检测方法 于清晨抽取纳入对象空腹状态下的外周静脉血10 mL,存放于EDTA管中,再用淋巴细胞分离液常规分离获得外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。采用流式细胞仪检测CD19、CD38、PD-1、CD95的表达水平:每个样本取50 μL PBMC悬液,加入1 μL的相对应荧光素标记的抗人单克隆抗体,即Anti-Human CD19 APC-Cy7、Anti-Human CD38-PerCP-Cy5.5、Anti-Human CD95 PE-Cy7、Anti-Human PD-1 APC,在4℃条件下避光孵育30 min,用磷酸缓冲盐溶液洗涤2次并弃去上清后,再用500 μL的1%多聚甲醛固定重悬,最后用流式细胞仪上机检测。本研究以CD19+B淋巴细胞作为细胞群,以荧光扣除对照作为设门依据,分析CD19+B淋巴细胞群上CD38、PD-1、CD95的表达水平。
1.4 设门策略 通过调整前向角散光(forward scatter,FSC)和侧向角散射光(side scatter,SSC)选取PBMC,从选定的细胞群中根据所标记荧光设门CD19+B淋巴细胞,再从CD19+B淋巴细胞中设门观察CD38、CD95、PD-1的表达情况,见图1。
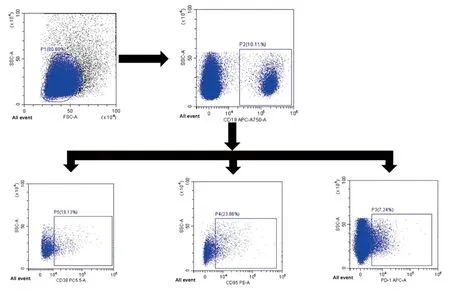
图1 人PBMC设门策略
1.5 统计学分析 采用GraphPad Prism 8.0软件进行统计分析。计量资料以(x±s)表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验;不符合正态分布的计量资料以[M(P25,P75)]表示,比较采用非参数秩和检验。绘制散点图并采用相关分析法分析CD19+B淋巴细胞水平以及CD95、CD38、PD-1表达量之间的关系。以P<0.05为差异具有统计学意义。
2 结 果
2.1 3组CD19+B淋巴细胞水平的比较 未治疗组、治疗组、健康对照组CD19+B淋巴细胞水平依次升高(均P<0.05),见表1和图2。

表1 3组CD19+B淋巴细胞水平的比较[M(P25,P75),%]

图2 各组CD19+B淋巴细胞水平检测结果
2.2 3组CD19+B淋巴细胞CD38表达水平的比较 健康对照组和治疗组CD19+B淋巴细胞CD38的表达水平均低于未治疗组(均P<0.05),而治疗组和健康对照组CD19+B淋巴细胞CD38的表达水平差异无统计学意义(P>0.05),见表2和图3。

表2 3组CD19+B淋巴细胞CD38表达水平的比较[M(P25,P75),%]

图3 各组CD19+B淋巴细胞CD95的表达情况
2.3 3组CD19+B淋巴细胞CD95表达水平的比较 未治疗组、治疗组、健康对照组CD19+B淋巴细胞CD95的表达水平依次降低(均P<0.05)。见表3和图4。

表3 3组CD19+B淋巴细胞CD95表达水平的比较(x±s,%)

图4 各组CD19+B淋巴细胞CD95的表达情况
2.4 3组CD19+B淋巴细胞PD-1表达水平的比较 未治疗组和治疗组CD19+B淋巴细胞PD-1的表达水平均高于健康对照组(均P<0.05),而治疗组与未治疗组CD19+B淋巴细胞PD-1的表达水平差异无统计学意义(P>0.05)。见表4和图5。

表4 3组CD19+B淋巴细胞PD-1表达水平的比较[M(P25,P75),%]

图5 各组CD19+B淋巴细胞PD-1的表达情况
2.5 未治疗组CD19+B淋巴细胞水平、CD95、CD38、PD-1表达水平之间的相关性 相关分析结果显示,未治疗组HIV-1感染者外周血CD19+B淋巴细胞水平与CD38的表达水平、CD95的表达水平、PD-1的表达水平均不相关(均P>0.05);CD38的表达水平与CD95的表达呈正相关(P<0.05),而与PD-1的表达水平不相关(P>0.05);CD95的表达水平与PD-1的表达水平间也无相关性(P>0.05)。见图6。

图6 未治疗组中CD19+B淋巴细胞水平以及CD38、CD95、PD-1表达水平之间的相关性
2.6 治疗组外周血CD19+B淋巴细胞水平、CD95、CD38、PD-1 表达水平的相关性 相关性分析结果显示,治疗组HIV-1患者外周血CD19+B淋巴细胞水平以及CD38、CD95、PD-1的表达水平,两两之间均不相关(均P>0.05)。见图7。

图7 治疗组中CD19+B淋巴细胞水平以及CD38、CD95、PD-1表达水平之间的相关性
3 讨 论
HIV-1感染会导致机体淋巴细胞异常,如CD4+T淋巴细胞、单核巨噬细胞、CD8+T淋巴细胞和B淋巴细胞等。CD4+T淋巴细胞数量随着感染的进展持续性减少,常作为HIV感染的临床分期依据[6-7]。本研究中未治疗组、治疗组、健康对照组CD19+B淋巴细胞的百分比依次升高(均P<0.05)。这提示ART可能影响HIV-1感染者外周血中CD19+B淋巴细胞的表达。随着HIV-1感染的进展,CD19+B淋巴细胞的表达可能是动态变化的,细胞的活化与耗竭可能是并存的。为进一步探究CD19+B淋巴细胞活化与耗竭的变化规律,我们选取CD38、CD95、PD-1这几个指标进行进一步研究。
CD38存在于B淋巴细胞表面,与B淋巴细胞的活化相关,CD38与B淋巴细胞受体以及CD19/CD21/CD81共受体等组成共刺激复合物,在复合物的刺激下B淋巴细胞的活化阈值降低,此外,CD38可激活磷脂酰肌醇激酶途径,促进B淋巴细胞的发育[8-9]。HIV-1感染可导致CD38表达升高,CD38的表达与体内HIV-1的载量呈正相关,因此CD38可间接反映体内的HIV-1载量[10]。本研究结果显示,未治疗组的CD19+B淋巴细胞的CD38表达水平高于治疗组和健康对照组(均P<0.05),提示,在HIV-1感染进程中CD19+B淋巴细胞水平降低,导致CD19+B淋巴细胞的活化阈值降低,CD38随之表达并促进CD19+B淋巴细胞的成熟、修复。而治疗组与健康对照组CD19+B淋巴细胞的CD38表达水平差异无统计学意义(P>0.05),提示ART可能作用于CD38,活化CD19+B淋巴细胞,从而弥补HIV-1感染造成的B淋巴细胞受损。
CD95主要存在于活化的T淋巴细胞和B淋巴细胞表面,可通过依赖胱天蛋白酶通路介导细胞凋亡[11]。研究显示,未经治疗的HIV-1感染者的B淋巴细胞中CD95的表达增加,这可能导致细胞的加速更新以及细胞对病原体、疫苗抗原的记忆丧失[12-14]。本研究中,未治疗组、治疗组、健康对照组CD19+B淋巴细胞CD95的表达水平依次降低(P<0.05),即经ART后HIV感染者的CD95表达水平虽较未治疗组低,但仍高于健康对照组,不能完全恢复到健康人的状态。这提示ART部分作用于CD95,而CD95能介导凋亡,诱导CD19+B淋巴细胞凋亡,间接抑制了体液免疫[15]。
PD-1参与HIV-1的感染进程,在T淋巴细胞、B淋巴细胞和单核细胞等细胞中均有表达,它能通过抑制机体的免疫功能,促进疾病发展[16-19]。相关研究表明,HIV-1患者外周血中可溶性PD-1含量高于健康对照组,且与病毒载量呈正相关,与CD4淋巴细胞计数呈负相关[20];在HIV-1感染进程中,CD8+T淋巴细胞中PD-1表达水平影响CD8+T淋巴细胞的活化及功能[21]。在本研究中,治疗组、未治疗组CD19+B淋巴细胞的PD-1表达水平均高于健康对照组(均P<0.05),但治疗组与未治疗组之间差异无统计学意义(P>0.05),这提示ART可能不作用于PD-1。
我们为进一步分析CD19+B淋巴细胞耗竭与活化之间的相关性。结果显示,治疗组外周血CD19+B淋巴细胞水平及CD19+B淋巴细胞上的CD38、PD-1、CD95的表达水平之间均不相关(均P>0.05);在未治疗组中仅有CD38与CD95的表达水平之间呈正相关(P<0.05),而其他指标之间均不存在相关性(均P>0.05)。这提示在HIV-1感染者中CD19+B淋巴细胞的活化与耗竭间存在正相关关系,且ART可能影响CD38与CD95之间的互作用。
综上所述,ART可能通过影响HIV-1感染者CD19+B淋巴细胞中CD38与CD95的表达及二者之间的相互作用,对HIV-1感染者的体液免疫功能发挥一定的修复作用。ART可能不影响HIV-1感染者CD19+B淋巴细胞中PD-1的表达水平。ART增强CD19+B淋巴细胞活化并抑制其凋亡的作用,或可成为今后抗HIV-1感染的一个新思路。
