慢性阻塞性肺疾病合并侵袭性肺曲霉菌病危险因素Meta分析*
2021-09-18刘美芳高颖王登本李阳魏永梅马俊彦赵瑞婧王丽娜范亚莉鱼军李建英
刘美芳 高颖 王登本 李阳 魏永梅 马俊彦 赵瑞婧 王丽娜 范亚莉 鱼军 李建英#
(1延安大学医学院2019级硕士研究生 陕西延安716000;2延安大学医学院2020级硕士研究生陕西延安716000;3延安大学医学院2018级硕士研究生 陕西延安716000;4西安交通大学附属中心医院 陕西西安710003)
慢性阻塞性肺疾病(COPD)是一种常见的、可预防和可治疗的疾病,其特征是气道和/或肺泡异常所致持续的呼吸道症状和气流受限[1]。COPD患者病情急性加重常与感染有关,主要是细菌,其次是真菌。近年来随着糖皮质激素和广谱抗生素的广泛应用,COPD患者合并真菌感染的情况越来越多,研究表明肺部真菌感染中以曲霉菌最为常见[2]。曲霉菌属于条件致病菌,在自然界中广泛存在,常寄生于上呼吸道,通常在机体免疫力下降时致病。由于曲霉菌有很强的产孢能力,曲霉孢子形成后释放在空气中的分生孢子又足够小,可到达肺泡,因此肺是曲霉菌感染的主要器官[3]。侵袭性肺曲霉菌病(IPA)主要是由烟曲霉引起的肺组织破坏,多表现为局限性肉芽肿或广泛化脓性肺炎伴脓肿形成[4]。以前认为IPA主要发生在中性粒细胞缺乏患者身上,这类患者通常患有严重免疫抑制疾病,如恶性血液病,实体器官或造血干细胞移植或正在接受长期免疫抑制治疗[5]。然而越来越多研究发现,非中性粒细胞减少的患者,特别是COPD患者,也容易发生肺曲霉菌感染[3,5~6]。在临床上COPD合并IPA临床表现隐匿,无特异性,诊断很困难,且预后差,病死率高达90%以上[7]。因此尽早诊断COPD合并IPA,对于提高患者生存率,改善其预后至关重要。本研究对国内外公开发表的COPD合并IPA危险因素对照研究进行分析,探讨COPD合并IPA发生的相关危险因素,以便临床工作者尽早地识别高危患者,为预防、诊断COPD合并IPA提供循证参考。现报道如下:
1 资料与方法
1.1 文献纳入标准(1)国内外公开发表的病例对照研究;(2)研究对象:确诊的COPD患者,根据是否合并IPA,分为COPD合并IPA的病例组和COPD未合并IPA的对照组;(3)观察指标:提取至少3篇文献报道的相关因素,包括患者的一般情况(性别、吸烟史、COPD严重程度分级、血清白蛋白水平、低白蛋白血症)、合并疾病(糖尿病、呼吸衰竭、肾功能不全、肝功能不全、心功能不全)、糖皮质激素应用时间≥2周、长期使用糖皮质激素、糖皮质激素使用史、应用广谱抗生素≥2周、应用抗菌药物时间(d)、入住ICU例数、机械通气、侵入性操作;(4)相关因素的单位标准相同或者可以转换。
1.2 文献排除标准 (1)回顾性研究;(2)不完整的研究,如无法获取全文、数据不完整的文献;(3)重复文献。
1.3 检索策略 在万方医学网、维普数据库、中国知网(CNKI)、PubMed等数据库中检索,中文检索词包括“慢性阻塞性肺疾病、侵袭性肺曲霉菌病、侵袭性肺曲霉菌感染、危险因素、影响因素”;英文检索词包括“Chronic Obstructive Pulmonary Disease、COPD、Invasive Pulmonary Aspergillosis、Risk Factors、Associate Factors”。检索时间从建库起至2021年3月。
1.4 文献筛选与数据提取 由两名研究者根据标准独立阅读相关文献,两人互相核对,筛选并去除明显不符合的文献,如有不肯定或有分歧的文献,则通过讨论解决或由第3名研究者来决定。根据标准进行筛选,对最终纳入的研究进行资料提取,提取内容包括第1作者、发表年限、纳入研究的病例基本特征、COPD患者合并侵袭性肺曲霉菌感染的危险因素及相关数据。
1.5 文献质量评价 采用纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)对纳入文献进行评价,评价内容包括人群选择、可比性、暴露评价3个方面,8个条目。
1.6 统计学方法 本研究使用RevMan 5.3软件进行Meta分析,计数资料采用优势比(OR),效应量以95%可信区间(CI)来表示。研究之间的异质性检验采用卡方检验,若P≤0.1,I2≥50%则说明各研究之间有较大的异质性,应该采用随机效应模型进行Meta分析;若P>0.1,I2<50%说明各研究之间无较大的异质性,应该采用固定效应模型进行Meta分析。以P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果 检索数据库初步获得相关文献57篇,根据纳入和排除标准,共排除重复文献、文章结局指标不明确及数据不完整的文献、回顾性研究47篇,最终纳入18篇文献[8~25],其中中文文献17篇,英文文献1篇。
2.2 纳入研究的基本特征及质量评价 纳入的研究文献发表年限为2008~2020年,所有研究均为病例对照研究,其中病例组879例,对照组3 327例,共4 206例患者纳入本研究。纳入研究质量评分5~8分,文献质量较高,纳入研究的基本特征及质量评价。见表1。
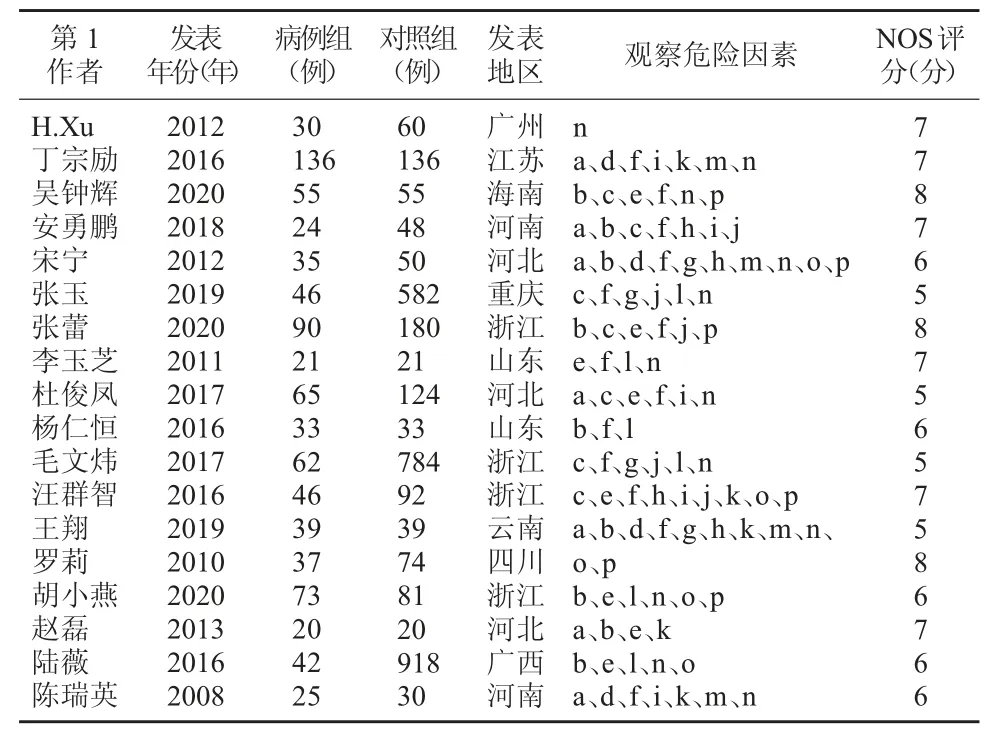
表1 纳入研究基本特征
2.3 COPD合并IPA危险因素Meta分析结果
2.3.1 患者一般情况与IPA的关系 有8篇文献[9,11,12,16,20,22,24,25]报道了性别与IPA的相关性,各研究之间无较大的异质性(P=0.99,I2=0%),故采用固定效应模型显示,结果显示性别与COPD合并IPA无相关性(OR=1.11,95%CI:0.86~1.44,P=0.41);9篇文献[10~12,14,17,20~23]报道了吸烟史与IPA的相关性,各研究之间有较大的异质性(P=0.01,I2=58%),故采用随机效应模型显示,结果显示吸烟史与COPD合并IPA无 相 关 性(OR=1.47,95%CI:0.93~2.33,P=0.10);7篇文献[10,11,13,14,16,18,19]报道了COPD严重程度3、4级与IPA的相关性,各研究之间有较大的异质性(P<0.000 01,I2=95%),故采用随机效应模型显示,结果显示COPD严重程度3、4级是COPD合并IPA的危险因素(OR=4.82,95%CI:1.38~16.84,P=0.01)。见图1。4篇文献[9,14,20,24]报道了血清白蛋白水平与IPA的相关性,各研究之间无较大的异质性(P=0.84,I2=0%),故采用固定效应模型显示,结果显示血清白蛋白水平是COPD合并IPA的危险因素(MD=-7.70,95%CI:-8.21~-7.19,P<0.000 01)。见图2。8篇文献[10,14~16,19,21~23]报道了低白蛋白血症与IPA的相关性,各研究之间有较大的异质性(P=0.02,I2=58%),故采用随机效应模型显示结果显示低白蛋白血症是COPD合并IPA的危险因素(OR=4.93,95%CI:3.04~7.99,P<0.000 01)。见图3。

图1 COPD严重程度分级3级、4级与IPA相关性Meta分析

图2 血清白蛋白水平与IPA相关性Meta分析

图3 低白蛋白血症与IPA相关性Meta分析
2.3.2 合并疾病与IPA的关系14篇文献[9~20,24,25]报道了合并糖尿病与IPA的相关性,各研究之间有较大的异质性(P<0.000 01,I2=93%),故采用随机效应模型显示,结果显示合并糖尿病是COPD合并IPA的危险因素(OR=6.78,95%CI:2.59~17.79,P<0.000 1)。见图4。4篇文献[12,13,18,20]报道了合并呼吸衰竭与IPA的相关性,各研究之间有较大的异质性(P=0.06,I2=60%),故采用随机效应模型显示结果显示合并呼吸衰竭是COPD合并IPA感染的危险因素(OR=6.09,95%CI:3.19~11.63,P<0.000 01)。见图5。5篇文献[11,12,19,20,25]报道了合并肾功能不全与IPA的相关性,各研究之间无较大的异质性(P=0.86,I2=0%),故采用固定效应模型显示,结果显示合并肾功能不全是COPD合并IPA的危险因素(OR=2.97,95%CI:1.23~7.18,P=0.02)。见图6。5篇文献[9,11,16,19,24]报道了合并肝功能不全与IPA的相关性,各研究之间无较大的异质性(P=0.63,I2=0%),故采用固定效应模型显示,结果显示合并肝功能不全与COPD合并IPA无相关性(OR=0.92,95%CI:0.59~1.46,P=0.74);6篇文献[11,13,14,18,19,25]报道了合并心功能不全与IPA的相关性,各研究之间有较大的异质性(P<0.000 01,I2=87%),故采用随机效应模型显示,结果显示合并心功能不全是COPD合并IPA的危险因素(OR=3.26,95%CI:1.38~7.68,P=0.007)。见图7。

图4 合并糖尿病与IPA相关性Meta分析
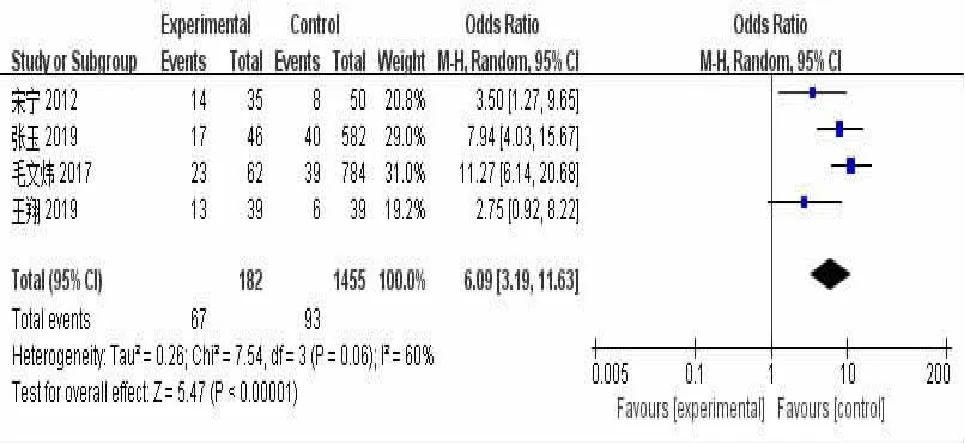
图5 合并呼吸衰竭与IPA相关性Meta分析

图6 合并肾功能不全与IPA相关性Meta分析
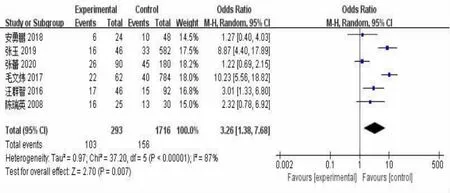
图7 合并心功能不全与IPA相关性Meta分析
2.3.3 糖皮质激素与IPA的关系 有5篇文献[9,19,20,22,24]报道了长期使用糖皮质激素与IPA的相关性,各研究之间有较大的异质性(P=0.02,I2=67%),故采用随机效应模型显示,结果显示长期使用糖皮质激素是COPD合并IPA的危险因素(OR=3.96,95%CI:2.30~6.83,P<0.000 01)。见图8。有7篇文献[13,15,17,18,21,23,25]报道了糖皮质激素使用史与IPA的相关性,各研究之间有较大的异质性(P=0.002,I2=71%),故采用随机效应模型显示,结果显示糖皮质激素使用史是COPD合并IPA的危险因素(OR=6.73,95%CI:3.34~13.56,P<0.000 01)。见图9。

图8 长期使用糖皮质激素与IPA相关性Meta分析

图9 糖皮质激素使用史与IPA相关性Meta分析
2.3.4 应用抗菌药物时间与IPA的关系 有5篇文献[9,12,20,24,25]报道了应用抗菌药物时间与IPA的相关性,各研究之间有较大的异质性(P<0.000 01,I2=87%),故采用随机效应模型显示,结果显示应用抗菌药物时间是COPD合并IPA的危险因素(MD=8.25,95%CI:6.93~9.58,P<0.000 01)。见图10。

图10 应用抗菌药物时间与IPA相关性Meta分析
2.3.5 机械通气与IPA的关系 有13篇文献[8~10,12,13,15,18,20,21,23~25]报道了机械通气与IPA的相关性,各研究之间有较大的异质性(P<0.000 01,I2=77%),故采用随机效应模型显示,结果显示机械通气是COPD合并IPA的危险因素(OR=10.60,95%CI:6.18~18.15,P<0.000 01)。见图11。

图11 机械通气与IPA相关性Meta分析
2.3.6 侵入性操作与IPA的关系 有5篇文献[12,19~21,23]报道了侵入性操作与IPA的相关性,各研究之间有较大的异质性(P=0.05,I2=57%),故采用随机效应模型显示,结果显示侵入性操作是COPD合并IPA的危险因素(OR=7.95,95%CI:3.74~16.92,P<0.000 01)。见图12。

图12 侵入性操作与IPA相关性Meta分析
2.3.7 入住ICU与IPA的关系6篇文献[10,12,14,19~21]报道了入住ICU与IPA的相关性,各研究之间无较大的异质性(P=0.25,I2=25%),故采用固定效应模型显示,结果显示入住ICU是COPD合并IPA的危险因素(OR=4.49,95%CI:3.02~6.67,P<0.000 01)。见图13。

图13 入住ICU与IPA相关性的Meta分析
2.4 敏感性分析 对纳入研究中COPD合并IPA感染的13个危险因素分别进行随机与固定效应两种模型分析,比较结果发现,13个危险因素的OR值相差均较小,证明本研究的合并结果较为可靠。见表2。

表2 随机效应模型和固定效应模型计算结果比较
2.5 发表偏移分析 使用RevMan 5.3对合并糖尿病的评价指标绘制漏斗图,漏斗图显示,数据点大部分集中于中上部,但不对称,提示可能存在发表偏倚风险。见图14。

图14 糖尿病指标漏斗图
3 讨论
曲霉菌是一种通过空气传播的病原体,其孢子可随空气经气道到达肺部。正常情况下,气道内的黏液会将曲霉孢子黏附,借助纤毛摆动将其排出肺外。COPD患者因吸烟、多次感染发作及反复的上皮损伤致纤毛运动减弱[3],因此在很大程度上增加了并发IPA的概率。COPD合并IPA无特异性的临床表现,尤其是急性加重期的患者症状重,完全掩盖了IPA的症状[10,26],因此早期诊断非常具有挑战性。近年来,因抗生素和糖皮质激素的使用,COPD合并IPA的患者逐年增加,发病率和死亡率也不断攀升,严重影响了患者的生活质量和预后。因此尽早识别COPD并发IPA的危险因素,对其进行早期干预,可改善患者的预后,提高其存活率。
本研究共纳入18篇文献,其中COPD合并IPA组共879例,COPD未合并IPA组共3 327例。Meta分析结果显示性别、吸烟史、合并肝功能不全与COPD并发IPA无关;而COPD严重程度分级、血清白蛋白水平、低白蛋白血症、合并糖尿病、合并呼吸衰竭、合并肾功能不全、合并心功能不全、长期使用糖皮质激素、糖皮质激素使用史、应用抗菌药物时间、机械通气、侵入性操作、入住ICU、住院时间是COPD合并IPA的危险因素。
白蛋白水平是反映机体营养状况的重要指标,白蛋白水平的下降会削弱机体免疫功能,包括体液免疫和细胞免疫,肺泡巨噬细胞与中性粒细胞的杀菌能力减弱,从而使气道内的黏蛋白生成减少,支气管及肺泡上皮修复能力减弱,最终导致呼吸系统的防御能力下降,使COPD患者更容易并发IPA[10,12]。COPD严重程度分级可以反映COPD患者气道阻塞的严重程度[16],危重症患者肺功能基础较差,营养不良,机体抵抗力低下,易出现真菌感染,COPD患者并发IPA的发病率也随之上升。COPD患者合并糖尿病、呼吸衰竭、肾功能不全、心功能不全等会导致机体的自身免疫出现不同程度地受损[11],进而易并发IPA。因此对于COPD患者,需要注意加强营养,提高自身的免疫力,从而减少感染的风险。
糖皮质激素本身无抗菌作用,并且会抑制机体的免疫功能,影响中性粒细胞阻碍曲霉菌丝体的形成[22],使淋巴细胞产生抗体的能力下降[10]。此外,糖皮质激素抑制Th1型细胞因子的产生,并增强Th2细胞因子,减少宿主对曲霉菌的反应[3],最终导致机体对病原菌的清除能力下降,易诱发严重的感染。在临床中需严格把控COPD患者使用糖皮质激素的指征,防止真菌的感染,降低患者并发IPA的风险。长期使用抗生素会破坏患者呼吸道的正常菌群,使体内菌群失调,细菌大量繁殖,导致正常定植在气道的真菌发生迁移、侵袭[10,22],而大剂量及频繁的用药又会削弱机体的抵抗力[12]。此外,广谱抗生素会使中性粒细胞释放过氧化物酶减少,从而无法有效破坏真菌菌丝细胞壁[22]。因此长期使用抗生素是导致真菌感染最主要的外部诱因之一。因此在临床中应避免抗生素的滥用、过度使用等,减少细菌耐药性的发生。
本研究中,与非IPA患者相比,合并IPA的COPD患者接受机械通气、侵入性操作的比例更高,入住ICU的例数更多,住院时间更长,究其原因是因为合并IPA的COPD患者伴有更多的慢性基础性疾病,更有可能处于危重状态。机械通气是COPD患者病情严重程度的标志,此类患者常伴有呼吸衰竭等[16]。机械通气及由此产生的抽吸都是损伤气管内黏膜、改变黏液纤毛力学和促进侵袭性微生物入侵危重患者的过程[27]。机械通气和侵入性操作均会有不同程度的机械损伤,均会对机体的黏膜屏障产生一定的破坏,从而为病菌入侵提供便利的条件。需要接受机械通气和侵入性操作的COPD患者往往有更长的住院时间,住院时间的延长会增加院内机会致病菌的感染概率,在一定程度上增加了抗生素和糖皮质激素的使用时长,导致并发IPA的风险增高,因此需严格把控COPD患者的住院时间。
综上所述,COPD严重程度分级、血清白蛋白水平、低白蛋白血症、合并糖尿病、合并呼吸衰竭、合并肾功能不全、合并心功能不全、长期使用糖皮质激素、糖皮质激素使用史、应用抗菌药物时间、机械通气、侵入性操作、入住ICU、住院时间是COPD合并IPA的危险因素。本Meta分析存在一定的局限性:(1)纳入文献的大部分为中文文献,资料可能不具有全面性;(2)如年龄等部分指标因提取数据有限,可能对结果分析产生一定的影响;(3)文献可能存在发表偏倚。故本Meta分析结果仍需更多设计良好、大样本、高质量的RCT来进一步验证,提供更可靠的临床证据。随着COPD并发IPA的发生率增高,我们在临床上需对这类患者提高警惕,尽早识别其危险因素,这对于疾病预防、诊治及预后有重要意义。
