全蝎和蜈蚣的多肽粗提物对肝癌细胞中HBV的抑制作用
2021-09-18马青杨扬马韬徐卫东赵明
马青,杨扬,马韬,徐卫东,赵明
(1. 江苏大学药学院,江苏 镇江 212013; 2. 上海计划生育科学研究所,上海 200032; 3. 上海交通大学附属瑞金医院普外科,上海 200025)
乙型肝炎病毒(hepatitis B virus,HBV)感染可诱发肝癌,导致全球每年超过100万人死亡[1]。HBV闭合环状DNA合成下一代病毒RNA[2],前基因组RNA编码HBV聚合酶和HBV核心蛋白(HBV core protein, HBc)[3],病毒逆转录酶合成HBV基因组的负链[4]。HBV基因组编码4个开放阅读区:P、C、S、X,其中P基因编码病毒聚合酶,C基因编码核衣壳的结构蛋白以及HBV核心抗原(HBeAg),S基因编码3种不同的包膜糖蛋白,包括HBV表面抗原(HBsAg),而X基因编码多功能X蛋白[1]。HBV主要治疗药物是核苷酸类似物,如拉米夫定和恩替卡韦,其中,拉米夫定主要通过抑制病毒逆转录酶活性抑制HBV产生[5-6],而恩替卡韦对HBV聚合酶具有很高的选择性,长期服用可能造成患者肝损伤。全蝎(ButhusmartensiiKarsch)及蜈蚣(ScolopendrasubspinipesmutilansL.Koch)作为广谱性抗病毒中药材,从中提取的某些毒性肽具有抗病毒作用[7-9]。以往研究表明,全蝎和蜈蚣的活性多肽的分子量分别集中在5~10 kDa和5 kDa以下两个主要区域[10-12]。肝癌HepAD38细胞在诱导型四环素启动子的控制下可以产生HBV,当去除细胞培养液中四环素后,可诱导HBV RNA转录和蛋白质合成。目前,全蝎和蜈蚣的多肽是否具有抗HBV活性尚不清楚。因此,本研究拟通过对全蝎尾部提取的5~10 kDa多肽(PEST)和蜈蚣头部提取的5 kDa以下多肽(PECH)2个组分与HepAD38细胞体外共培养,行抗HBV活性研究。
1 材料与方法
1.1 细胞株、主要试剂及仪器
全蝎和蜈蚣购自江苏大学附属医院,由江苏大学医学院赵明主任中药师完成样本鉴定。肝癌HepAD38细胞、HepG2细胞均由上海计划生育科学研究所分子实验室赠予。
DMEM、Trizol(美国Thermo Fisher公司);胎牛血清(美国Gibco公司);100×青霉素/链霉素溶液(上海源培生物科技股份有限公司);四环素(睿铂赛生物科技有限公司);MTT(上海生工生物工程有限公司);微型分光光度计ASP-3700(美国ACTGene公司);PCR引物由上海生工生物工程有限公司合成;PBST(澳大利亚Devondale公司);PVDF膜、GAPDH(美国Abcam Biotechnology公司);鼠抗HBc,兔抗GAPDH,山羊抗兔或抗鼠IgG(美国Cell Signaling 公司);化学发光试剂(北京Key-Bio公司);RT-6500酶标仪(深圳雷杜生命科学股份有限公司);HBV核酸扩增(PCR)荧光定量试剂盒(中美生物技术公司);HBsAg诊断试剂盒(万泰生物药业股份有限公司);FastQuant cDNA第一链合成试剂盒(德国天根生化科技公司);Light Cycle 480Ⅱ实时荧光定量PCR系统(美国Roche公司);Tanon-5200化学发光成像系统(上海天能科技有限公司);二甲基亚砜、拉米夫定、恩替卡韦均购自美国Sigma-Aldrich公司;其余生化试剂均为国产分析纯。
1.2 细胞培养
HepAD38细胞培养于含DMEM、10%胎牛血清、100×青霉素/链霉素溶液和6.86 μmol/L四环素的培养基中。HepG2细胞培养在无四环素的相同培养基中。培养条件为温度37 ℃,含5% CO2。
1.3 多肽提取物制备及浓度与重金属测定
取全蝎尾部与蜈蚣头部,用0.5 mL PBS清洗3次;加入0.2×PBS于4 ℃匀浆;4 ℃,2 000×g离心30 min、离心2次收集上清液;5 000×g,4 ℃超滤10 min;加入200 μL PBS重复超滤3次;分别收集全蝎5~10 kDa超滤液,蜈蚣5 kDa以下超滤液;于-80 ℃保存2 h;用冷冻干燥器浓缩至1/5;浓缩液以4 ℃、2 000 ×g离心20 min,收集上清液;全蝎和蜈蚣的多肽提取物分别命名为PEST和PECH。多肽浓度直接通过微型分光光度计测量,取部分送由中国科学院南京土壤研究所测定重金属含量。剩余于-80 ℃保存。
1.4 细胞活力与HBV DNA含量检测
1.4.1 细胞分组和处理 HepAD38细胞常规培养48 h。细胞分组如下:对照组采用空白培养基培养;PEST组:分别用0.125、0.250、0.500和1.000 mg/mL PEST处理;PECH组:分别用0.125、0.250、0.500和1.000 mg/mL PECH处理;阳性对照组:0.250 μmol/L拉米夫定或0.010 μmol/L恩替卡韦或6.860 μmol/L四环素;培养48 h。更换含上述药物培养基或空白培养基,再培养72 h,收集上清液保存于-80 ℃用于HBV DNA测定,其余用于细胞活力测定。HepG2细胞常规培养12 h,细胞分组如下:对照组采用空白培养基培养;PEST组:分别用0.125、0.250、0.500和1.000 mg/mL PEST处理;PECH组:分别用0.125、0.250、0.500和1.000 mg/mL PECH处理;分别培养24、48、72 h,用于细胞活力测定。筛选PEST和PECH活性浓度范围。
1.4.2 MTT法检测细胞活力 培养板中每孔加入90 μL培养基和10 μL MTT溶液(5 mg/mL),孵育4 h;加入150 μL DMSO,振荡10 min以溶解结晶;用酶标仪检测570 nm处光密度(D)值。细胞活力(%)=(实验组D值-调零孔D值)/对照组D值-调零孔D值)×100%。
1.4.3 qRT-PCR检测HBV DNA含量 从HepAD38细胞上清液中提取HBV DNA;qRT-PCR检测:18.8 μL HBV PCR反应液+0.2 μLTaq酶+0.03 μL尿嘧啶-N-糖基化酶,混合均匀后取19 μL分装入PCR管,加入1 μL待测样本DNA,共20 μL总反应体系;37 ℃反应5 min,95 ℃变性3 min,接着95 ℃ 15 s,60 ℃ 30 s,50个循环。羧基荧光素检测通道(FAM)收集信号,60 ℃收集数据。HBV DNA拷贝数用不同浓度HBV标准品制成的标准曲线进行定量。
1.5 HBV抗原含量、mRNA相对表达以及HBc含量检测
1.5.1 细胞分组和处理 HepAD38细胞常规培养48 h。对照组采用空白培养基培养;PEST组和PECH组分别用1 mg/mL PEST、PECH处理;阳性对照组:0.250 μmol/L拉米夫定或0.010 μmol/L恩替卡韦或6.860 μmol/L四环素;培养48 h;更换相应培养基再培养72 h。取上清液检测HBsAg和HBeAg含量,细胞用于qRT-PCR检测X/S/preC/PmRNA相对表达和HBc表达。
1.5.2 ELISA法检测HBsAg和HBeAg含量 检测HBsAg时, 每组设3个复孔,标准品孔中加入标准品溶液各50 μL,样本孔中加入样本溶液各10 μL和稀释液40 μL,再加入100 μL检测抗体,封闭,于37 ℃孵育60 min;检测HBeAg时,样品孔和阴性对照设3个复孔,阳性对照设2个复孔,相应孔中加入待测溶液各50 μL和酶标试剂50 μL,封闭,于37 ℃孵育30 min。两种微孔板均洗涤5次,毎孔加入A液、B液各50 μL,于37 ℃孵育15 min,加终止液50 μL,立即用酶标仪以双波长450 nm/600~650 nm进行检测。具体操作步骤按说明书进行。计算HBsAg和HBeAg的相对含量:相对含量(%)=(实验组D值-调零孔D值)/对照组D值-调零孔D值)×100%。
1.5.3 qRT-PCR检测X、S、preC、P等mRNA相对表达 采用Trizol法提取细胞总RNA,进行逆转录,反应体系共20 μL,RNA 2 μL,5×gDNA缓冲液2 μL ,快速逆转录缓冲液2 μL,逆转录酶混合物1 μL,FQ-逆转录随机引物2 μL,无RNA酶的双蒸水11 μL,操作方法参照逆转录试剂盒说明书进行。qRT-PCR反应体系共20 μL:罗氏缓冲液10 μL,cDNA模板2 μL,上、下游引物各2 μL,加无菌水至20 μL。qRT-PCR引物序列:X基因上游为5′-TGCGCAGACCAATTTATGC-3′,下游为5′-CTCAGCAATGTCAACGACC-3′;S基因上游为5′-GGTAGGAGCTGGAGCATTCG-3′,下游为5′-GTAGGCTGCCTTCTTGACTG-3′;preC基因上游为5′-GGAGCTACTGTGGAGTTACTCTC-3′,下游为5′-TGTTCAAG CCTCCAAGCTGT-3′;P基因上游为5′-TTGTGG GTCTTTTGGGTTTTG-3′,下游为5′-GTTGGCGAG AAAGTGAAAGC-3′;GAPDH基因上游为5′-CAAGAAGGTGGTGAAGCAG-3′,下游为5′-AGGTGGAGGAGTGGGTG-3′。反应程序:95 ℃预变性10 min,95 ℃ 15 s,55 ℃ 15 s,72 ℃ 45 s,然后95 ℃ 10 s,60 ℃ 15 s,40 ℃ 10 s,共35个循环。样本mRNA Ct值通过GAPDH的Ct值均一化,即ΔCt=Ct样本-Ct内参,样本基因mRNA相对丰度值以2-ΔΔCt值表示。
1.5.4 蛋白印迹法检测HBc表达 取“1.5.1”细胞,加入上样缓冲液于100 ℃煮10 min,冰上冷却2 min;10 000 r/min、4 ℃离心2 min;行SDS-PAGE,90 V 1 h;200 mA 2 h转印至PVDF膜;用含5%脱脂奶粉的PBST室温封闭1 h;放入一抗稀释液(小鼠HBc抗体,1 ∶1 000),内参稀释液(兔GAPDH,1 ∶2000),室温孵育1 h;PBST洗膜4次,每次10 min;加入二抗(抗小鼠IgG 1 ∶10 000,或抗兔IgG 1 ∶3 000)孵育1 h;PBST洗膜4次,每次10 min;ECL化学发光试剂盒显色,通过灰度扫描分析各蛋白表达量。
1.6 统计学分析
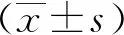
2 结果
2.1 提取物多肽浓度与重金属含量测定
PEST多肽浓度为6.000 mg/mL,PECH多肽浓度为5.600 mg/mL。重金属检测结果表明,PEST、PECH以及细胞培养基中的重金属含量均在机器检测误差范围内,因此重金属含量对细胞造成的影响可以忽略。见表1。
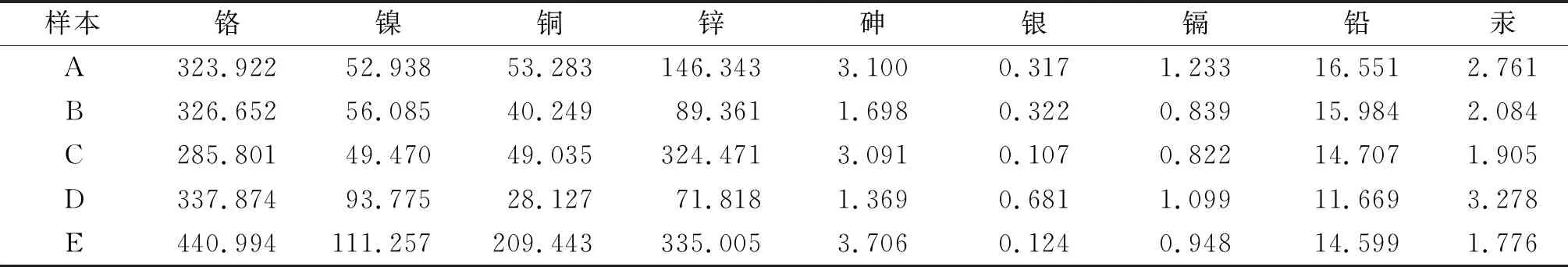
表1 各样本的重金属含量 mg/mL
2.2 PEST和PECH对HepAD38和HepG2细胞无毒性
由图1可见,肝癌HepAD38和HepG2细胞活力在70%以上,各组之间未见显著性差异,表明PEST和PECH对其没有细胞毒性。在HepG2细胞中,48 h时,与对照组相比,0.250和0.500 mg/mL PEST组细胞活力显著升高(t=3.26,3.31,P<0.05),0.125、0.250、0.500和1.000 mg/mL PECH组细胞活力显著升高(P均<0.05),与0.125 mg/mL组相比,0.250和0.500 mg/mL PEST组细胞活力显著升高(t=4.67,3.35,P<0.05);72 h时,与对照组相比,0.250、0.500和1.000 mg/mL PEST组细胞活力显著升高(P均<0.05),1.000 mg/mL PECH组细胞活力显著升高(t=2.25,P<0.05),与0.125 mg/mL组相比,0.250、0.500和1.000 mg/mL PEST组细胞活力显著升高(P均<0.05),1.000 mg/mL PECH组细胞活力显著升高(t=4.21,P<0.05)。
a:P<0.05,与对照组比较;b:P<0.05,与同时间点0.125 mg/mL比较图1 PEST和PECH分别对HepAD38和HepG2细胞活力的影响
2.3 PEST和PECH抑制HBV DNA复制
与对照组相比,0.250、0.500和1.000 mg/mL PEST组和0.125、0.500、1.000 mg/mL PECH组HBV DNA拷贝数显著降低(P<0.05或<0.01)。由此可见,特定浓度的PEST和PECH可抑制HBV DNA复制,其中1.000 mg/mL浓度作用下HBV DNA拷贝数最小,故选此浓度进行后续抗HBV活性实验。同时,四环素、恩替卡韦和拉米夫定组HBV DNA拷贝数较对照组显著降低(P均<0.01)。见图2。
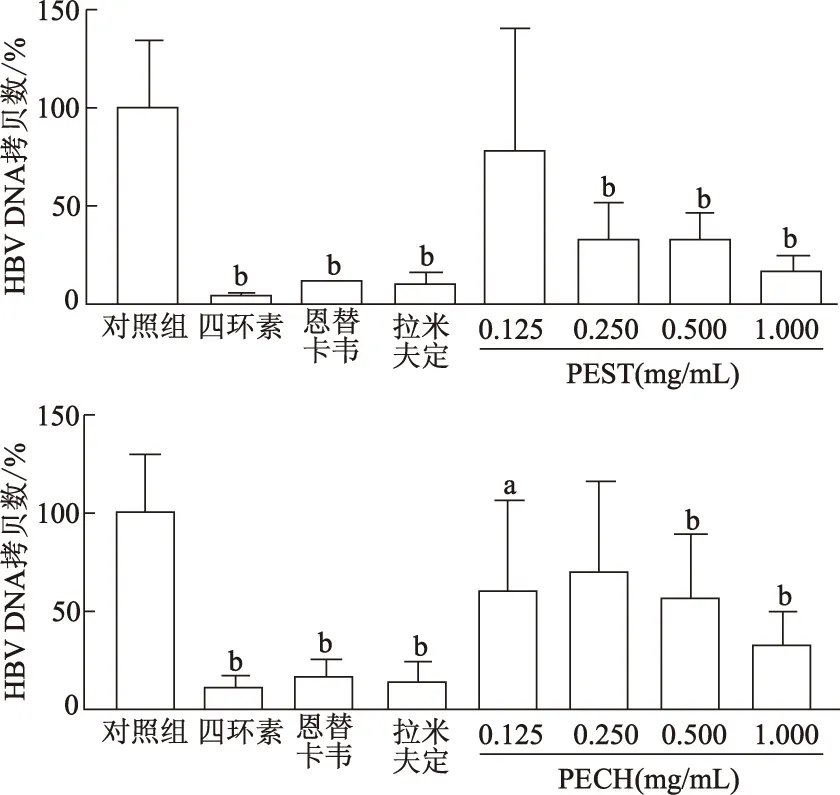
a:P<0.05,b:P<0.01,与对照组比较图2 不同组HBV DNA拷贝数比较
2.4 PEST和PECH抑制HBsAg和HBeAg含量
与对照组相比,PEST组和PECH组HBsAg含量和HBeAg含量均显著降低(P<0.05或<0.01)。由此可见,PEST和PECH可抑制HBV抗原分泌。同时,四环素、恩替卡韦和拉米夫定组HBsAg含量和HBeAg含量较对照组显著降低(P<0.05或<0.01)。见图3。
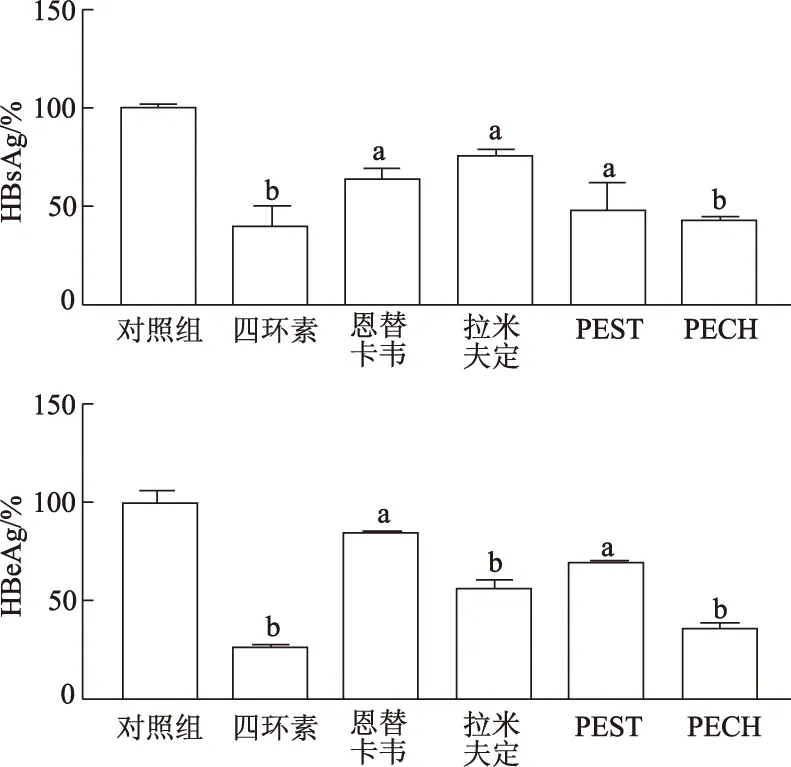
a:P<0.05,b:P<0.01,与对照组比较图3 不同组HBsAg和HBeAg含量比较
2.5 PEST和PECH降低HBV P mRNA相对表达
与对照组相比,PEST组和PECH组XmRNA相对表达显著升高(t=11.86,P<0.01;t=4.75,P<0.05);PEST组和PECH组S和preCmRNA相对表达无明显变化。PEST组和PECH组PmRNA相对表达显著降低(t=6.79,5.12,P均<0.05);同时,四环素组X、preC和PmRNA,恩替卡韦组和拉米夫定组PmRNA相对表达显著降低(P均<0.05),拉米夫定组SmRNA相对表达显著升高(P<0.05)。见图4。
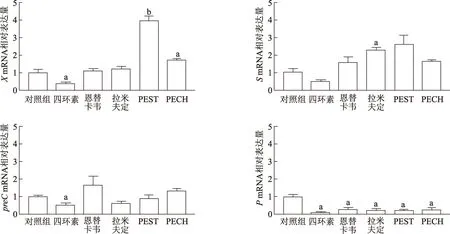
a:P<0.05,b:P<0.01,与对照组比较图4 不同组HBV X/S/preC/P mRNA相对表达量比较
2.6 PECH抑制HBc合成
与对照组相比,四环素组、拉米夫定组和PECH组HBc表达量显著降低(P<0.05或<0.01),恩替卡韦组HBc表达量显著升高(t=22.17,P<0.01),而PEST组HBc表达量无显著性差异。由此可见PEST对HBc合成几乎无影响,而PECH能抑制其合成。见图5。
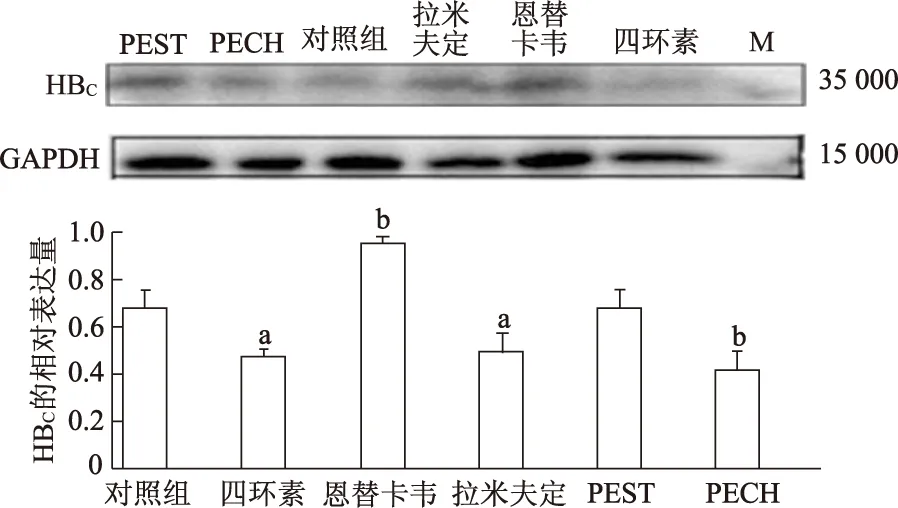
M:蛋白分子标准参照物;a:P<0.05,b:P<0.01,与对照组比较图5 不同组HBV core蛋白表达量比较
3 讨论
全蝎和蜈蚣的毒液是独特的药理资源,其中包含大量具有高度靶向功能的蛋白质和多肽类成分[13]。然而,获取毒液困难且花费高昂,本研究采用的提取多肽方法相对简单且经济。
抗HBV药物也用于与HBV相关的肝细胞癌患者的辅助治疗,显著降低患者体内病毒载量及活跃度,从而延缓病程的进展和复发[14]。HepAD38属于可以分泌HBV的肝癌细胞,HepG2属于肝癌细胞,因此抗HBV作用也可以以细胞毒性的形式表达。PEST和PECH样本中重金属含量在正常范围,本研究分别设置0.125、0.250、0.500和1.000 mg/mL浓度梯度的PEST组和PECH组以探索细胞毒性,结果显示二者对HepAD38和HepG2无细胞毒性。据报道,蜈蚣毒素肽在低浓度下可作为细胞生长因子[15],据此可以推测PECH类似细胞生长因子在低浓度下促进HepG2细胞生长。同样在HepAD38细胞中探索0.125、0.250、0.500和1.000 mg/mL浓度梯度的PEST组和PECH组对HBV DNA拷贝数的影响。预实验表明,去除四环素后第5天HBV DNA拷贝数约为去除四环素后第2天的53倍,与其他研究一致[16]。由此表明,PEST和PECH可以抑制HBV DNA复制,其中1.000 mg/mL抑制效果最好。
抑制HBV复制必然减少HBsAg和HBeAg的分泌[17],本研究结果证实PEST和PECH显著抑制HBsAg和HBeAg分泌。此外,PEST和PECH使HBVPmRNA相对表达量显著降低。需要进一步验证P蛋白表达显著降低是否只是由于HBV的PmRNA特异性编码HBV聚合酶[1,18],没有直接的结构信息可用于P蛋白,但是P蛋白是从pgRNA翻译而来的,pgRNA也可以作为HBc的mRNA,故进一步分析HBc表达,结果表明PECH能抑制HBc表达。
由于多肽类成分分离的复杂性,PEST和PECH样本中多肽成分的分离纯化有待进一步研究。如果分离出有效单体化合物,将更好地发挥全蝎和蜈蚣的抗HBV价值。目前关于PEST和PECH抗HBV活性的研究仅限于HepAD38细胞,还有待于使用动物模型进一步探索。
综上所述,PEST和PECH具有良好的抗HBV活性,可以抑制HBV DNA复制、抑制HBsAg和HBeAg分泌,PECH可以抑制HBc合成。PEST和PECH在HepAD38细胞株中表现出抗HBV作用,可能与PEST、PECH抑制HBVPmRNA合成有关。
