LncRNA44372在卵巢癌中的差异表达及生物信息学分析
2021-09-18丁璟杨鑫鑫邹雪琴高淑君刘雪潘玲丽张鳅丹赵杨静梁秀婷王荟朱彦玲邵启祥
丁璟, 杨鑫鑫, 邹雪琴, 高淑君, 刘雪, 潘玲丽,张鳅丹, 赵杨静, 梁秀婷,王荟, 朱彦玲, 邵启祥
(1. 江苏大学医学院, 江苏 镇江 212013; 2. 江苏大学附属徐州医院妇产科, 江苏 徐州 221005)
长链非编码RNA(long non-coding RNA,lncRNA)是长度大于200 nt的RNA转录物,具有很少的蛋白编码功能[1]。研究表明,lncRNA与多种生理和病理过程有关,尤其是癌症的发生发展,其异常表达可致癌细胞不受细胞周期调控,无限增殖[2]。lncRNA可从基因的转录前、转录和转录后水平进行调控,还调控DNA甲基化,重构染色质和组蛋白甲基化、乙酰化等表观遗传[3]。lncRNA常见的作用机制是通过海绵体吸附某些miRNA从而影响下游靶mRNA,构成竞争性内源RNA网络,从而调控基因的表达和功能的发挥[4]。但是,lncRNA在卵巢癌中发挥的生物学作用尚不清楚。本研究通过GEO数据库筛选获得在卵巢癌中具有显著差异表达的lncRNA44372,其位于chr6:165773201-165773271。进一步采用生物信息学技术对其生物学作用进行预测分析,并运用定量PCR验证其在卵巢癌细胞中的表达水平。
1 材料与方法
1.1 细胞株、主要试剂与仪器
人卵巢癌细胞系HO8910,3AO,A2780,OVCR3以及卵巢上皮HOSEpiC细胞由江苏大学医学院周小明教授惠赠;人卵巢癌SKOV3细胞由江苏大学医学院卢小东教授惠赠。
DMEM,RPMI 1640,胎牛血清购于美国Gibco公司;Trizol 试剂购于宝日医生物技术(北京)有限公司;异丙醇、氯仿、无水乙醇购自上海国药集团化学试剂有限公司;逆转录试剂盒、PCR ExTaqDNA聚合酶和SYBR©Premix ExTaqTMⅡ购自宝日医生物技术(北京)有限公司;焦炭酸二乙酯(DEPC)水购于上海生工生物工程有限公司;实时荧光定量PCR仪(美国Bio-Rad公司);NanoDrop1000测定仪(美国Thermo Scientific公司)。
1.2 研究方法
1.2.1 下载数据库 从NCBI GEO(https:∥www.ncbi.nlm.nih.gov/geo/)数据库中下载基因芯片数据集。进入NCBI网站,找到“GEO DataSets”搜索关键词“ovarian tissue samples”,“normal”,“tumor”,点击“search”,下载基因表达谱芯片数据GSE119054。它的基因芯片平台是GPL19615 Agilent-067406 CBC lncRNA + mRNA microarray V4.0。
1.2.2 筛选在卵巢癌中差异表达的lncRNA 在肿瘤转录组数据库CRN(http:∥syslab4.nchu.edu.tw/index.jsp)中对来自NCBI GEO数据库中卵巢癌及正常组织样本数据分析,以P<0.05,差异倍数1.2倍以上为条件,筛选出在卵巢癌中表达上调和下调的lncRNA。
1.2.3 筛选与lncRNA44372作用的相关基因 通过在线工具Annolnc(http:∥annolnc.cbi.pku.edu.cn/)[5]筛选出可能与lncRNA44372表达水平相关的基因,并用互作分数来表示共表达的强度。
1.2.4 lncRNA44372的GO分析和信号通路分析 利用在线工具David[6-7](https:∥david.ncifcrf.gov)对筛选出的共表达基因进行基因本体论分析(gene ontology,GO)及信号通路分析。
1.2.5 lncRNA44372的竞争性内源RNA网络构建 通过在线工具starbase(http:∥starbase.sysu.edu.cn/)研究lncRNA44372可靶向的miRNA分子和下游靶mRNA分子。利用在线数据库GEPIA(http:∥gepia.cancer-pku.cn)研究靶mRNA分子在卵巢癌中的表达量。
1.2.6 细胞培养 将卵巢癌SKOV3,HO8910,OVCR3和3AO细胞用含10%胎牛血清的DMEM培养,卵巢上皮细胞癌A2780细胞和卵巢上皮HOSEpiC细胞用含10%胎牛血清的RPMI 1640培养基培养。
1.2.7 RNA提取 取对数生长期的“1.2.6”细胞,以1×105密度接种于6孔板中,待细胞长至汇合度80%时取出;弃去培养基,用预冷PBS洗涤2次;每孔加入1 mL Trizol 试剂,在冰上静置5 min;用微量移液器小心吹打细胞使其脱落并转移至1.5 mL EP管中,加入200 μL氯仿,上下颠倒混匀5次,静置5 min;于4 ℃ 12 000×g离心15 min;取上清液,加入500 μL异丙醇,上下颠倒混匀5次后静置5 min;于4 ℃ 12 000×g离心10 min;弃上清液,每管加入75%乙醇1 mL漂洗沉淀;于4 ℃ 7 500×g离心5 min;弃去上清液后室温干燥,每管加入适量DEPC水溶解RNA,用NanoDrop ND-1000测定RNA浓度和纯度。
1.2.8 逆转录反应 根据逆转录试剂盒说明书将提取的总RNA逆转录成cDNA。反应条件:37 ℃反应15 min, 85 ℃反应5 min,4 ℃得到cDNA,保存于-20 ℃备用。
1.2.9 实时荧光定量PCR检测lncRNA44372表达 引物设计采用Primer 5.0软件,β-肌动蛋白上游引物序列为5′-CACGAAACTACCTTCAACTCC-3′,下游引物序列为5′-ATACTCCTGCTTGCTGATC-3′;lncRNA44372上游引物序列为5′-TATTGCACTTGGACGGAGCA-3′,下游引物序列为5′-AAGGCAAGCAACTTGACACG-3′,引物由上海生工生物工程有限公司合成。以cDNA 0.5 μL为模板,上下游引物各0.2 μL,SYBR Premix ExTaqTMⅡ5.0 μL,灭菌水4.1 μL,配制10 μL反应体系。反应条件:95 ℃预变性30 s,95 ℃ 变性5 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。每个样本设置3个复孔,根据熔解曲线形态判断反应的特异性,通过2-ΔΔCt法计算目的基因相对表达量。
1.3 统计学分析

2 结果
2.1 卵巢癌中差异表达的lncRNA
在肿瘤转录组数据网站CRN中对来自NCBI GEO数据库中有关的卵巢癌样本结果分析,其中根据表达量差异及P值发现,与卵巢正常组织相比,卵巢癌组织中表达上调的lncRNA有CROCCP2,lncRNA 00883,lncRNA00704,MCM3AP-AS1,DLEU2,NBLA00301;表达下调的lncRNA有lncRNA44372,lncRNA00657,RP11-890B15.3,TP73-AS1,差异具有统计学意义(P<0.05)。本实验室前期芯片检测结果[7]发现,在卵巢癌细胞系中有227个lncRNA表达上调,有483个lncRNA表达下调;结合基因表达谱芯片数据GSE119054选择lncRNA44372作为研究对象。
2.2 与lncRNA44372作用相关的共表达基因的筛选结果
根据相关作用分数及P值<0.05,筛选出与lncRNA44372存在相互作用关系的基因有579个。根据相关作用分数对579个基因进行排序,筛选出最具有相关性的10个基因(表1)。这些基因的功能主要涉及蛋白激酶活性、细胞凋亡、细胞周期等。

表1 相关性显著的10个基因
2.3 与lncRNA44372共表达基因的GO分析
对579个相关基因和lncRNA44372进行GO分析(表2)。结果显示,共表达基因在生物过程中富集在细胞周期调控、细胞转运、细胞骨架调控、细胞迁移、蛋白肽调节等方面;分子功能主要富集在信号传感器活性的调节、MHCⅡ类受体分子的活性、GTP酶激活剂活性、蛋白苏氨酸/酪氨酸激酶活性、蛋白结合能力等方面。见图1。
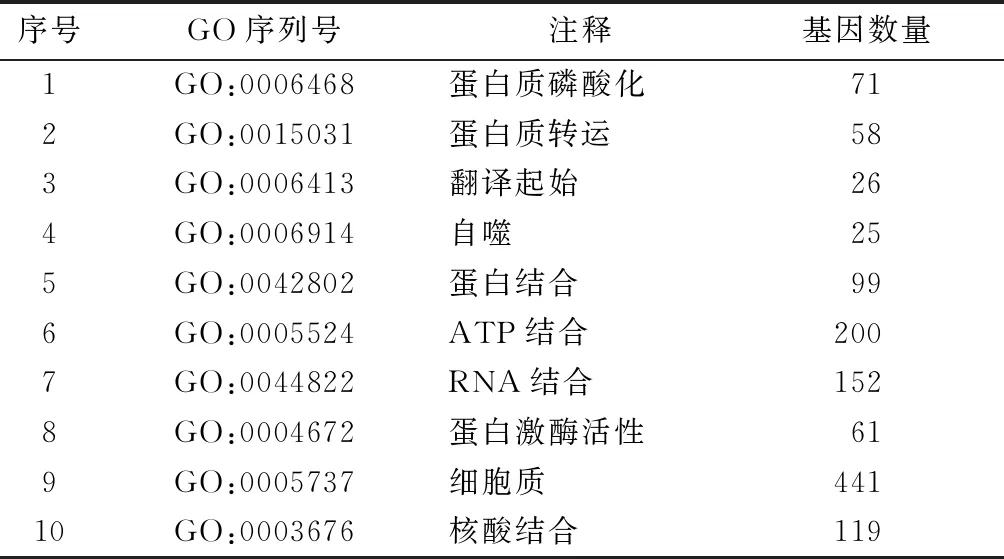
表2 相关基因的GO分析

图1 相关基因的GO分析
2.4 与lncRNA44372共表达基因的信号通路分析
信号通路富集分析表明,lncRNA44372可以在肿瘤坏死因子受体及其介导的细胞凋亡途径、p75神经营养因子受体介导的细胞凋亡通路,神经生长因子及其受体酪氨酸激酶A介导的肿瘤发生、增殖、血管生成和转移等相关途径发挥作用。
2.5 lncRNA44372的竞争性内源RNA网络构建
生物信息学在线工具starbase分析发现lncRNA44372可靶向的miRNA分子有miR-190和miR-193,相关的下游靶mRNA分子有UBLCP1、PHF20L1、ULK2、MED15、DPY19L1、PYROXD1和LONP2等(图2 A)。通过GEPIA数据库预测靶mRNA分子在卵巢癌中的表达,结果显示与正常样本相比,ULK2分子(t=2.43,P<0.05)和LONP2分子(t=2.49,P<0.05)在卵巢癌中表达明显降低(图2B)。
2.6 lncRNA44372在卵巢癌细胞的表达
qRT-PCR检测结果显示,与卵巢正常HOSEpiC细胞相比,lncRNA44372在卵巢癌细胞A2780(t=13.18,P<0.01),SKOV3(t=12.82,P<0.01),HO8910(t=5.36,P<0.05),OVCR3(t=5.19,P<0.05),3AO(t=4.73,P<0.05)中表达明显下调,且与生物信息学结果一致。见图3。

A:竞争性内源RNA网络构建; B: ULK2和LONP2在卵巢癌组织及正常组织中的表达图2 竞争性内源RNA网络及靶mRNA在卵巢癌组织和正常组织中的表达

a:P<0.05,b: P<0.01,与HOSEpiC细胞比较图3 lncRNA44372在卵巢癌细胞系和卵巢正常细胞中的表达
3 讨论
本研究首先通过NCBI GEO数据库筛选出在卵巢癌中表达具有差异意义的lncRNA44372,并进一步分析与其相关的基因。GO分析和信号通路分析结果显示,lncRNA44372可能与调控细胞迁移、侵袭变化,细胞周期改变,细胞骨架蛋白调控,蛋白苏氨酸/酪氨酸激酶活性的调节等有关。
研究表明,细胞迁移和侵袭变化可促进肿瘤细胞的上皮间质转化过程[8],促进肿瘤转移;细胞周期失控可以使得肿瘤细胞不接受抑制信号,持续增殖[9];细胞骨架蛋白Rho经GDP激活后,可以与下游分子结合使得细胞骨架重排。有文献指出,lncRNA PCGEM1可以通过上调RhoA表达促进卵巢癌的发展[10]。此外,苏氨酸/酪氨酸蛋白激酶活性对肿瘤细胞的迁移具有调控作用。例如,lncRNA-BANCRY通过激活苏氨酸/酪氨酸蛋白激酶,从而通过调节细胞自噬来抑制甲状腺癌细胞增殖[11]。但是,lncRNA44372在上述生物学过程中发挥的作用尚需进一步研究。
通过生物信息学预测,lncRNA44372可能与miR-190,miR-193及下游UBLCP1、PHF20L1、ULK2、MED15、DPY19L1、PYROXD1和LONP2的靶mRNA分子构成竞争性内源RNA网络。在该网络中,与正常组织相比,lncRNA44372呈低表达且像海绵体一样吸附靶miRNA分子,而被吸附的miRNA分子可负向调控靶mRNA分子。因此,只有在卵巢癌中下调表达的mRNA分子才可能发挥作用。
研究发现,ULK2分子在卵巢癌中呈低表达,其主要作用是编码丝氨酸/苏氨酸激酶,并且可以调节细胞代谢和自噬途径[12],该发现与本研究中GO分析结果相一致。此外,LONP2分子同样在卵巢癌中呈低表达。有研究发现,LONP2 在宫颈癌中通过氧化应激促进子宫颈癌细胞增殖、迁移和侵袭[13]。因此推断,lncRNA44372可能与miR-190,miR-193及ULK2和LONP2构成竞争性内源RNA网络。此外,在细胞水平证实lncRNA44372在卵巢癌中呈低表达,与生物信息学预测结果一致。
综上所述,lncRNA44372在卵巢癌组织中呈低表达,可能通过影响卵巢癌细胞凋亡、细胞周期和细胞蛋白激酶活性等促进卵巢癌发展。
