miR-376c-3p通过靶向谷氨酸受体相互作用蛋白1影响乳腺癌细胞的增殖和迁移
2021-09-18王超高雨婷刘子瑶李涛王晶哲刘璐谢岩孙晓春
王超, 高雨婷, 刘子瑶, 李涛, 王晶哲, 刘璐, 谢岩, 孙晓春
(江苏大学医学院, 江苏 镇江 212013)
世界卫生组织国际癌症研究机构最新发布的2020年全球癌症负担数据显示,乳腺癌新发病例高达226万例,超过肺癌的220万例,成为全球第一大癌[1]。随着乳腺癌手术、化疗、放疗、内分泌治疗、免疫治疗及多种联合治疗策略的应用,乳腺癌患者的生存期明显延长[2-4]。然而,仍有许多乳腺癌患者最终出现复发、转移和耐药。
微小RNAs(microRNAs, miRNAs)是一类微小、内源性调节多种生物作用的非编码RNA,参与细胞分化、器官发育、信号转导以及肿瘤发生发展等多种生物学过程[5]。研究发现,miRNAs在多种肿瘤中存在异常表达,并且在肿瘤的增殖、侵袭和转移、血管生成、耐药性以及上皮-间质转化(epithelial-mesenchymal transition,EMT)进程中起重要作用[6-8]。miR-200家族在癌症中的异常表达及其参与EMT进程已得到充分研究。在浸润性乳腺癌中,miR-200与E-钙黏蛋白水平显著相关[9];miR-200家族成员的过表达导致E-钙黏蛋白表达上调,并通过靶向转录因子ZEB1和锌指结构E-bok-结合同源框2(ZEB2)抑制EMT进程[10];miR-145可以通过直接调节N-钙黏蛋白和ZEB2表达抑制胃癌EMT进程[11]。
研究表明,miR-376c-3p在胃癌[12]、肝细胞癌[13]、神经母细胞瘤[14]和口腔鳞癌[15]等多种肿瘤中呈异常表达。miR-376c-3p在抑制胃肿瘤生长及肿瘤相关基因表达中具有重要作用,其在胃癌中表达下调,可靶向SYF2从而抑制胃癌细胞的增殖和迁移[12]。过表达hsa-miR-376c-3p可促进胃癌细胞凋亡和G1期阻滞[16]。miR-376c-3p通过靶向同源框B7(HOXB7)抑制人口腔鳞癌细胞增殖、侵袭、迁移和凋亡[15]。研究发现,miR-376c-3p在三阴性乳腺癌中表达下调[17],但其在乳腺癌中的作用并不明确。因此,本研究中检测其在乳腺癌中的表达水平以及生物学功能,并结合生物信息学探讨其分子调控机制。
1 材料与方法
1.1 细胞系、主要试剂及仪器
人乳腺上皮细胞系MCF-10A购于上海富衡细胞库;人乳腺癌细胞系MCF-7、MDA-MB-231购于中国科学院上海生命科学研究院细胞资源中心。MEGM(瑞士Lonza/Clonetics公司);H-DMEM(美国Gibco公司);胎牛血清(以色列BI公司);胰酶(美国Sigma公司);Trizol及LipofectamineTM3000转染试剂(美国Invitrogen公司);逆转录试剂盒(日本TaKaRa公司);PowerUpTMSYBRTMGreen实时荧光定量PCR试剂盒、荧光定量PCR仪(美国ABI公司);链霉素、青霉素、蛋白质裂解液RIPA、BCA蛋白浓度检测试剂盒、兔抗人E-钙黏蛋白抗体以及兔抗人波形蛋白抗体均购自上海碧云天公司;兔抗人谷氨酸受体相互作用蛋白1(GRIP1)抗体(美国SAB公司);兔抗人GAPDH抗体(美国CST公司);HRP标记羊抗兔IgG(上海爱必信公司)。CO2细胞培养箱(美国Thermo公司);倒置显微镜(日本Olympus公司);酶标仪(美国Biotek公司);化学发光凝胶成像分析系统(美国GE公司)。
1.2 细胞培养和细胞转染
在MEGM中加入100 ng/mL霍乱毒素配制成MCF-10A完全培养基,于37 ℃、5% CO2细胞培养箱中培养人乳腺上皮MCF-10A细胞。
用含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的H-DMEM,于37 ℃、5% CO2细胞培养箱中培养人乳腺癌MCF-7和MDA-MB-231细胞。取生长状态良好的MCF-7和MDA-MB-231细胞常规消化,用无双抗的H-DMEM完全培养基重悬制成单细胞悬液,计数并调整细胞浓度为1×105/mL,在6孔板中加入2 mL细胞悬液,置于37 ℃恒温、5% CO2的饱和湿度培养箱中继续培养;次日待贴壁细胞融合度达到70%左右时根据LipofectamineTM3000转染试剂说明书进行转染。
实验设阴性对照、miR-376c-3p mimic组,每组3个复孔。在EP管中用125 μL无血清培养基稀释7.5 μL的LipofectamineTM3000,在另外EP管中用125 μL无血清培养基稀释100 pmol miR-376c-3p mimic或阴性对照RNA序列;将稀释的mimic或阴性对照RNA序列加入至稀释的LipofectamineTM3000中,室温孵育10~15 min;加入到含有1.75 mL无双抗完全培养基的人乳腺癌MCF-7和MDA-MB-231细胞中轻柔摇匀。转染6 h左右,根据细胞情况进行换液,进行后续实验。
1.3 qRT-PCR检测乳腺上皮和乳腺癌细胞中miR-376c-3p表达水平
按照Trizol试剂说明书提取总RNA,用紫外分光光度仪测定所提RNA浓度。按逆转录试剂盒说明书将RNA逆转录为cDNA,随后以cDNA为模板进行PCR扩增引物,并以U6作为内参,实验设3个复孔,重复3次。所用引物由上海生工生物设计并合成,具体序列如下,miR-376c-3p:上游5′-CGCGCG AACATAGAGGAAATT-3′,下游5′-AGTGCAGGGTCCGAGGTATT-3;U6:上游5′-CTCGCTTCGGCAGCACA-3′,下游5′-AACGCTTCACGAATTTGCGT-3′。qRT-PCR反应条件:50 ℃ 尿嘧啶-DNA糖基化酶激活2 min;95 ℃预变性2 min;95 ℃变性15 s,56 ℃退火15 s,72 ℃延伸1 min,共40个循环。通过2-ΔΔCt计算目的基因相对表达量。
1.4 平板克隆实验检测乳腺癌细胞克隆能力
MCF-7和MDA-MB-231细胞转染6 h后,常规消化收集,计数并调整细胞浓度至500个/孔接种于6孔板,于37 ℃、5% CO2孵箱内培养3~4 d换液;培养10~14 d,PBS洗2~3次,4%多聚甲醛固定细胞30 min;PBS洗2~3遍;结晶紫染色15 min;PBS洗2~3遍;拍照计数并统计分析。
1.5 划痕实验检测乳腺癌细胞迁移能力
MCF-7和MDA-MB-231细胞在6孔板转染后,待细胞融合度达到90%以上时,用200 μL枪头在6孔板中划3条直线,再用无血清培养液漂洗直到无漂浮的细胞为止,置于倒置显微镜下观察并随机选取3个视野拍照(0 h),37 ℃、5% CO2培养箱中继续培养24 h,计算划痕愈合率。划痕愈合率(%)=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%。
1.6 Transwell迁移实验检测乳腺癌细胞迁移能力
在MCF-7和MDA-MB-231细胞转染48 h后,常规消化收集细胞,计数并调整细胞浓度至5×105/mL,在Transwell下室内加入800 μL含10%胎牛血清的H-DMEM完全培养基,在Transwell上室内加入100 μL细胞悬液,于37 ℃、5% CO2孵箱内培养16~24 h;吸干上室内液体,用棉签轻柔除去上室内未迁移细胞,于4%多聚甲醛中固定30 min;结晶紫染色30 min;于显微镜下随机观察5个视野,并进行计数和统计。
1.7 生物信息学分析
通过Starbase网站(http://starbase.sysu.edu.cn/)对miR-376c-3p进行检索,预测其靶基因;然后将预测到的靶基因作为研究对象,使用OncoLnc在线生存分析网站(http://www.oncolnc.org/)对TCGA数据库中浸润性乳腺癌(breast invasive carcinoma,BRCA)进行生存分析,根据GRIP1表达水平中位数将BRCA患者分为GRIP1高表达组与GRIP1低表达组。
1.8 蛋白质印迹实验检测GRIP1、E-钙黏蛋白、波形蛋白表达水平
在MCF-7和MDA-MB-231细胞转染48 h后,PBS洗2~3遍,加入200 μL RIPA裂解液(RIPA ∶PMSF=100 ∶1)裂解细胞,收集细胞裂解液,全程冰上操作;4 ℃,12 000×g离心15 min,取上清液,并用BCA蛋白浓度检测试剂盒定量浓度;根据浓度加入上样缓冲液,100 ℃热变性10 min,分装于-20 ℃保存备用。取50 μg蛋白行10% SDS-PAGE分离蛋白,80 V电泳30 min,待溴酚蓝显示于下层胶后将电压调至110 V,适时终止电泳;然后,以300 mA湿转120 min至PVDF膜;5%脱脂奶粉室温封闭2 h;分别加入兔抗人GRIP1抗体、兔抗人E-钙黏蛋白抗体、兔抗人波形蛋白抗体、兔抗人GAPDH抗体(内参),均1 ∶1 000稀释,4 ℃孵育过夜;TBST洗膜3次,每次10 min;HRP标记羊抗兔二抗(1 ∶5 000稀释)室温孵育2 h;TBST洗膜3次,每次10 min;加入ECL曝光液显影、拍摄并计算灰度值。
1.9 统计学分析

2 结果
2.1 miR-376c-3p在乳腺癌细胞中呈低表达
qRT-PCR检测结果显示,与人正常乳腺上皮MCF-10A细胞相比,miR-376c-3p在乳腺癌MCF-7细胞(t=19.460,P<0.01)和MDA-MB-231细胞(t=34.940,P<0.01)中的表达水平显著降低(图1)。

图1 qRT-PCR法检测miR-376c-3p在不同乳腺细胞系中的表达水平
2.2 miR-376c-3p过表达抑制乳腺癌细胞增殖
qRT-PCR结果显示,miR-376c-3p mimic组乳腺癌MCF-7细胞(t=-15.542,P<0.01)和MDA-MB-231细胞(t=-12.072,P<0.01)miR-376c-3p表达显著上调(图2)。平板克隆形成实验结果显示,与阴性对照组相比,miR-376c-3p mimic组MCF-7细胞(t=4.492,P<0.05)和MDA-MB-231细胞(t=9.055,P<0.01)克隆形成的集落数量明显减少(图3),提示miR-376c-3p能够显著抑制乳腺癌细胞的增殖能力。
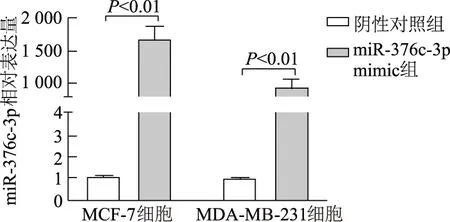
图2 qRT-PCR法检测miR-376c-3p mimic转染效率
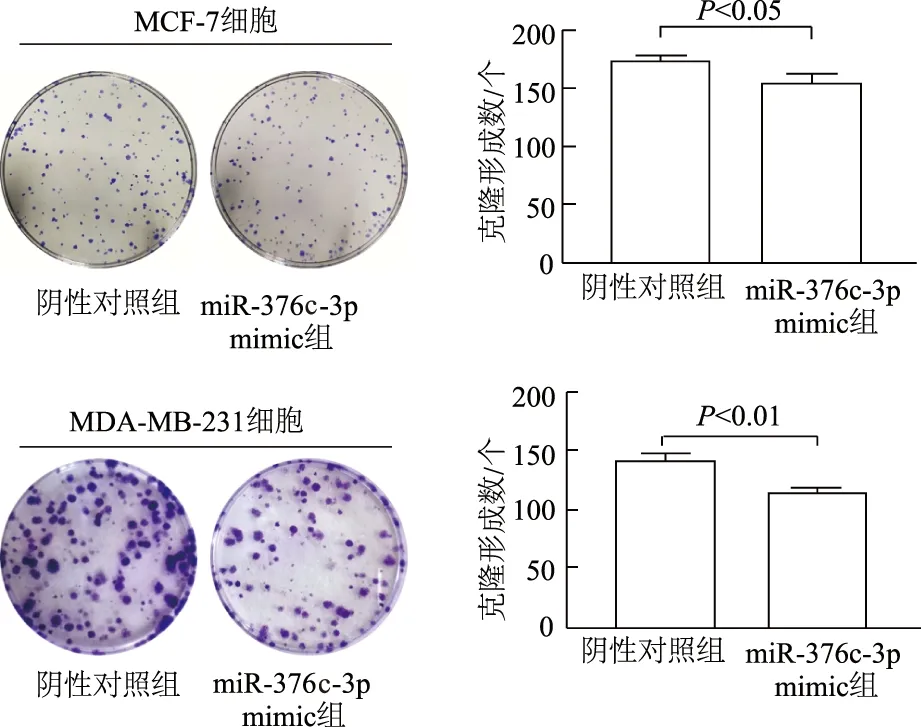
图3 miR-376c-3p对乳腺癌细胞克隆形成能力的影响
2.3 miR-376c-3p过表达抑制乳腺癌细胞迁移和侵袭能力
Transwell迁移实验结果显示,与阴性对照组相比,miR-376c-3p mimic组MCF-7细胞(t=9.999,P<0.01)以及MDA-MB-231细胞(t=9.773,P<0.01)的迁移细胞数显著减少(图4)。划痕实验结果显示,与阴性对照组相比,miR-376c-3p mimic组MCF-7细胞(t=6.042,P<0.01)和MDA-MB-231细胞(t=5.257,P<0.01)划痕愈合率显著降低(图5)。
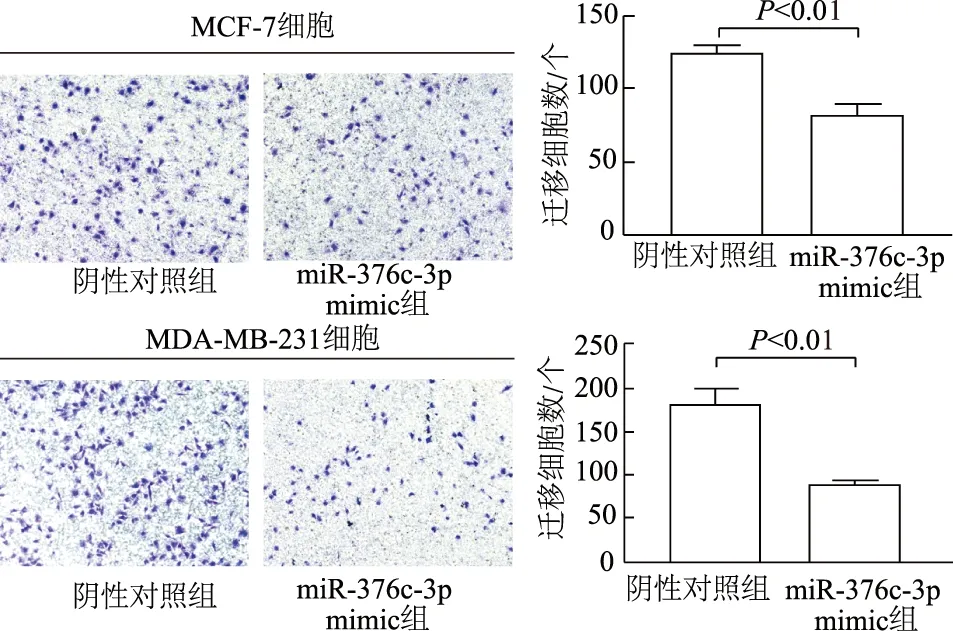
图4 miR-376c-3p对乳腺癌细胞迁移能力的影响(×100)

图5 miR-376c-3p对乳腺癌细胞划痕愈合率的影响(×40)
2.4 miR-376c-3p靶向GRIP1调控乳腺癌细胞EMT相关蛋白的表达
通过生物信息学Starbase网站预测发现miR-376c-3p与GRIP1存在相互结合位点(图6);生存分析结果显示,GRIP1高表达组BRCA患者的总体生存期明显缩短(Cox系数=0.214,P<0.05),GRIP1高表达与患者预后不良有关(图7)。
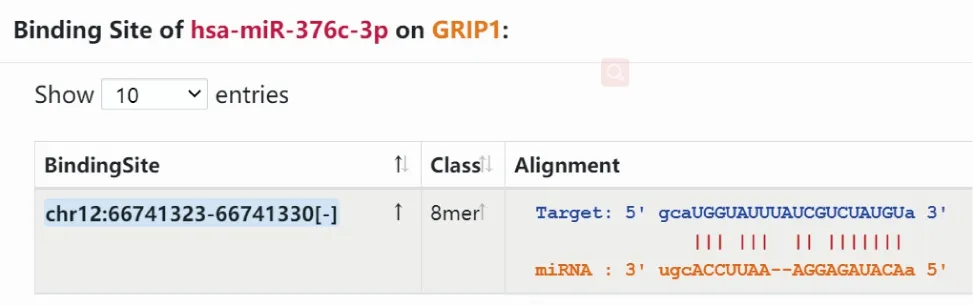
图6 miR-376c-3p与GRIP1相互结合位点

图7 GRIP1表达与BRCA总体生存期的关系
蛋白质印迹实验结果显示,与阴性对照组相比,miR-376c-3p mimic组乳腺癌细胞GRIP1蛋白表达水平显著降低(MCF-7细胞t=10.240,MDA-MB-231细胞t=4.913,P均<0.05);与此同时,EMT相关蛋白E-钙黏蛋白表达水平明显增高(MCF-7细胞t=12.440,MDA-MB-231细胞t=6.444,P均<0.01),波形蛋白表达显著降低(MCF-7细胞t=12.360,MDA-MB-231细胞t=9.023,P均<0.01)。见图8。由此可见,miR-376c-3p可能通过靶向GRIP1抑制乳腺癌细胞EMT进程。

图8 蛋白质印迹实验检测乳腺癌细胞中相关蛋白的表达水平
3 讨论
研究表明,miRNAs是肿瘤恶性转化和转移的重要调控因子[18]。本研究中miR-376c-3p在乳腺癌细胞中表达下调,且下调水平与乳腺癌细胞的恶性程度相关,与之前报道一致[16]。由此提示,miR-376c-3p可能作为乳腺癌新的诊断分子标志物,其表达下调极有可能参与调控乳腺癌的发生发展。为探讨miR-376c-3p在乳腺癌中的生物学功能,本研究利用miR-376c-3p mimic转染乳腺癌MCF-7以及MDA-MB-231细胞,结果显示外源性过表达miR-376c-3p可以显著抑制乳腺癌细胞的生长。此外,Transwell迁移实验以及细胞划痕实验显示,上调乳腺癌细胞中miR-376c-3p表达可以显著抑制细胞的迁移能力。由此表明,在乳腺癌进展中,miR-376c-3p可以作为肿瘤抑制因子抑制乳腺癌细胞的增殖和迁移能力。然而,在肝细胞癌中miR-376c-3p可能发挥致癌作用促进肿瘤进展[13],这可能与肿瘤的异质性以及不同的分子调控机制有关。
miRNAs可通过靶向mRNAs序列的3′-非翻译区广泛参与多种基因的转录后调控过程,进而影响细胞的生物学功能。为进一步分析miR-376c-3p在乳腺癌中的调控机制,本研究通过在线生物信息学网站预测到GRIP1是miR-376c-3p的潜在靶基因;进一步实验发现,miR-376c-3p靶向GRIP1基因调控GRIP1蛋白表达,同时影响乳腺癌EMT相关蛋白的表达水平,进而调控乳腺癌的生物学行为。通过生存分析发现,GRIP1表达水平与乳腺癌患者生存期呈显著负相关,然而,其在乳腺癌中的作用并未明确。此前有报道称,GRIP1可以通过与14-3-3蛋白间相互作用,从而调控神经元物质运输[19]。研究表明,14-3-3蛋白在多种肿瘤中呈异常表达[20],与乳腺癌转移风险密切相关[21-22],有望成为提示乳腺癌患者总生存期和无复发生存期的预后生物标志物[23]。然而,GRIP1是否可以通过14-3-3蛋白进而影响乳腺癌的进展及作用机制尚未明确,仍需深入研究。
综上所述,本研究结果表明miR-376c-3p可能作为肿瘤抑制因子通过靶向GRIP1调控乳腺癌细胞的增殖、迁移以及EMT进程。但是,本研究仅在体外乳腺癌细胞中进行,仍需在临床样本中研究miR-376c-3p对乳腺癌的诊断价值。此外miR-376c-3p与GRIP1在乳腺癌中的生物学功能以及相关信号转导通路的激活还有待于后续进一步研究。
