C-反应蛋白及其基因多态性与妊娠期肝内胆汁淤积症的相关性研究
2021-09-17徐海波罗丽琼陈清梅罗小雨
陆 丽,钟 敏,徐海波,罗丽琼,陈清梅,罗小雨
(广东省深圳市龙华区人民医院妇产中心产科,广东 深圳 518000)
妊娠期肝内胆汁淤积症(Intrahepatic cholestasis of pregnancy,ICP)是一种好发于妊娠中晚期特有的并发症,临床常见症状为皮肤瘙痒、黄疸,同时合并不同程度的血清胆汁酸升高和肝功能受损。数据[1]显示,ICP具有明显的种族性和地域性,我国以长江流域部分地区的发病率较高。ICP的大部分孕产妇可于产后很快恢复,但其对胎儿及新生儿的影响较大,可能造成新生儿窒息、新生儿颅内出血、胎死宫内等不良结局,严重危害胎儿的生命安全。近几年,越来越多学者倾向于探究炎性因子在ICP中的表达水平及临床意义,但是其相关基础研究较少。蒋长斌等人研究[2]发现,ICP中肿瘤坏死因子-α(tumorn ecrosis factoro,TNF-α)、高敏C-反应蛋白(high sensitive C-reactive protein,hs-CRP)等相关指标水平明显升高,同时以上指标可用于评估ICP严重程度及不良结局。据报道[3],白介素-6(intefleuldn,IL-6)、TNF-α在ICP中表达水平异常,多种炎性因子相互作用,可能参与ICP的病理生理过程。目前,临床上缺乏关于C-反应蛋白(C-reaction protein,CRP)及其基因多态性与妊娠期肝内胆汁淤积症疾病的相关性报道。笔者以此为切入点,旨在为临床提供ICP诊疗的新思路,同时为其发病机制提供理论参考依据。
1 资料与方法
1.1一般资料:本研究经院内医学伦理委员会批准,研究对象选取我院 2019年12月~2020年11月纳入我科住院的ICP孕妇50例为观察组,根据血清总胆汁酸水平将观察组孕妇分为ICP轻度组25例和ICP重度组25例,同期选择住院的正常孕妇50例为对照组,纳入标准[4]:①均符合《九版妇产科学》有关ICP的相关诊断;②无皮肤病、尿毒症性瘙痒、妊娠特异性皮炎、过敏性反应等疾病者;③无病毒性肝炎、肝胆石症、急性脂肪肝、子痫前期等疾病者;④知情并签署知情同意书。观察组年龄为20~43岁,平均(31.86±4.63)岁,孕周为34~41周,平均(34.82±4.11)周,BMI 35~37 kg/m2,平均(35.86±0.53)kg/m2;对照组年龄为20~42岁,平均(32.51±4.87)岁,孕周为35~42周,平均(35.21±4.34)周,BMI 36~37 kg/m2,平均(36.86±0.45)kg/m2,两组患者在年龄、孕周、BMI等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
1.2方法:抽取所有产妇空腹外周肘静脉血5 ml,置入一次性抗凝真空采血管(K2- EDTA)中,静置于常温空气中30.0 min,随后放入3 000 r/min离心机中,高速离心15 min,放置于-20℃冰箱中保存待测。本院检验科专业医生使用免疫透射比浊法测定CRP水平以及使用酶联免疫吸附法测定TNF-α、IL-6水平。
在公开的数据库中查询CRP基因SNP信息,测定CRP基因启动子区- 757T/C(rs3093059),-409G/A(rs3093062)、-717A/G (rs2794521)、内含子区的+29A/T(rs1417938)四个位点的基因多态性。多态性包括rs3093059位点:CC、CT、TT型;rs3093062位点:AA型、AG型、GG型;rs2794521位点:AA型、AG型、GG型、rs1417938位点:AA、A/T、TT型。将待测标本恢复至室温,采用全血基因DNA提取试剂盒进行DNA提取,严格按照试剂盒说明书操作步骤操作。采用核酸蛋白测定仪测定DNA的OD值,确定DNA浓度,最后-20°冰箱中备存待测。从外周血单个核细胞(peripheral blood mononuclear cell ,PBMC)中提取总RNA,采用real-time PCR及TaqMan技术对相关SNP进行基因型鉴定。使用TaqMan HT7900实时焚光定量 PCR 仪 (美国加州Applied Biosystems公司 )进行 real-time PCR 。10 μl反应体系(Master Mix 5 μl,正反 向引物各0.2 μl,cDNAl μl,水3.6 μl)在标准反应条件下进行。
1.3判定标准:根据血清总胆汁酸水平将观察组孕妇分为ICP轻度组和ICP重度组,即ICP轻度:①血清总胆汁酸为10~39.9 μmol/L;②主要症状为瘙痒,无其他明显症状。ICP重度:①血清总胆汁酸≥40 μmol/L;②复发性ICP,症状严重且合并多胎妊娠、妊娠期高血压病等其他疾病,既往存在因ICP所致死胎史或新生儿窒息死亡史等病史,满足以上任何一条即为重度。
1.4观察指标:①比较观察组和对照组间血清CRP、TNF-α、IL-6水平差异;②比较对照组和观察组四个位点基因型频率的差异;③比较ICP轻度组和重度组间四个位点基因型频率的差异。
2 结果
2.1观察组和对照组间血清CRP、TNF-α、IL-6水平差异比较:观察组孕妇的CRP、TNF-α、IL-6水平明显高于对照组,差异有统计学意义(P<0.001)。见表1。

表1 观察组和对照组间血清CRP、TNF-α、IL-6水平差异比较
2.2观察组和对照组四个位点基因型频率的差异比较:观察组rs3093059、rs1417938位点基因型频率明显高于对照组,差异有统计学意义(P<0.05),rs3093062、 rs2794521位点基因型频率比较,差异均无统计学意义(P>0.05)。见表2。
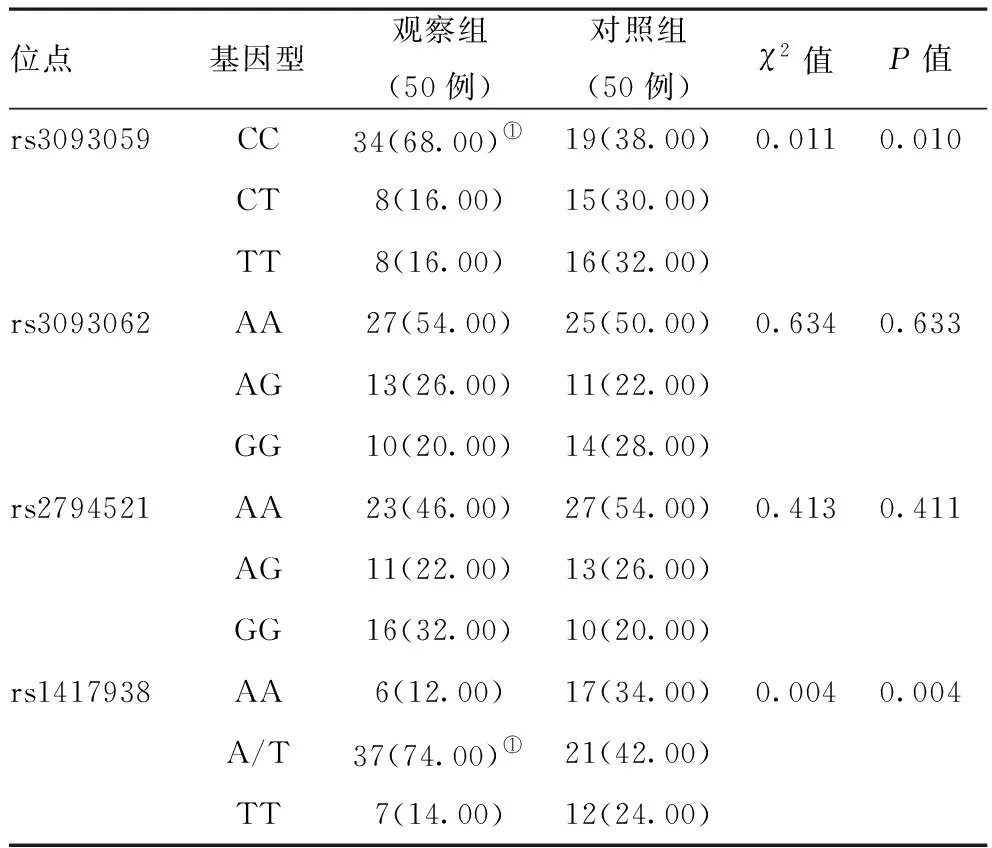
表2 观察组和对照组四个位点基因型频率的差异比较[例(%)]
2.3ICP轻度组和重度组间四个位点基因型频率的差异比较:ICP轻度组和重度组间四个位点基因型频率比较,差异均无统计学意义(P>0.05)。见表3。
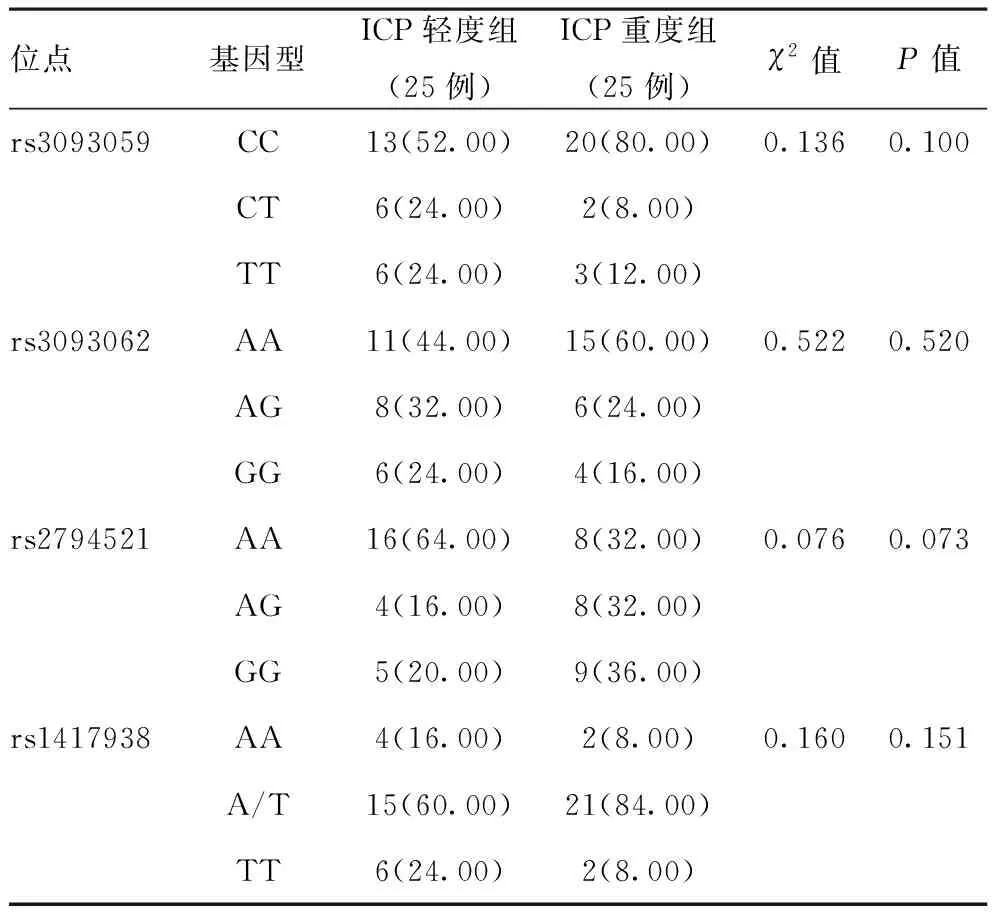
表3 ICP轻度组和重度组间四个位点基因型频率的差异比较[例(%)]
3 讨论
ICP是产科常见妊娠中晚期疾病,对胎儿危害性极大。研究发现,ICP会增加胎儿或新生儿发生不良结局的风险,如早产、死胎、新生儿窒息等不良结局,同时严重影响孕产妇的生活质量[5]。目前,有关ICP的病因和发病机制仍未明确,普遍认为与机体免疫因素、遗传、环境等多因素共同相互作用所致。然而,本研究认为ICP与免疫因素密切相关,其发生可能与孕妇妊娠期间机体免疫平衡失调有关。ICP常发生于妊娠中晚期,考虑妊娠后期胎盘分泌大量雌激素、孕激素、甲状腺激素等阻碍肝细胞进行正常代谢,从而引起肝内胆汁淤积。研究发现,既往存在母亲或姐妹曾患ICP家族史的孕妇患ICP的风险可能会相应的增加[6],符合孟德尔显性遗传规律,表明遗传、环境因素在ICP疾病发生发展过程中充当必要的作用。
研究发现,肝内胆汁淤积症发生环节中以炎性反应最为关键,其中CRP在机体免疫炎性反应过程中发挥重要作用[7]。ICP机体免疫失衡时,其CRP等相关炎性因子水平升高,提示机体合并感染与肝细胞损伤。正常妊娠胎盘组织中可检测TNF-α表达,其表达水平随妊娠结束逐渐恢复正常。IL-6主要是由中性粒细胞、巨噬细胞、树突状细胞等细胞共同作用产生,通过刺激机体产生IL-8、TNF-α等炎性因子,增加NK细胞毒性作用,造成肝脏微循环发生障碍,使得肝细胞发生缺血缺氧,最终导致肝细胞受损[8]。多项研究证实,CRP、TNF-α、IL-6等炎性因子在ICP中呈异常表达水平,可能共同参与ICP疾病发生发展[9-10]。本研究结果发现,观察组孕妇的CRP、TNF-α、IL-6水平明显高于对照组,加以证实以上炎性因子与ICP密切相关。
研究发现,CRP及其基因多态性与多种疾病呈相关性,如急性心肌梗死、出血性脑卒中等疾病,但其CRP基因单核苷酸多态性信息不同[11-12]。根据公开数据库中查询CRP基因单核苷酸多态性信息,发现CRP基因启动子区- 757T/C(rs3093059),-409G/A(rs3093062)、-717A/G(rs2794521)、+29A/T(rs1417938)与CRP水平密切相关。CRP的表达水平受CRP基因多态性影响,其中757T/C (rs3093059)双C/C转录起始水平和CRP水平呈明显相关,+29A/T (rs1417938)与机体CRP水平、炎性反应程度呈明显相关[13-14]。ICP机体通过产生大量的IL-6、CRP等炎性细胞因子,加之自身肝细胞已受损,进一步激发免疫炎性反应,使得胆汁酸、毒素、炎性因子大量蓄积于肝脏,加重肝细胞受损程度[15]。本研究结果显示,观察组rs3093059、rs1417938位点基因型频率明显高于对照组,其中rs3093059位点CC基因型、rs1417938位点A/T基因型频率明显高于对照组,提示以上两种位点的基因型可能与ICP的发生发展有关。CRP基因多态性与ICP的严重程度未见明显差异性,考虑与样本量过小有关,有待进一步探索。
综上所述,CRP、TNF-α、IL-6表达水平在ICP中呈升高趋势,其中rs3093059位点CC基因型、rs1417938位点A/T基因型可能与ICP的发生发展有关,有望成为ICP诊疗的新靶标。
