低氧联合远隔缺血预适应对大鼠缺血再灌注肾损伤的保护作用
2021-09-17梅霄阳闫林轩王勤章李应龙
梅霄阳,闫林轩,李 丽,王勤章,李应龙
(1.石河子大学医学院,新疆 石河子 832000;2.石河子大学医学院第一附属医院,新疆 石河子 832000;3.成都市第五人民医院,四川 成都 610000)
缺血再灌注损伤(Ischemia reperfusion injury,IRI)是指由多种原因引起的组织或器官缺血以及血流灌注恢复造成损伤进一步加重的现象。肾脏作为高灌注器官对IRI较敏感,临床上常见于肾移植、部分肾切除术等过程中[1-2]。肾缺血再灌注损伤是缺血性急性肾损伤的重要损伤环节,尽管目前治疗技术有了明显进步,如血液净化、选择性动脉阻断等技术的开展,但是休克、脓毒症等造成的急性肾损伤仍严重威胁着患者的生命安全。不仅影响移植肾早期功能恢复及长期存活,而且病死率较高[3],但是阻断血流的肾部切除手术仍然是泌尿外科治疗肾肿瘤的主要手段。肾缺血再灌注损伤的病理生理机制十分复杂,如何减轻缺血再灌注过程带来的组织器官损害成为目前临床工作亟需解决的难题。低氧预适应(Hypoxic preconditioning,HPC)和远隔缺血预适应(Remote ischemic preconditioning,RIPC)作为一种新颖的预处理方法成为目前国内外研究的热点,其在多个器官如骨骼肌、肾、肝表现出对IRI的保护作用[4-7]。HPC指预先低剂量非致死性短时间重复低氧处理,诱发机体获得对随后急性致死性损伤的耐受能力。RIPC即预先在远离缺血脏器的其他组织或器官实施短时间缺血再灌注处理增加对长时间缺血的抵抗力的过程。然而,低氧联合远隔缺血预适应对肾缺血再灌注损伤是否存在协同保护作用及其机制,目前尚缺乏相关报道。
1 材料与方法
1.1主要仪器及试剂:TUNEL试剂盒(武汉博士德生物过程有限公司);Bcl-2兔多克隆抗体、Caspase3兔多克隆抗体(Abcam公司),APY-250IM恒温恒湿低氧舱(杭州得聚仪器设备有限公司);医用弹力绷带;正置荧光显微镜(Olympus)。
1.2研究方法
1.2.1肾脏IRI模型制备:参考本实验室既往方法,实验大鼠术前禁食6 h,以3%戊巴比妥钠50 mg/kg麻醉成功后,将其俯卧位固定,常规手术区消毒、铺巾,暴露并游离肾脏,切除右侧肾脏,分离左侧肾动脉,无创动脉夹夹闭肾动脉,避免损伤周围大血管及输尿管,观察肾脏由鲜红色逐渐变为暗红色,说明缺血成功,反之缺血失败。持续缺血45 min,恢复血流,再灌注24 h。
1.2.2实验动物及分组:选择健康清洁级SD雄性大鼠40只,体重250~300 g之间,周龄12周左右,由新疆医科大学实验动物中心提供,动物标准SPF级。动物实验经过本院动物管理和使用委员会批准。随机均分五组,假手术组,切除右肾,仅暴露左肾;缺血再灌注组,低氧预适应组,缺血再灌注前将实验动物置于恒温恒湿低氧舱内,正常光照,充入氮氧混合气体,将氧浓度维持在12%,15 h/d(17∶00~8∶00),持续4周;远隔缺血预适应组,缺血再灌注前24 h用医用弹力绷带施加对左下肢圆形压缩的10 min缺血和10 min再灌注3个循环;低氧预适应联合远隔缺血预适应组,缺血再灌注模型制备前24 h,先进行低氧预适应,再进行对左下肢的10 min缺血和10 min再灌注3个循环。
1.2.3组织处理与标本采集:各组大鼠造模过程中如出现死亡,以同等方法补充。所有动物造模实验前6 h禁食,允许自由饮水。再灌注24 h后,进行组织处理及标本采集,戊巴比妥钠行腹腔麻醉,行下腔静脉采血,取血后打开胸腔,用冰盐水经左心室反复灌洗肾脏至颜色苍白,取出左侧肾脏,去除被膜,行纵轴冠状面剖开,置于4%多聚甲醛固定48 h。
1.2.4肾功能血生化检测:采集的大鼠血标本,离心后取上清液送往石河子大学第一附属医院检验科。采用全自动生化分析仪检测血清尿素氮(BUN)、肌酐(SCr)水平。
1.2.5肾组织病理学检查:取出多聚甲醛固定的肾组织,脱水透明,石蜡包埋,切片后行HE染色,200倍光镜下观察病理形态并摄片,进行Paller评分[8]。评分标准为:肾小管扩张明显计1分;肾小管上皮细胞肿胀或扁平1分;刷状缘损伤1分;刷状缘脱落2分;管型形成2分;肾小管管腔存在脱落、坏死(尚未形成管型或细胞碎片)1分;肾小管正常0分。由专业的病理医师每个视野随机选择10个肾小管,参照评分标准评估损伤程度。
1.2.6TUNEL法检测肾细胞凋亡:TUNEL染色后,400倍荧光显微镜下观察,每张片子随机选取5个不重叠的视野拍照,阳性细胞为绿色荧光,采用ImageProPlus6.0图像分析系统统计各类细胞数,取其平均值计算凋亡指数。细胞凋亡指数(AI)=阳性细胞数/细胞总数×100%。
1.2.7免疫组化检测肾组织caspase3和bcl-2蛋白表达:取石蜡切片,严格参照试剂盒实验步骤操作,免疫组化染色后,阳性细胞胞质呈棕黄色,于400倍光镜下观察切片,每张切片随机选择5个视野,应用显微成像系统采集图像,并采用ImageProPlus6.0对图像进行半定量分析,计算各组caspase3和bcl-2阳性细胞的平均光密度值(IOD/Area)。
2 结果
2.1肾功能血生化检测结果:缺血再灌注组、低氧预适应组、远隔缺血预适应组及低氧联合远隔缺血预适应组血清BUN和Scr水平均较假手术组升高,差异有统计学意义(P<0.05);与缺血再灌注组比较,低氧预适应组、远隔缺血预适应组及联合组BUN和Scr水平显著降低,差异有统计学意义(P<0.05);而与低氧预适应或远隔缺血预适应组比较,联合组对肾功能水平改善更明显,差异有统计学意义(P<0.05)。见表1。
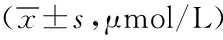
表1 各组大鼠血生化BUN和Scr水平
2.2肾组织病理改变:HE染色后光镜下可见假手术组结果清晰,无明显异常,肾小管上皮细胞排列整齐,刷状缘完好,管腔未见管型及管腔堵塞。缺血再灌注组组织结构明显紊乱,可见肾小管扩张明显,上皮细胞出现不同程度肿胀及空泡变性,部分刷状缘消失,管腔出现坏死脱落的细胞甚至管型,肾间质充血以及炎细胞浸润。低氧预适应组和远隔缺血预适应组肾小管扩张程度减轻,上皮细胞坏死及管型减少。偶见间质充血及炎细胞浸润。联合组肾脏病理损害明显减轻,仅表现为肾小管轻度扩张,偶见管型。见图1。Paller评分见表2。

注:A:假手术组;B:缺血再灌注组;C:低氧预适应组;D:远隔缺血预适应组;E:低氧联合远隔缺血预适应组图1 各组大鼠肾组织病理改变(×200)

表2 各组大鼠肾组织Paller评分(n=8)
2.3肾脏细胞凋亡情况:假手术组组织中极少数细胞发生凋亡,低氧预适应和远隔缺血预适应组均可减轻缺血再灌注损伤导致的细胞凋亡。而与低氧预适应和远隔缺血预适应相比,联合组的细胞凋亡水平显著降低。见图2。凋亡指数见表3。
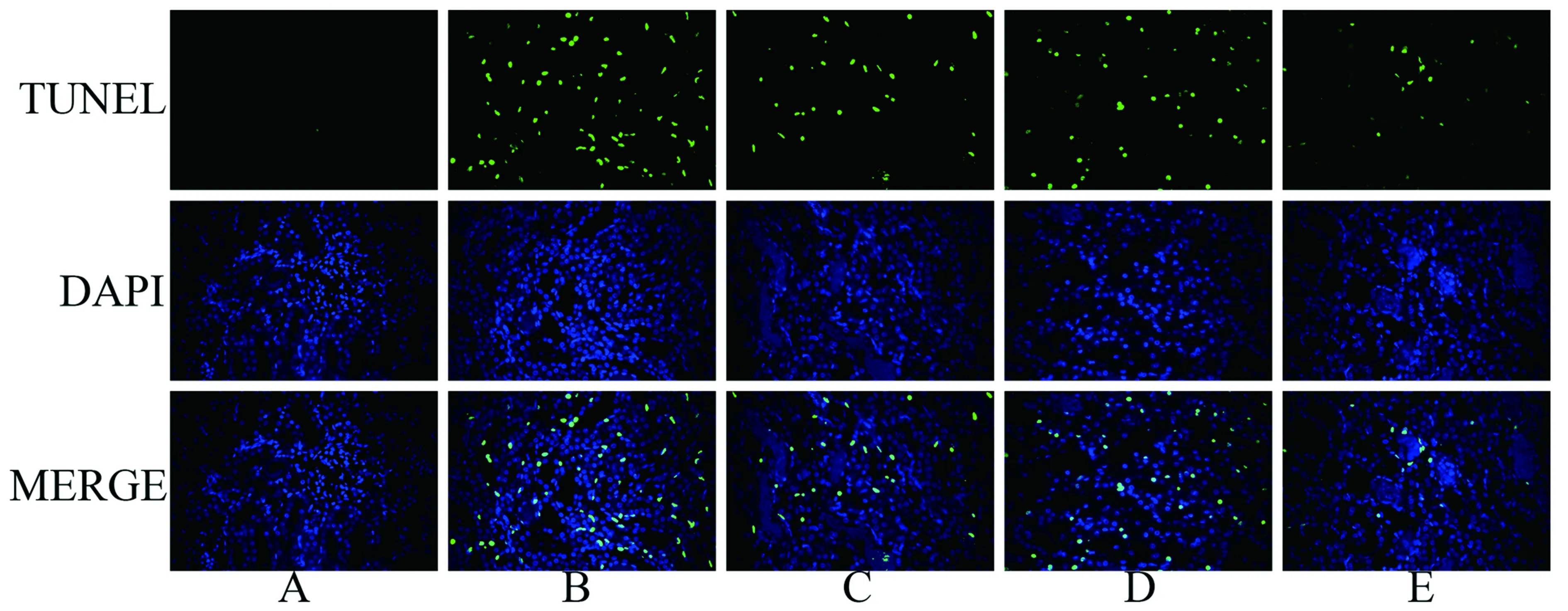
注:A:假手术组;B:缺血再灌注组;C:低氧预适应组;D:远隔缺血预适应组;E:低氧联合远隔缺血预适应组图2 各组大鼠肾组织细胞凋亡情况(×400)

表3 各组大鼠肾组织细胞凋亡指数(n=8)
2.4免疫组化观察Caspase3和Bcl-2蛋白的表达水平:与假手术组相比,肾缺血再灌注组大鼠的Caspase3表达升高,Bcl-2表达降低;与缺血再灌注组相比,低氧预适应和远隔缺血预适应组Bcl-2表达升高,Caspase3表达降低;而与低氧预适应和远隔缺血预适应组相比,联合组Bcl-2表达明显升高,而Caspase3表达降低,差异有统计学意义(P<0.05)。见图3。平均光密度值见表4。

注:A:假手术组;B:缺血再灌注组;C:低氧预适应组;D:远隔缺血预适应组;E:低氧联合远隔缺血预适应组图3 各组大鼠Caspase3和Bcl-2表达情况(×400)
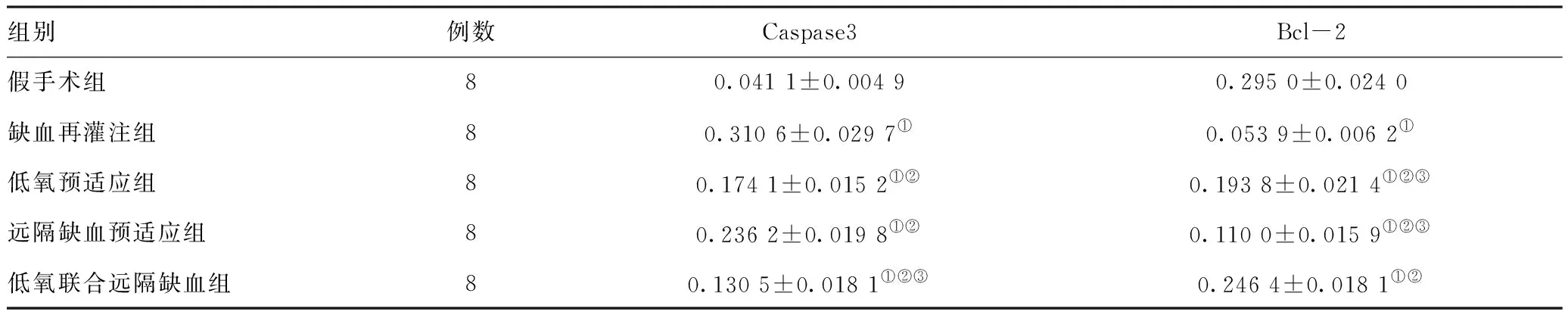
表4 各组大鼠Caspase3和Bcl-2平均光密度值(IOD/Area)(n=8)
3 讨论
肾脏IRI是一种临床常见的病理生理过程,目前国内外对于如何减轻肾脏IRI进行了大量研究,部分成果已经运用到了临床工作中,但大多是药物干预或者直接干预肾脏本身。药物干预如雌激素等副作用较大,且随着患者年龄增长可能出现对药物代谢率降低[9]。直接对肾脏干预不仅临床操作不方便,而且是一种有创操作,且增加手术时间。低氧预适应和远程缺血预适应作为新兴的非药物干预措施已经在多个器官如肝、肾、脑等表现出对IRI的保护作用。不仅操作简便,费用较低,而且对患者损伤较小。本实验联合应用低氧预适应及远隔缺血预适应探讨了其对肾脏是否存在协同保护作用及其机制。
大量研究认为雌激素对肾IRI具有保护作用,因此笔者选择雄性大鼠作为研究对象保证样本均一性,也有证据表明这种性别对肾IRI敏感性更高。本实验结果显示肾IRI组BUN、Scr水平较假手术组明显升高,说明模型构建成功。与肾IRI组比较,低氧预适应组、远隔缺血预适应组及联合组上述指标降低。同时,光镜下病理形态结果可见细胞坏死、水肿程度等明显减轻,提示两种预适应均能减轻肾IRI,改善肾功能。且与两种单独预适应相比,两者联合对肾功能及病理形态改善更明显。
肾缺血再灌注损伤发病机制十分复杂,常见的有氧化应激、炎性反应、钙超载以及细胞凋亡等,近年来大量研究表明,细胞凋亡在缺血再灌注过程中占重要地位,是肾IRI的重要环节[10-11]。抑制细胞凋亡过程可以有效预防肾IRI的发生。本实验TUNEL法结果显示与肾IRI组相比,低氧预适应组、远隔缺血预适应组及两者联合组细胞凋亡指数AI明显降低,说明三种干预措施在一定程度上均能减少大鼠肾组织细胞凋亡。与低氧预适应或远隔缺血预适应组比较,两者联合细胞凋亡更少。查阅文献,肾IRI过程中的细胞凋亡由一系列繁琐的级联反应所引起,有多种凋亡相关蛋白参与,而Bcl-2和Caspase3是其中重要的两种凋亡蛋白[12]。大量证据表明在肾IRI过程中提升Bcl-2的表达可以抑制细胞凋亡,而抑制内源性Bcl-2蛋白的表达或者消除Bcl-2反而会促进细胞凋亡加重肾IRI[13]。本实验过程免疫组化结果显示,与肾IRI模型组比较,低氧预适应、远隔缺血预适应及联合组Bcl-2蛋白表达增多,两者联合组增多更明显,差异有统计学意义(P<0.05),且其与各组间细胞凋亡趋势相反,两者联合组细胞凋亡较少,这表明低氧预适应及远隔缺血预适应在肾IRI过程中可能通过提高Bcl-2表达减少细胞凋亡从而改善肾IRI。
目前较多研究认为半胱氨酸天冬氨酸蛋白酶Caspase依赖的细胞凋亡是缺血再灌注损伤过程中诱导细胞凋亡的重要途经。激活的Caspase以瀑布式的活化方式活化,而Caspase3是其中最关键的一种蛋白酶。Caspase3是一种在正常细胞以无活性酶原形式存在的蛋白酶,其位于细胞凋亡下游,是各种细胞凋亡通路的必经之路。受多种凋亡刺激因素介导后激活,活化的Caspase3可引起一系列细胞形态学变化,如细胞固缩、凋亡小体形成和DNA分解等,最终促使细胞凋亡发生[14]。天然或合成的Caspase3抑制剂可以显著减轻甚至阻断多种刺激引起的细胞凋亡[15]。本实验免疫组化结果显示,肾IRI组Caspase3蛋白表达明显升高,低氧预适应、远隔缺血预适应及联合组Caspase3蛋白表达较肾IRI模型组降低。与低氧预适应或远隔缺血预适应相比,两者联合组降低更明显。Caspase3蛋白表达与各组间细胞凋亡分布一致。说明低氧预适应及远隔缺血预适应能够通过抑制Caspase3表达来抑制细胞凋亡发生。
综上所述,低氧预适应及远隔缺血预适应均能降低肾IRI,且低氧联合远隔缺血预适应对肾IRI改善更明显,其机制可能是通过下调Caspase3表达和上调Bcl-2蛋白表达,从而抑制细胞凋亡有关。但其对肾IRI过程细胞凋亡的具体调控机制仍待进一步研究。
