脓毒症大鼠急性肾损伤炎性因子的表达水平及意义
2021-09-17张文超
曾 民,佟 晶,张文超,凌 林
(南华大学附属第二医院,湖南 衡阳 421001)
脓毒症(sepsis)是严重感染导致宿主反应失调,进而引起致命性多器官功能障碍的危重疾病[1],其同时出现了组织低灌注,这是由于致病原微生物侵入机体并繁殖以及其代谢产物在机体内引起微循环障碍从而诱导严重的炎性反应及多器官功能障碍[2],据统计全球每年超过1 800万严重脓毒症患者,且每年按1.5%~8.0%的速度增多。目前数据也显示在重症监护病房中有超过50%的多脏器功能障碍与脓毒症有关,并且其中50%~66% 的脓毒症患者会发生急性肾损伤(AKI),并且其病情发展迅速,病死率高[3-4],所以脓毒症致 AKI 的高发病率和高病死率已成为重症医学科面临的重要难点和挑战。目前对于脓毒症性急性肾损伤与抑制促炎因子的合成和释放的上游信号转导的调控机制尚不清楚,因此本研究以AKI 模型大鼠为载体,考察脓毒症大鼠NF-κB 信号通路中关键信号传导蛋白的影响,进一步探讨AKI病症下可能的炎症反应作用靶点及调控机制,为后续临床用药研究提供理论依据。
1 资料与方法
1.1一般资料:选取雄性 SD大鼠40只,SPF级,体重 20~28 g,由南华大学动物实验中心提供。实验采用LPS(美国 Sigma 公司)及TNF-a、IL-6、IL-10 酶联免疫吸附(ELISA)试剂盒(美国 eBioscience 公司)和p65、IκBα 抗体(英国 Abcam 公司)。
1.2研究方法
1.2.1动物模型建立及分组:40只大鼠随机分为对照24 h组,对照48 h组,模型24 h组和模型48 h组各10只,对照24 h组和对照48 h组大鼠予以腹腔注射生理盐水2 ml,模型24 h组和模型48 h组大鼠予以腹腔注射脂多糖(15 mg/kg) 2 ml建立脓毒症急性肾损伤模型。对照24 h组及模型24 h组于建模术后24 h后取大鼠肾脏标本并冻存,采集大鼠的静脉血;对照48 h组及模型48 h组于术后48 h后取标本,本研究经过本院医学伦理委员会同意。
1.2.2血清炎性因子(TNF-a、IL-6、IL-10)水平检测:ELISA 检测大鼠静脉血中 TNF-a、IL-6、IL-10含量,两组均取处死大鼠静脉血3 ml,2 000 r /min离心10 min,分离所得血清置于-80 ℃ 冰箱备检。TNF-a、IL-6、IL-10检测操作严格按试剂盒说明书进行。
1.2.3血清肌酐(SCr)水平及大鼠小便肾损伤分子-1(KIM-1)表达水平检测:采用ELISA法检测大鼠血清KIM-1表达水平,方法同上,反应结束后各孔于波长 450 nm 的酶标仪上读取光密度(D)值。采用全自动多功能生化分析仪按照步骤进行检测大鼠血清SCr水平。
1.2.4蛋白免疫印迹法检测肾组织中p65,IκBα蛋白表达水平:称取适量冻存的大鼠肾组织,用RIPA裂解液提取蛋白,并用BCA 法测定蛋白浓度。各组取总蛋白样品50 μg,然后行12% SDS聚丙烯酰胺凝胶电泳( SDS PAGE),再用湿法转膜法转至硝酸纤维素滤膜上后予以5% 脱脂牛奶封闭 2 h,TBST 洗涤后加入一抗稀释液( 1∶1 000),4 ℃孵育1夜。次日 TBST 洗涤后加入辣根过 氧化物酶 ( HRP)藕联的羊抗兔 IgG( 1∶1 000),室温孵育2 h。TBST 洗膜3次后ECL法显色,于凝胶成像系统中采集图像信息分别计算NF-κB p65及核因子及IκBα蛋白相对表达量,实验重复3次结果取平均值。
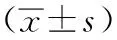
2 结果
2.1各组大鼠炎性因子水平比较:模型24 h组及模型48 h组大鼠水平炎性因子水平高于对照组,差异均有统计学意义(P<0.05),模型48 h组IL-10较模型24 h组下降明显,但TNF-a、IL-6上升明显,差异均有统计学意义(P<0.05)。见表1。

表1 各组大鼠炎性因子水平比较
2.2各组大鼠p65,IκBα蛋白磷酸化水平比较:模型24 h组及模型48 h组大鼠p65,IκBα蛋白磷酸化水平高于对照组大鼠,差异均有统计学意义(P<0.05);并且模型48 h组较模型24 h组上升明显,差异有统计学意义(P<0.05)。见表2。

表2 各组大鼠p65,IκBα蛋白磷酸化水平比较
2.3各组大鼠肾功能比较:模型48 h组大鼠KIM-1、SCr水平高于对照48 h组大鼠,差异均有统计学意义(P<0.05);且模型24 h组KIM-1水平高于对照24 h组,差异有统计学意义(P<0.05);但模型24 h组SCr水平与对照24 h组比较差异无统计学意义(P>0.05)。见表3。

表3 各组大鼠肾功能比较
3 讨论
脓毒血症在临床上是一种十分常见的能够导致机体多个脏器功能发生损伤的病理过程,其发病机制非常复杂[5],目前大家多支持全身炎性反应网络效应是其重要因素,由感染等多种诱因导致机体免疫失衡,被炎性反应网络进行级联放大,最终导致全身炎性反应综合征[6-7],AKI是其严重的常见并发症之一。KIM-1是一种肾脏近曲小管上皮细胞表达的跨膜蛋白,在正常肾脏内表达极低,近年有研究表明KIM-1可作为急性肾损伤的早期特异性生物标志[8]。本实验中数据显示早期模型24 h组与对照24 h组SCr差异无统计学意义(P>0.05),模型24 h组及模型48 h组KIM-1表达水平较对照24 h组、对照48 h组均明显升高(P<0.005),再次证明KIM-1可以用作早期监测评价肾功能的有效指标。LPS是革兰阴性菌外膜的主要成分,可作为脓毒症动物模型建立的主要致病原,能诱导中性粒细胞、巨噬细胞等免疫细胞及产生大量炎性因子和氧自由基[9]。 TNF-α、IL-6和 IL -1β 是先天免疫系统对感染最初反应的重要促炎因子,能够引发细胞因子风暴的发生,并放大机体的炎性反应级联反应。 本研究发现,模型24 h组及模型48 h组TNF-α、IL-6 水平较对照24 h组、对照48 h组均明显升高(P<0.05),IL-10是一种由B细胞刺激激活的内源性抑炎因子,由B细胞、T细胞和巨噬细胞产生,可以抑制免疫反应及应答。实验中模型24 h组及模型48 h组IL-10高于对照组,差异均有统计学意义(P<0.005),但模型48 h组IL-10较模型24 h组下降明显,而TNF-a、IL-6上升明显,差异均有统计学意义(P<0.05)。结合实验中大鼠肾功能改变说明脓毒血症早期引起大量释放促炎因子,并导致后期抗炎因子的不足及促炎因子的级联反应,再次证明TNF-α、IL-6 及 IL-10参与了脓毒血症性AKI的发生、发展过程。
NF-κB 是早期诱导炎性因子释放的核转录因子,在静息状态下,NF-κB p65 和胞浆内的抑制蛋白IκB结合以无活性的复合物形式存在。当机体遭受刺激后,IκB发生磷酸化并降解,与NF-κB p65二聚体解离,使NF-κB p65 磷酸化再转移至胞核内,从而调控炎性因子等基因的转录和表达[9]。本实验结果表明,AKI 模型大鼠肾组织中p65,IκBα蛋白磷酸化水平均显著升高(P<0.05),并且随着时间的推移,大鼠肾组织中p65,IκBα蛋白磷酸化水平升高更加明显(P<0.05),且TNF-α、IL-6及IL-10水平较对照组也显著上升(P<0.05),但模型48 h组IL-10较模型24 h组下降明显(P<0.005),表明脓毒症后期大鼠出现免疫抑制表现,表明模型大鼠肾组织中 NF-κB信号通路被激活,进而促进了下游炎性因子的转录表达。
综上所述,NF-κB是脓毒症发生发展过程中的重要通路,是一种多效性、多向性的调控因子,是致炎-抗炎的核心通路,在脓毒症的发生发展过程中发挥着至关重要的作用,所以通过本研究可试想寻找一种抑制 NF-κB 通路的药物治疗脓毒症。
