食管癌细胞来源的外泌体促进人脐静脉血管内皮细胞血管生成
2021-09-17施晋升王茂松李本忠张秀梅
施晋升, 王茂松, 李本忠, 张秀梅
(南京医科大学康达学院附属兴化医院心胸外科, 江苏 兴化 225700)
食管癌是我国最常见的消化系统肿瘤之一,其发病率居恶性肿瘤的第5位,死亡率居第4位。我国2018年食管癌新发患者和死亡患者分别为25.8万和18.5万,均占全球的55%左右[1-2]。食管癌的术后复发以及癌细胞的转移是导致食管癌患者死亡的重要因素之一,而肿瘤血管形成与肿瘤的侵袭、浸润和转移密切相关,直接影响肿瘤患者的预后[3]。研究表明肿瘤细胞可产生血管形成因子,促进血管内皮细胞增殖,刺激毛细血管生长[4]。然而,肿瘤组织中调控血管内皮细胞血管形成过程的具体机制尚不清楚[5]。外泌体是直径为30~150 nm的细胞外囊泡,含有核酸、蛋白质等多种生物大分子,作为细胞间信息交流的重要载体[6],其在组织损伤和肿瘤发生发展、复发转移的各个过程中发挥重要作用[7-12]。本研究拟观察食管癌细胞EC109分泌的外泌体(EC109-ex)促进人脐静脉血管内皮细胞(HUVECs)血管形成的作用。
1 材料与方法
1.1 试剂和仪器
食管癌细胞株EC109和 HUVECs购自中国科学院上海生命科学研究院细胞库;H-DMEM、胎牛血清、胰酶(美国Gibco公司);小鼠抗人CD9抗体、CD63抗体(德国Millipore公司),小鼠抗人CD31抗体、兔抗人CD34抗体、兔抗人VEGF抗体(美国Abcam公司);兔抗人β-肌动蛋白抗体、HRP标记山羊抗兔/小鼠IgG二抗(北京康为世纪生物科技有限公司);CM-DiR染料(美国Invitrogen公司); hoechest33342染料(美国Sigma公司);外泌体快速提取试剂(美国SBI公司);BCA蛋白提取和浓度检测试剂盒(上海碧云天生物科技有限公司);Transwell小室(美国Corning公司); Matrigel基质胶(美国BD公司);PVDF膜、100 kDa MWCO超滤离心管(德国Millipore公司);CO2培养箱(美国Forma公司);ImageQuant LAS4000mini化学发光成像分析系统(美国GE公司); HT7800透射电镜(日本HITACHI公司); TE300倒置式生物显微镜(日本Nikon公司)。
1.2 细胞培养
EC109和HUVECs细胞采用含10 %胎牛血清的H-DMEM,置于37 ℃、5% CO2培养。
1.3 EC109-ex提取
收集处于对数生长期的EC109细胞上清液,采用梯度-超速离心法提取EC109-ex。4 ℃、10 000×g离心30 min去除细胞碎片,上清液用100 kDa MWCO超滤管过滤;4 ℃、1 000×g离心30 min获得含EC109-ex的浓缩液;加入外泌体快速提取试剂,4 ℃沉淀过夜;4 ℃、1 500×g离心30 min,收集沉淀,PBS洗涤后重悬于PBS,分装后-80 ℃冻存备用。
1.4 透射电镜观察EC109-ex结构
取50 μL EC109-ex滴于载样铜网,室温静置2 min,滴加1%磷钨酸溶液(pH=6.8)复染5 min,室温风干后透射电镜下观察EC109-ex形态。
1.5 蛋白质印迹法检测外泌体和血管形成标志蛋白表达
1.5.1 EC109-ex外泌体表面标志CD9、CD63检测 取EC109-ex样品,加入RIPA/PMSF/PIC蛋白裂解液,冰上摇床混匀10 min,超声法裂解4次;4 ℃、15 000×g离心15 min,收集上清液获得蛋白。BCA法检测蛋白浓度,加入上样缓冲液,煮沸10 min。取蛋白样品50 μg进行10% SDS-PAGE,小鼠抗人CD9抗体(1 ∶500)、小鼠抗人CD63抗体(1 ∶500)、兔抗人β-肌动蛋白抗体(1 ∶2 000)4 ℃孵育过夜;TBS/T洗涤,加入HRP标记的山羊抗兔/小鼠IgG(1 ∶3 000),37 ℃孵育1 h;TBS/T洗涤,超敏ECL发光法显色,经化学发光成像分析系统曝光并分析结果。
1.5.2 HUVECs血管标志蛋白检测 HUVECs经5 μg/mL和10 μg/mL EC109-ex处理48 h后,提取总蛋白,变性处理后,取蛋白样品20 μg,经电泳、转膜、洗涤封闭,分别结合小鼠抗人CD31抗体(1 ∶1 000)、兔抗人CD34抗体(1 ∶1 000)、兔抗人β-肌动蛋白抗体(1 ∶2 000)、兔抗人VEGF抗体(1 ∶500),4 ℃孵育过夜,洗涤,山羊抗兔/小鼠IgG(1 ∶3 000)孵育2 h,超敏ECL发光法检测蛋白条带。
1.6 HUVECs摄取CM-DiR染料标记的EC109-ex
CM-DiR染料(5 μL/mL)加入EC109-ex,充分混匀后于37 ℃避光孵育30 min。孵育结束后混合液转移至100 kDa MWCO超滤离心管,加入10倍体积PBS,轻柔吹打混匀,4 ℃、1 500×g离心30 min,去除未结合的CM-DiR 染料,收集超滤离心管中的浓缩液,经0.22 μm的滤器除菌后置于新的EP管中,即为CM-DiR染料标记EC109-ex。将HUVECs以3×104/mL密度接种于细胞玻片,待细胞完全贴壁后加入CM-DiR染料标记的EC109-ex,37 ℃孵育48 h。以4%多聚甲醛室温固定30 min,PBS洗涤,加入Hoechst33342染核10 min,PBS洗涤,封片后采用荧光显微镜观察CM-DiR标记的EC109-ex在HUVECs内定位。
1.7 Transwell侵袭实验
5 μg/mL和10 μg/mL EC109-ex处理24 h的HUVECs经0.25%胰蛋白酶消化,无胎牛血清H-DMEM制成细胞悬液,调整细胞密度为3×105/mL,充分混匀后,加入铺有Matrigel胶的 Transwell小室,下室加入600 μL含10%胎牛血清的H-DMEM,37 ℃培养12 h。取出Transwell小室,棉签去除未透膜细胞,置于4%多聚甲醛室温固定30 min,结晶紫染色10 min,于显微镜下观察拍照,随机选取上下左右高倍镜视野进行细胞计数。重复实验5次,取每视野平均数作为实验结果。
1.8 细胞成管实验
吸取Matrigel基质胶100 μL均匀平铺于24孔细胞培养板孔底,置于37 ℃恒温培养箱中3~4 h,使基质胶充分凝固。胰蛋白酶消化HUVECs,用含10%胎牛血清的H-DMEM重悬细胞,终浓度为1.0×105/mL。实验组加入5 μg/mL和10 μg/mL的EC109-ex,对照组加入等体积PBS。EC109-ex或PBS作用24 h后HUVECs(5.0×104个)均匀接种于基质胶上,37 ℃恒温培养箱培养24 h,倒置生物显微镜下观察并拍摄管腔形成。重复实验5次,采用Image J软件对每组管样结构的节点、血管分支数和总长度进行计数。
1.9 统计学方法
2 结果
2.1 EC109-ex的鉴定及EC109-ex在HUVECs内的分布
透射电子显微镜观察显示,EC109-ex为球形的膜性小囊泡,膜结构完整,直径为70~150 nm(图1A)。蛋白质印迹结果证实EC109-ex表达外泌体特异性标志物CD9和CD63(图1B)。采用CM-DiR染料标记EC109-ex,进行外泌体摄取实验,荧光显微镜下可见经CM-DiR染料标记的EC109-ex分布在HUVECs胞质及核周围。表明EC109-ex可被HUVECs摄取(图1C)。
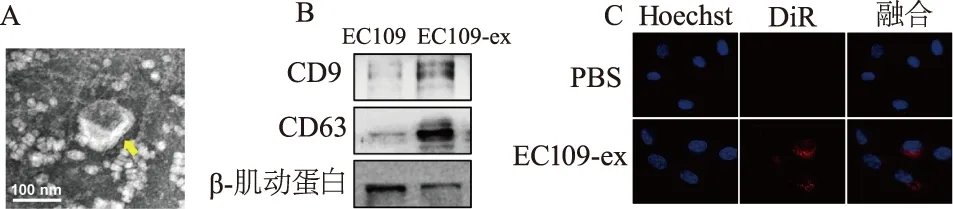
A:透射电镜观察EC109-ex结构(×30 000); B: 蛋白质印迹检测外泌体标志蛋白; C: 荧光显微镜观察CM-DiR染料标记的EC109-ex在HUVECs内分布(×400)
2.2 EC109-ex促进HUVECs的侵袭
Transwell实验结果显示,与对照组相比,EC109-ex 5 μg/mL刺激24 h后实验组侵袭细胞数目显著增加,而EC109-ex 10 μg/mL组侵袭细胞数目更多(图2)。由此提示EC109-ex能够显著提升HUVECs的侵袭能力。
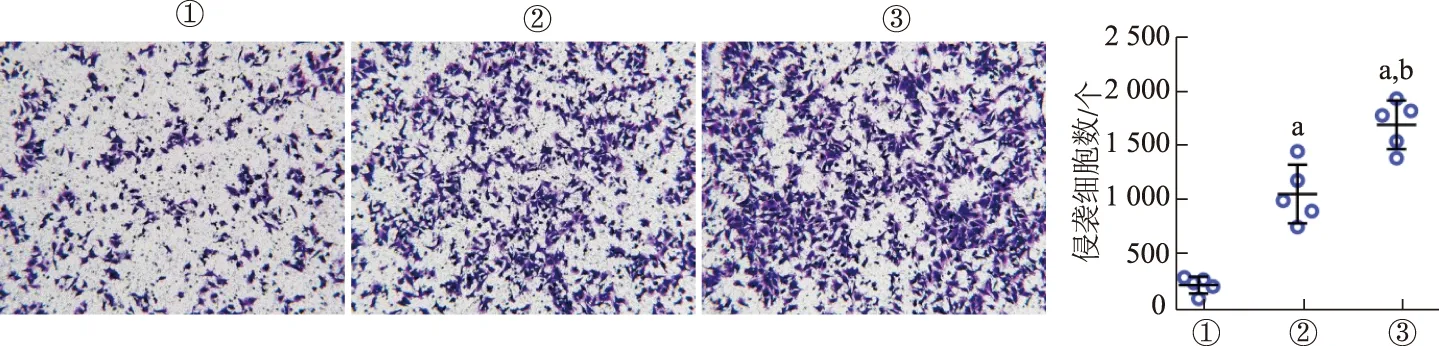
①:对照组;②:EC109-ex 5 μg/mL组;③:EC109-ex 10 μg/mL组。a: P<0.01,与对照组比较;b: P<0.01,与5 μg/mL组比较图2 Transwell实验检测EC109-ex促进HUVECs的侵袭(×40)
2.3 EC109-ex促进HUVECs的小管形成
倒置生物显微镜观察显示,对照组HUVECs小管形成较少,仅可见不完全闭合的多边形。而EC109-ex处理组含有闭合的管腔样血管形态,EC109-ex 10 μg/mL组的成管腔样血管形态较5 μg/mL组更加完整。与对照组相比,EC109-ex处理组的成管数、交叉点数明显增加,EC109-ex 10 μg/mL组增加更加明显。见图3。结果表明EC109-ex可促进HUVECs的成管能力。
2.4 EC109-ex促进HUVECs血管形成特异标志表达
蛋白质印迹结果显示,与对照组相比,EC109-ex 5 μg/mL作用组HUVECs CD31、CD34表达上调,而10 μg/mL作用组CD31、CD34和VEGF表达都显著上调,见图4。由此表明EC109-ex可促进HUVECs的血管形成相关标志物的蛋白表达。
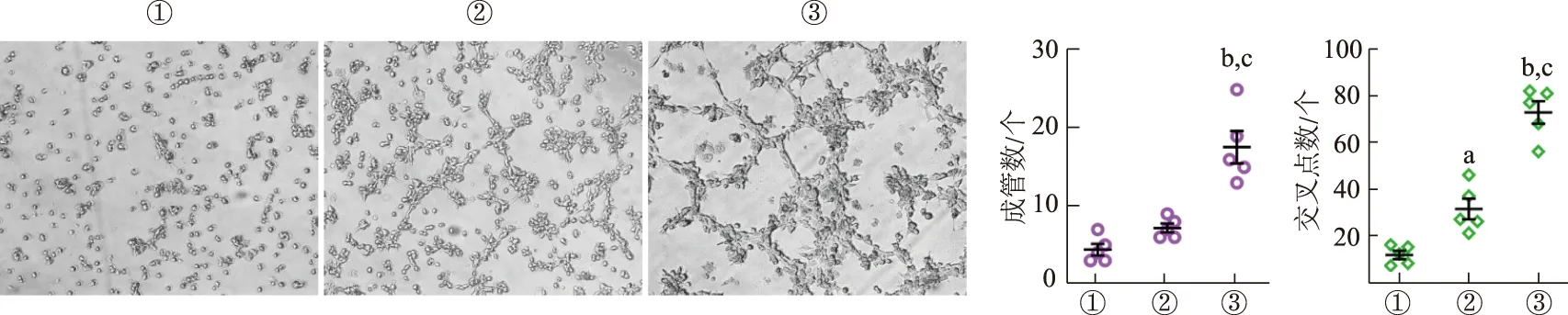
①:对照组;②:EC109-ex 5 μg/mL组;③:EC109-ex 10 μg/mL组。a: P<0.05,b: P<0.01,与对照组比较;c: P<0.01,与5 μg/mL组比较图3 EC109-ex促进HUVECs的小管形成(×40)
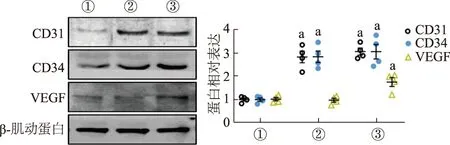
①:对照组;②:EC109-ex 5 μg/mL组;③:EC109-ex 10 μg/mL组。a: P<0.01,与对应的对照组比较
3 讨论
食管癌的发病率和致死率较高,总体预后差,5年生存率为15%~25%[1-2,13]。食管癌细胞的高侵袭性和易转移性是影响患者预后的主要因素。血管生成在食管癌等肿瘤细胞增殖、侵袭、迁移和转移过程中发挥着关键作用。肿瘤血管一方面为新生的肿瘤细胞提供新陈代谢所需的氧气、蛋白质和其他营养物质,同时也可以促进肿瘤细胞从原发部位向远处转移、定居,导致肿瘤恶化[14]。研究表明,肿瘤细胞通过旁分泌效应调控血管周围环境和内皮细胞增殖、迁移。抑制食管癌血管新生是食管癌治疗的重要组成部分。
外泌体含有来源细胞的各种核酸、蛋白质、脂质、细胞因子等[6, 15],是细胞间通讯的信息载体。肿瘤细胞分泌的外泌体在肿瘤血管生成和转移过程中发挥重要作用[9, 16]。研究表明乳腺癌细胞可通过外泌体向细胞外转运miR-939,下调血管内皮细胞钙黏蛋白,增加体外血管通透性[17]。结直肠癌外泌体可转运miR-25-3p,下调内皮细胞血管内皮细胞生长因子受体2(VEGFR2)、紧密连接蛋白(tight junction protein 1, TJP1)等表达,提高血管通透性[18]。缺氧条件可刺激肺癌细胞分泌外泌体,通过转运miR-23a抑制内皮细胞TJP1,增加血管通透性和癌细胞转移[19]。也有研究表明,胶质母细胞瘤[20]、肝癌[21]、胰腺癌[22-23]、鼻咽癌[24]和胃癌[25]等多种肿瘤细胞来源的外泌体含有各种长链非编码RNA和蛋白质,可诱导毛细血管出芽、新生,是新生血管形成的有效诱导剂。抑制肿瘤细胞来源的外泌体分泌,则可抑制肿瘤的增殖、迁移和肿瘤血管生成[26-27]。目前,有关食管癌细胞外泌体调控血管内皮细胞成管的报道较少。本实验研究结果表明,与对照组比较,EC109-ex在孵育30 min后即可被HUVECs成功摄入。EC109-ex作用后HUVECs的侵袭能力明显提升,成管能力显著增加。这些结果提示EC109-ex可进入血管内皮细胞,促进血管内皮细胞的侵袭和成管能力。
CD31、CD34是肿瘤研究中常用的血管内皮细胞标志物[28]。同时,CD31存在于内皮细胞间紧密连接处,参与血管生成和整合素的激活。CD34分子是高度糖基化的Ⅰ型跨膜糖蛋白,选择性地表达于人类及其他哺乳动物的内皮细胞表面,在介导内皮细胞间黏附中发挥着重要作用。VEGF可通过促进受体介导的毛细血管内皮细胞增殖从而诱导毛细血管管腔形成,还可通过自分泌及旁分泌途径引起血管通透性增加,改变肿瘤细胞间隙,在肿瘤细胞迁移和侵袭中起重要作用,是食管癌过度表达的血管新生刺激因子[29-30]。本研究结果证实EC109-ex能够促进HUVECs的CD31、CD34和VEGF的蛋白表达,提示EC109-ex的促血管形成作用可能与其调控VEGF的表达有关。然而,EC109-ex在动物模型中是否具有类似的促血管效果需要进一步证实。此外,EC109-ex中发挥促血管形成的关键分子及其相关调控机制仍有待进一步探讨。
综上所述,本研究初步证实了食管癌细胞来源外泌体能够进入内皮细胞,诱导其侵袭、小管形成,并上调血管标志物和血管生长因子的表达。这为进一步靶向食管癌细胞释放外泌体,建立食管癌治疗的有效手段提供了重要的思路和方向。
