骨髓间充质干细胞输注对MRL/lpr狼疮鼠B淋巴细胞CXCR4表达的影响
2021-09-17马翠汤郁程孟微史伟郑文娟裘影影芮金兵王燕茹
马翠, 汤郁, 程孟微, 史伟, 郑文娟, 裘影影, 芮金兵, 王燕茹
(江苏大学附属医院风湿免疫科, 江苏 镇江 212001)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种临床表现多样、发病机制复杂的慢性自身免疫性疾病[1],B细胞异常活化使人体产生大量自身抗体及免疫复合物是其主要发病机制[2]。相关研究指出CXC趋化因子受体4(CXCR4)与趋化因子CXCL12特异性结合形成CXCL12/CXCR4轴,启动细胞内信号传导系统,参与B细胞产生、分化及趋化作用,从而参与SLE的发生发展[3-4]。
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)是一种多能、非造血的基质前体细胞,具有显著的多潜能分化和免疫调节特性[5],广泛用于移植治疗多种疾病。有多个临床研究证明异基因BMMSCs治疗SLE可获得较好的疗效[6-7],而关于其改善病情的机制尚待进一步探究。现有的研究表明间充质干细胞输注可能是通过分泌免疫调节因子和下调辅助性T细胞17(T-helper cell 17,Th17)分化来实现对病情的控制[8]。间充质干细胞改善病情与CXCR4相关的治疗机制仍未见报道。本研究检测BMMSCs输注后MRL/lpr狼疮鼠血浆IgG、C3水平,肾脏病理的改善以及狼疮鼠B细胞、浆细胞表面CXCR4表达的变化,旨在探究BMMSCs输注改善SLE疾病活动与CXCR4之间的联系,为控制SLE病情进展提供新的思路。
1 材料和方法
1.1 材料
MRL/lpr鼠(SPF级)15只, 4~5周龄,雌性,购自上海灵畅生物科技有限公司,动物许可证号:SCXK(沪)2018-0003。C57BL/6 小鼠(SPF级)5只,6 周龄,雌性,购自江苏大学实验动物中心,许可证号:SCXK(苏)2018-0012。实验小鼠于江苏大学动物实验中心SPF级饲养区饲养至20周龄。
胎牛血清、低糖DMEM 培养液(美国Sigma公司);B220-PE(骨髓),CD19-PE(外周血、脾脏),CD138-APC荧光抗体(美国BD公司);CXCR4-FITC荧光抗体、驴抗山羊IgG(美国Abcam公司);流式细胞仪CANTO10C(美国BD公司);IgG、C3 ELISA试剂盒(美国SAB公司)。
1.2 细胞培养
从C57BL/6小鼠的股骨和胫骨中冲洗出骨髓,将全部骨髓细胞置于含有20%胎牛血清的低糖DMEM中,置于37 ℃、5%CO2的培养箱中进行原代培养。根据全骨髓贴壁筛选法获取BMMSCs,培养48 h后全量换液,去除没有贴壁的细胞,之后每3天半量换液1次。待原代细胞生长至汇合度达80%~90%时,用0.25%的胰蛋白酶消化传代。扩增至第3代用于BMMSCs输注实验。
1.3 实验动物分组
实验动物分为4组,每组5只小鼠,分别为C57BL/6组(C57BL/6鼠未进行尾静脉输注)、MRL/lpr组(MRL/lpr鼠未进行尾静脉输注)、BMMSCs组(MRL/lpr 鼠于12周龄尾静脉注射 BMMSCs)、PBS组(MRL/lpr鼠于12周龄尾静脉注射PBS);经尾静脉注射 BMMSCs的浓度为1×106个/mL PBS,按0.01 mL/g体重计算注射剂量,PBS组注射相同体积的PBS,所有动物统一在20周龄末处死。
1.4 ELISA法测定血浆C3和IgG浓度
取小鼠外周血500~1000 μL于EDTA抗凝管,2 500 r/min高速离心5 min,留取上层血浆200~400 μL,按SAB公司配套试剂盒说明书具体操作测定IgG、C3浓度。
1.5 流式细胞仪检测小鼠外周血、骨髓和脾脏B细胞、浆细胞表面CXCR4表达比例
经各组小鼠眼球内眦的眼眶静脉丛采集外周血,从股骨和胫骨中分离骨髓,并取脾脏研磨过筛,使用含5%胎牛血清的PBS缓冲液重悬、离心,裂解红细胞后进行有核细胞计数,每份标本检测1×106个细胞;在100 μL细胞悬液体系中,对B细胞-CD19/B220、浆细胞-CD138直标荧光单抗4 ℃避光孵育20 min,CXCR4先于4 ℃孵育一抗20 min,洗涤后4 ℃避光孵育FITC荧光二抗20 min,于流式细胞仪检测。
1.6 HE染色观察小鼠肾脏组织病理变化
分别将4组小鼠处死后取肾脏,首先经过组织固定、脱水、浸蜡、包埋、切片等处理,再按照购自宝灵科公司的HE染色试剂盒操作说明进行染色,在光学显微镜下观察各组肾脏组织病理变化,最后拍照留存。
1.7 统计学方法
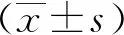
2 结果
2.1 MRL/lpr狼疮鼠与C57BL/6鼠血浆C3 、IgG浓度及B细胞、浆细胞表面CXCR4表达差异
ELISA 结果显示,MRL/lpr 组血浆中补体C3浓度较C57BL/6鼠明显明显降低(t=4.094,P<0.01),IgG浓度明显升高(t=3.997,P<0.01)。 见图1。流式细胞分析结果显示,MRL/lpr组外周血CXCR4+CD19+细胞比例较C57BL/6鼠明显降低(t=5.296,P<0.01),CXCR4+CD138+细胞比例在两组间无统计学差异;与C57BL/6鼠相比,MRL/lpr组骨髓CXCR4+B220+细胞比例(t=3.594,P<0.01)和CXCR4+CD138+细胞比例(t=3.486,P<0.05)均明显升高;MRL/lpr组脾脏CXCR4+CD19+(t=4.021,P<0.01)和CXCR4+CD138+细胞比例(t=4.492,P<0.01)均明显升高。见图2。

图1 ELISA检测小鼠血浆C3、IgG浓度

图2 流式细胞术检测小鼠外周血、骨髓、脾脏B细胞和浆细胞CXCR4表达水平
2.2 BMMSCs输注对MRL/lpr狼疮鼠血浆C3、IgG浓度的影响
ELISA结果显示,3组小鼠血浆C3浓度比较总体差异有统计学意义(F=15.92,P<0.01),BMMSCs组较PBS组、MRL/lpr组血浆C3浓度明显升高(P<0.01);3组小鼠血浆IgG浓度比较总体差异有统计学意义(F=14.40,P<0.01),BMMSCs组较PBS组、MRL/lpr组血浆IgG浓度均明显降低(P<0.01)。见图3。
*:P<0.01,与BMMSCs组比较图3 输注BMMSCs后MRL/lpr狼疮鼠血浆C3、IgG浓度的变化
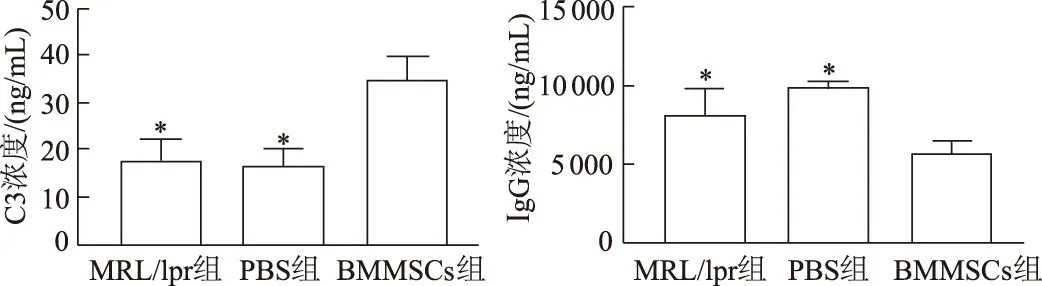
2.3 BMMSCs输注对MRL/lpr狼疮鼠B细胞、浆细胞表面CXCR4水平的影响
3组小鼠B细胞表面的CXCR4表达在外周血(F=7.43,P<0.05),骨髓(F=14.54,P<0.01)和脾脏(F=12.84,P<0.01)的总体差异均有统计学意义。BMMSCs组较PBS组B细胞表面CXCR4表达在外周血明显增加(P<0.01),在骨髓(P<0.01)和脾脏(P<0.05)明显下降;较MRL/lpr组在骨髓和脾脏表达均明显下降(P均<0.01)。
3组小鼠浆细胞表面CXCR4表达在骨髓(F=9.34,P<0.05)和脾脏(F=7.25,P<0.05)的总体差异有统计学意义。 BMMSCs组较PBS组、MRL/lpr组浆细胞表面CXCR4表达在骨髓和脾脏比例均明显降低(P均<0.05)。而3组外周血CXCR4+CD138+细胞比例总体差异无统计学意义(F=1.13,P>0.05)。见图4。


A:外周血;B:骨髓;C:脾脏。*:P<0.01,#:P<0.05,与BMMSCs组比较
CXCR4+浆细胞比例
2.4 BMMSCs输注对MRL/lpr狼疮鼠肾脏组织病理损伤的影响
HE染色结果显示,C57BL/6组肾脏结构完整,未见明显炎性细胞浸润;MRL/lpr组肾脏组织破坏,肾小球、肾小管以及肾间质均出现不同程度损伤,可见肾小球系膜增生、白细胞浸润,肾小管出现肿胀、萎缩等改变,间质局部少量纤维组织增生以及大量炎症细胞浸润。与PBS组、MRL/lpr组相比,BMMSCs组肾脏中肾小球系膜增生减轻,肾间质内炎性细胞浸润明显减少,肾小管肿胀程度减轻,总体上肾脏的病理损伤程度明显改善。见图5。

箭头示大量炎性细胞浸润的肾小球及肾间质图5 小鼠肾脏组织HE染色结果(×200)
3 讨论
SLE是典型的慢性、全身性自身免疫疾病,研究表明SLE患者血浆C3和IgG水平高低及其变化程度与病情严重程度和变化密切相关[9]。MRL/lpr狼疮模型鼠含有Fas基因隐性突变,与人类红斑狼疮相似,包括显著的血清自身抗体、免疫复合物肾小球肾炎、血管炎等[10],是较好的代表SLE的动物模型。本实验观察到MRL/lpr狼疮鼠血浆IgG浓度明显高于正常对照组C57BL/6小鼠,C3较C57BL/6小鼠呈现显著低水平,狼疮鼠肾脏HE染色表现为肾小球、肾小管及肾间质的多重损伤。这与SLE患者血浆IgG、补体C3较健康者的表达水平趋势一致,也与狼疮性肾炎患者的肾脏病理表现相近。
SLE临床治疗主要是以糖皮质激素及免疫抑制剂为主,尽管在治疗策略和后期护理已有改进,但该疾病仍呈现易复发的特点,甚至仍有部分患者因持续的免疫抑制治疗及药物不良反应累积死于严重的出血及感染[11]。BMMSCs输注作为新的治疗手段已在临床实行,因其低免疫原性、无免疫排斥的特点,已有多个临床试验证明BMMSCs输注能够安全有效地改善SLE患者的病情,且自体移植和异体移植都易成功[6-7,12]。本实验发现BMMSCs组较PBS组和MRL/lpr组小鼠血浆IgG水平降低,C3水平升高,且HE染色提示输注BMMSCs后肾脏病理明显改善。证明BMMSCs 输注可以有效控制狼疮鼠病情活动。
BMMSCs 输注改善SLE病情的机制目前认为主要为以下几点:① 抑制包括T细胞、B细胞、自然杀伤细胞等多种免疫细胞的增殖与活化,影响免疫因子分泌[7];② 调节转化生长因子-β(transforming growth factor β,TGF-β)的表达从而下调Th17水平以发挥疗效[8];③ 通过可溶性细胞因子影响B淋巴细胞表面趋化因子的表达[7]。近年来研究显示,狼疮患者的骨髓微环境存在一定缺陷,包括BMMSCs结构异常及功能减退[13]、B细胞分化及迁移异常[4]、抗体分泌相关细胞因子表达紊乱[14]等。本研究显示MRL/lpr 狼疮鼠外周血B细胞CXCR4表达水平低下,在骨髓表达水平升高。我们的前期研究发现SLE患者骨髓上清分泌更高水平的趋化因子CXCL12,提示狼疮骨髓微环境存在多方面的缺陷。CXCR4作为CXCL12的受体,二者相互作用参与了SLE患者 B细胞活化、浆细胞的产生以及自身抗体的分泌[15],由此推测狼疮病情活动时骨髓内环境可能分泌大量CXCL12,导致CXCR4+B细胞向骨髓迁移,因此在外周血中呈低水平。同时本研究中狼疮鼠骨髓CXCR4+CD138+比例高于C57BL/6小鼠,这与Hanaoka等[4]、Ma等[16]研究中浆细胞表面CXCR4的表达结果相一致。浆细胞是B细胞活化的结果,有研究显示骨髓浆细胞可能是狼疮耐药或者复发的原因之一[17],骨髓CXCR4+CD138+细胞比例增高对SLE的意义有待深入研究。
有学者证实脾脏CXCL12、CD54及IL-6等联合作用影响B细胞的迁移,并将浆细胞吸引至脾脏,促其保留和发挥功能[18]。Wang等[19]证实病情活动期小鼠脾脏高表达CXCL12。本研究中MRL/lpr狼疮鼠脾脏CXCR4+CD19+细胞、CXCR4+CD138+细胞比例较C57BL/6小鼠均明显升高,再次证明了CXCR4-CXCL12相互作用参与狼疮鼠疾病活动。
本研究进一步比较了MRL/lpr狼疮鼠输注BMMSCs后外周血、骨髓及脾脏中CXCR4+B细胞、CXCR4+浆细胞比例的差异,结果显示,输注BMMSCs后CXCR4+B细胞比例在外周血表达增高,在骨髓、脾脏中明显下降;同时,输注BMMSCs可显著降低骨髓、脾脏中CXCR4+浆细胞比例。因此,我们推测BMMSCs输注可能通过纠正MRL/lpr狼疮鼠B细胞、浆细胞表面CXCR4的异常表达,减少自身抗体分泌、降低IgG水平以及增加C3等免疫复合物的产生,从而改善肾脏损伤,减缓病情的进展。
综上所述,本研究结果表明狼疮鼠CXCR4+B细胞、CXCR4+浆细胞在外周血、骨髓及脾脏中分布异常,同种异体BMMSCs输注可纠正其分布。本研究对BMMSCs输注治疗改善狼疮疾病活动与CXCR4相关机制进行了探索,为SLE患者的治疗提供了新思路。
