基于液相色谱-串联质谱平台测定血清皮质醇的实验方法与质量评估
2021-09-17王菀叶
王菀叶
(南京市第一医院核医学科,江苏 南京 210006)
皮质醇是神经内分泌系统疾病的生物标志物,其过度分泌与库欣综合征有关,而皮质醇缺乏与艾迪生病有关。皮质醇参与了人体的葡萄糖代谢、血压调节等基础过程[1],在人体功能良好运转中起到重要的作用。近年来,许多精神健康相关的研究也将皮质醇检测纳入其中[2-3]。因此,血清皮质醇检测具有重要的临床价值。
电化学发光免疫分析法是目前广泛应用的皮质醇检测方法,其优点是自动化程度高,检测迅速快捷且重复性好,而免疫学检测法主要的两个缺点是特异性差和交叉反应。由于皮质醇主要是以与皮质醇结合球蛋白(cortisol-binding globulin,CBG)结合的形式存在于血液循环中,免疫法检测的皮质醇浓度实际上大于血液中游离态的皮质醇浓度[4]。而且库欣综合征的女性患者数与男性患者数比为10 ∶1[5],女性怀孕期间CBG明显升高,因此,免疫学检测方法并不能真实反映患者的皮质醇水平。另外,可的松、 17α-羟孕酮(17α-OHP)和地塞米松对免疫法检测有交叉反应的干扰[6]。而异嗜性抗体等干扰物质会使免疫学检测到的皮质醇浓度偏低[7]。相较而言,高效液相色谱-串联质谱(HPLC-MS/MS)平台对皮质醇等类固醇物质的检测有更好的准确性和特异性。美国国家标准技术研究院(the National Institute of Standards and Technology,NIST)的Tai等[8]在HPLC-MS/MS平台建立了血清皮质醇的检测方法,并提出将质谱法作为检测皮质醇的参考方法。Keevil等[9]提出液相色谱的高分离性能与质谱平台的高选择性能强强联合,更加适合类固醇物质的检测。朱宇清等[10]建立并验证了质谱方法适用于血清皮质醇的检测。鉴于目前国内相关临床检测方法和质量评价研究报道较少,有必要开发和验证血清皮质醇的HPLC-MS/MS分析规范,为建立中国人群的健康参考标准提供借鉴。
本研究详细介绍了在HPLC-MS/MS平台上如何建立检测血清皮质醇的实验方法及实验参数的优化过程。在性能验证与质量评估中,引入了Westgard等[11]推荐的六西格玛分析,更直观地对实验方法做出评价,对实验室质量管理提供了更有针对性的参考。
1 材料与方法
1.1 样品与质控品
纯皮质醇冻干粉(批号Q3880-000)、皮质醇-d4冻干粉(批号Q3880-040)为澳大利亚PM Separations公司产品;12个皮质醇外部质控样品(编号为35-01至35-12)为澳大利亚皇家检验学会质控品(The Royal College of Pathologists of Australasia Quality Assurance Programs, RCPAQAP),浓度依次为988,34,427,614,239,801,427,34,988,239,614和801 nmol/L,为美国赛默飞科技公司产品。
1.2 仪器与耗材
1290 Infinity高效液相色谱仪,6490 三重四级杆质谱仪,Poroshell 120 EC-C18分析柱(3.0 mm×50 mm, 粒径2.7 μm,批号B13236)均为美国安捷伦公司产品。甲醇(LC级 、批号1.06018.4000),乙酸乙酯(批号1.00868.2500),正己烷(LC级,批号1.04391.2500)均为德国默克集团产品;甲基叔丁基醚(Methyl tert-butyl ether,MTBE)批号34875,为美国生命科学与高科技集团公司产品;SeraCon类血清稀释剂为澳大利亚Abacus ALS公司产品。
1.3 储备液、工作液、标准品与质控品的制备
称取纯皮质醇冻干粉0.010 2 g,加入500 mL甲醇中,制成浓度为56 280 nmol/L的皮质醇储备液;称取皮质醇-d4冻干粉0.002 g,加入1 000 mL甲醇中,制成浓度为5 580 nmol/L的内标物储备液。将两种储备液储存于-18 ℃。
将355 μL 皮质醇储备液风干后加入10 mL 类血清稀释剂,制成浓度为2 000 nmol/L的皮质醇工作液;取2 509 μL内标物储备液加入7 491 μL甲醇,制成浓度为1 400 nmol/L的内标物工作液。用皮质醇工作液和类血清稀释剂配置6个水平的标准品,浓度分别为0,400,800,1 200,1 600和2 000 nmol/L。低、中、高3个水平的质控品浓度分别为100,500和1 500 nmol/L。
1.4 血清样本的预处理
吸取血清样本80 μL,水(LC级)80 μL,甲醇80 μL,内标物储备液80 μL,加入1.5 mL离心管内,涡旋振荡1 min,瞬时离心后加入液液萃取的溶剂1 mL,涡旋振荡5 min, 室温下3 000 r/min离心5 min,将500 μL上清液转移至干净的1.5 mL离心管中,36 ℃在生物安全柜内风干,用200 μL甲醇溶解后涡旋混匀20 s,转入上样瓶。
1.5 实验条件
使用正离子模式的电喷雾离子源(electrospray ionization, ESI),多反应监测模式(multiple reaction monitoring, MRM)进行监测分析,雾化气体为氮气,雾化气压力为60 psi,脱溶剂温度为350 ℃,离子源温度维持在150 ℃,锥孔电压40 V。液液萃取的溶剂、碰撞能量、流动相梯度、流速、柱温与进样量分别通过详细的优化实验选择。
2 结果
2.1 实验参数的优化
2.1.1 液液萃取的溶剂选择 使用正己烷、乙酸乙酯和MTBE溶剂做皮质醇的液液萃取,比较皮质醇峰的高度、形状和背景干扰。本实验中正己烷未能萃取出皮质醇,图1比较了MTBE与乙酸乙酯萃取的皮质醇峰,由于乙酸乙酯萃取出了疑似为同分异构体的杂峰,被认为萃取不稳定,最终选取MTBE作为本实验的溶剂。
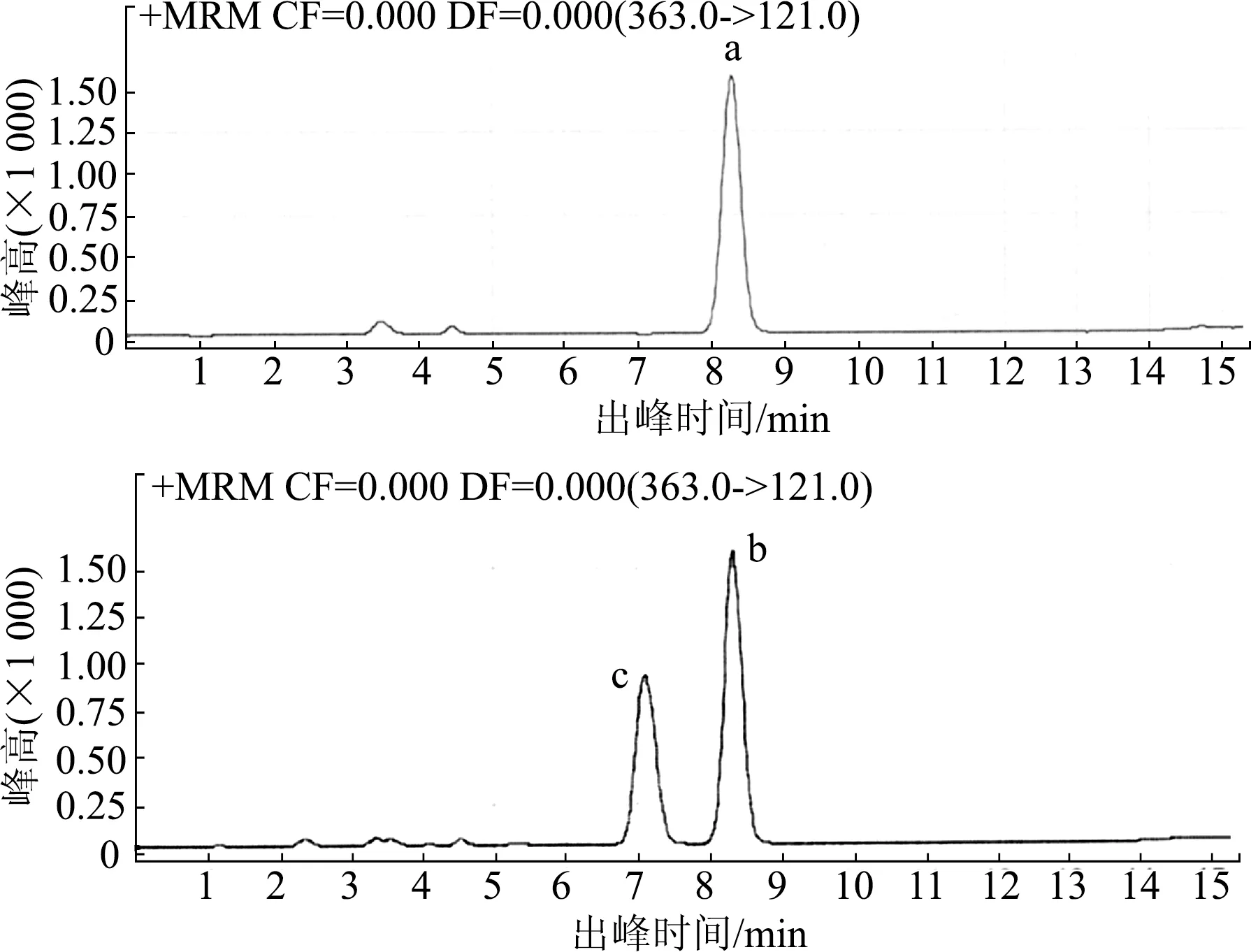
a: MTBE萃取的皮质醇峰;b: 乙酸乙酯萃取的皮质醇峰;c: 可能是长期储存而产生的同分异构体
2.1.2 碰撞能量的优化 使用皮质醇储备液与内标物储备液稀释10倍后上样,液相分析柱替换为普通连接柱,从而消除液相层面的干扰,记录碰撞能量从15 eV到50 eV下离子的产量。结果如图2所示,在30 eV下定量离子和定性离子的产生量均为最高。因此本实验中的皮质醇的离子跃迁分别选择为定量离子363 m/z→121 m/z 和定性离子363 m/z→97 m/z,碰撞能量为30 eV;而皮质醇-d4的离子跃迁用同样的方法确定为定量离子367 m/z→121 m/z,碰撞能量为 25 eV。
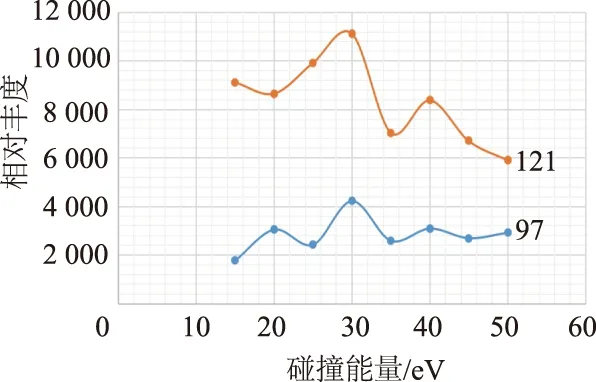
图2 皮质醇定量离子(363→121)和定性离子(363→97)在不同碰撞能量下的产量对比
2.1.3 流动相成分与时间表 本实验液相色谱仪流动相A的成分为2%甲醇溶液(含有0.1%甲酸),流动相B为含有0.1%甲酸的甲醇。为了得到最优的流动相占比,从100%流动相B开始,依次降低流动相B的百分比,得到不同高度和宽度的皮质醇等度洗脱峰。比较可得在流动相B占90%时皮质醇的洗脱为最优(图3)。考虑到皮质醇的疏水性,在流动相时间表的开头和结尾需要使用尽可能少的流动相B来减少丢失。综合以上条件,则本实验中梯度流动相设计为:0→2 min 35%B;2→4 min 35%B→90%B;4→6.5 min 90%B;6.5→8 min 100%B;8→8.5 min 100%B→35%B;8.5→11 min 35%B。
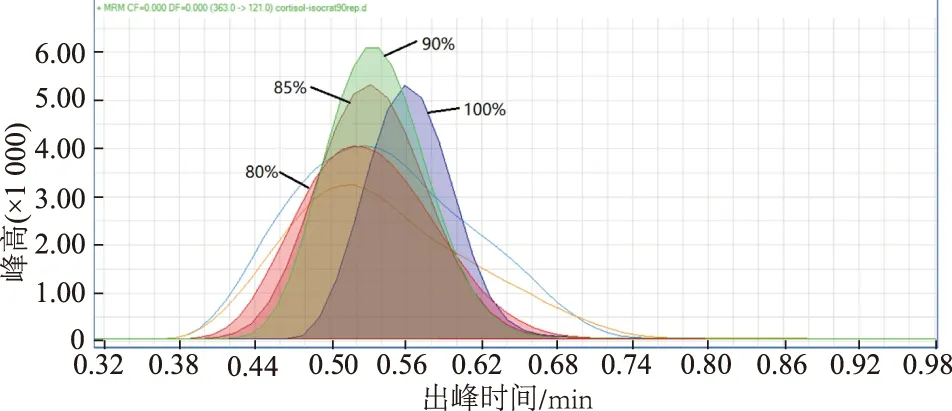
图3 比较不同梯度的流动相B洗脱得到的皮质醇等度峰
2.1.4 流速、柱温与进样量 本实验测试了0.2, 0.3, 0.4和0.6 mL/min 4种流速,选择了峰的高度和宽度最为理想的0.3 mL/min作为最终流速。相同流速下,分别测试2, 4, 5, 6, 7, 8和10 μL共7种进样量和45 ℃ 、20 ℃柱温,最终选择柱温为20 ℃,进样量为6 μL,皮质醇和内标物的保留时间为6.6 min。
2.1.5 离子抑制 为了排除磷脂的离子抑制作用的干扰,本实验监测了184 m/z和104 m/z的出峰情况,得到磷脂的出峰时间为2 min,对皮质醇及其内标物的检测不存在干扰。
2.2 性能验证与质量评估
2.2.1 标准曲线与定量下限 皮质醇的标准曲线方程为Y=8.147×10-4X+0.003 44(r=0.999 9),线性关系良好。使用RCPAQAP外部质控品最低浓度(34 nmol/L),分别稀释5倍、10倍、100倍各1对,检测它们的信噪比(S/N),用其中S/N比值均大于10的1对样品(1 ∶10)的检测浓度[12],求得本实验中的最低定量下限为2.19 nmol/L。
2.2.2 精密度 同批次检测步骤“1.3”中配置的低、中、高3个水平的质控品各10个,得到批内精密度为3.79%。将低、中、高3个水平的质控品分5个批次检测,得到批间精密度为7.48%。
2.2.3 偏倚(不确定度)与回归分析 检测12个RCPAQAP质控品,将检测值与靶浓度相比较做戴明回归分析(图4),得到的方程为Y=1.096X+2.1,计算2个最接近皮质醇医学决定水平[13]的浓度的偏差,分别为9.90%和8.40%,它们的平均值9.15%为本实验方法的偏倚(不确定度)[14]。由此求得本实验方法的总误差为21.49%。将已知浓度的2支RCPAQAP质控品(614和239 nmol/L)等量相加,检测3次,得到回收率为83%。
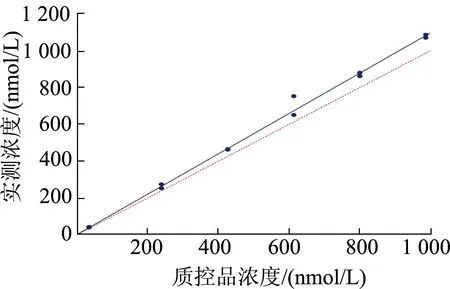
图4 RCPAQAP外部质控品的戴明回归分析
2.2.4 六西格玛分析 本实验使用六西格玛质量分析,用方程sigma=(总误差-偏倚)/精密度进行计算[11]。此处的允许总误差参考美国CLIA′88能力验证计划的分析质量要求:皮质醇的允许总误差为靶值±25%。六西格玛图表使用允许精密度作为x轴,允许不确定度作为y轴,当一个实验方法的sigma>4时,认为是理想的实验方法,而sigma<3时认为不在统计学程序控制范围内[15]。计算得到本实验方法的sigma为4.22,图5显示工作点落在4 sigma与5 sigma之间,说明本实验方法较为理想。
3 讨论
不同溶剂与皮质醇之间的亲和力不同,提取效率不同,对人体的毒性也不同,因此液液萃取的溶剂对于产物的提纯起到至关重要的作用。Honour[16]提出在选取溶剂时,检测时长和溶剂的毒性也应考虑在内。因此最终选择了峰形最好,提取最稳定,毒性不算很强的MTBE作为液液萃取的溶剂。
实验中值得注意的是,为了防止降解的影响,工作液需要在每批次实验前用储备液新鲜稀释而成。皮质醇-d4是本实验的内标物,由于甲醇可以起到沉淀蛋白的作用[17],而内标物的浓度应该在标准曲线范围之内(0~2 000 nmol/L),因此使用甲醇配置了1 400 nmol/L的工作液。
MRM除了监测定量离子、定性离子之外,还要监测次显著的离子跃迁[18]和离子抑制作用。在本实验中,皮质醇的检测并没有受到磷脂的离子抑制作用的影响。在今后进一步的实验优化中,也可以监测磷脂之外其他会产生基质效应的脂类,如胆固醇、甘油酯[19]。
在本研究的流动相时间表中,皮质醇洗脱之前使用了35%的流动相B,低于Jung等[20]和Hawley等[21]推荐使用的40%的流动相B作为标准的解决方案。本研究小幅下调了流动相B的比例,是考虑到皮质醇的疏水性和液液萃取的设备较为简化,以此来规避可能出现的提取率不高的问题。Jung等[20]研究指出液液萃取的重构步骤中使用的甲醇比例应该与流动相时间表的初始比例相一致,然而考虑到上样小管在冷冻保存时纯甲醇的稳定性更优,本研究重构步骤使用了100%纯甲醇以达到一个更精确易操作的重构效果。
本研究在方法学验证时得到批内精密度和批间精密度分别为3.79%和7.48%。Biswas等[22]指出批间精密度更能代表实验方法的整体精密度,因此确定本方法的精密度为7.48%。从戴明回归分析图上可以看出,本研究中浓度高的样品有产生更大偏倚的趋势。本实验的精密度7.48%,偏倚9.15%,总误差21.49%,均在Westgard数据库列出的理想的生物学多样性指标范围内(精密度7.6%,偏倚10.26%,总误差22.8%),也符合美国CLIA′88能力验证计划的分析质量要求,并且在六西格玛分析中得到了理想的结果。
值得提出的是,在精密度实验中使用的样品浓度为100,500和1 500 nmol/L,这有可能为六西格玛分析的计算带来问题。Westgard建议验证精密度和不确定度的样品浓度应与医学决定水平一致[23]。考虑到RCPAQAP样品的浓度更接近于医学决定水平,进一步的实验优化可以使用同样的RCPAQAP样品做精密度和不确定度分析。
综上所述,本研究在HPLC-MS/MS平台上建立了血清皮质醇的检测方法,优化了色谱分离和质谱检测的参数,并对其精密度、偏倚(不确定度)、定量限和六西格玛分析等做了方法学验证与质量评估,最终得到一个精密度高、准确性好、理想且高效的策略。
