精胺对辐射所致氧化损伤H9c2心肌细胞的影响研究
2021-09-16杜霄许超涂彧周菊英
杜霄,许超,涂彧,周菊英*
机体的电离辐射损伤一直是放疗科医生非常关注的问题。辐射可直接作用于细胞关键靶点,导致DNA单链或者双链发生断裂;亦可作用于水分子,产生大量自由基,直接攻击细胞膜和细胞核内的DNA,造成DNA的间接损伤,引发不饱和脂肪酸脂质过氧化进而使细胞膜损伤、各种亚细胞结构破坏、酶活性降低和消失,如何避免或者减少这种损伤是目前研究的重点。精胺是一类广泛分布的多胺,具有抗氧化、抗衰老、抗癌、调节细胞增殖以及维持细胞膜、核酸和离子通道等细胞结构稳定性的功能[1-3]。有研究表明,外源性精胺可使大鼠离体胸主动脉环收缩,并在一定范围内呈浓度依赖性[4];细胞内精胺浓度变化可影响细胞的生长代谢过程。目前,精胺和放射导致的心肌氧化损伤之间的关系并不明确,相关研究甚少。因此本研究旨在探讨精胺类药物对辐射所致氧化损伤的心肌细胞是否具有保护作用。
1 材料与方法
1.1 研究时间 2018年12月至2020年12月。
1.2 实验材料 spermine(美国sigma公司),H9c2细胞系(中科院上海细胞库),DMEM培养基(美国corning公司),新生胎牛血清(美国gibco公司),胰蛋白酶(美国gibco公司),青霉素-链霉素溶液(上海碧云天科技有限公司),PBS(上海源培生物科技有限公司),CCK8试剂盒(日本同仁公司),超氧化物歧化酶(SOD)试剂盒(南京建成生物工程研究所,货号:A001-1-1,生产批号:20190628),丙二醛(MDA)试剂盒(南京建成生物研究所,货号:A003-1-1,生产批号:20190629),Annexin V-FITC/PI细胞凋亡检测试剂盒(大连美伦生物技术有限公司:100T,货号:MAO220-2,批号:Feb-28E)。
1.3 实验仪器 MCO-18AC CO2细胞培养箱(日本松下健康医疗器械株式会社),倒置荧光显微镜(日本奥林巴斯公司),酶标仪(MK3型,美国Thermo公司),DK-500电热恒温水浴箱(上海精宏实验设备有限公司),DK-S22电热恒温水锅(上海精宏实验设备有限公司),BY-G20型医用离心机(北京白洋医疗器械有限公司),西门子primus医用直线加速器,流式细胞仪(美国BD公司)。
1.4 H9c2心肌细胞的培养 将H9c2心肌细胞置于含10%胎牛血清、1%双抗的DMEM高糖培养液,37 ℃、5% CO2、饱和湿度的培养箱中培养。
1.5 细胞存活率 取对数生长期的H9c2心肌细胞接种于96孔板,104个细胞/孔,24 h后加入精胺并分为100 μmol/L组、200 μmol/L组、400 μmol/L组,空白对照组为加等量不含药物的培养液,每组设3个复孔。放置于CO2细胞培养箱中培养12、24、48 h后,在每孔内加入100 μl含10 μl新型细胞增殖及细胞毒性检测溶液——CCK8溶液的细胞培养基,37 ℃下继续在培养箱中培养4 h,于450 nm波长处测定每孔的光密度(OD)值,计算细胞存活率,细胞存活率=(加药细胞OD值/对照细胞OD值)×100%,上述所有实验步骤重复3次,取平均值。
1.6 细胞凋亡检测 选取对数生长期的H9c2心肌细胞并调整细胞的数量为105/孔,接种于6孔板,24 h后分别加入精胺,根据细胞存活率的检验结果将细胞分为空白对照组、单纯辐射组和辐射+100 μmol/L精胺组、辐射+200 μmol/L精胺组,培养24 h,对单纯辐射组和辐射+100 μmol/L精胺组、辐射+200 μmol/L精胺组进行X线照射,辐射源为医用直线加速器(西门子primus)6 MV X线照射,照射剂量6 Gy,剂量率200 MU/min,辐射视野10 cm×10 cm,用1.5 cm组织等效材料,消除建成区,机头转180°,空白对照组含等量的DMEM高糖培养基且不予X线照射,于照射后0、12、24、48 h进行如下操作:胰蛋白酶消化后,收集细胞,离心弃上清,用预冷PBS洗涤细胞2次,细胞沉淀中加入1×Bing buffer工作液,重悬后吸取细胞悬液至新管,加入5 μl Annexin V-FITC和5 μl碘化丙啶(PI)染色液,轻轻混匀。室温避光孵育15 min,染色孵育后,每管加入400 μl 1×Binding Buffer工作液,混匀后使用流式细胞仪(美国BD公司)检测,Annexin V-FITC为绿色荧光,PI为红色荧光。细胞凋亡率=(早期凋亡率+晚期凋亡率)。Annexin V FITC/PI流式细胞术将实验样本中正常、坏死、凋亡细胞区分开。以FITC和PI荧光做双参数点图,细胞分为4个区,1区:机械损伤细胞(Annexin V FITC-/PI+);2区:凋亡晚期或坏死细胞(Annexin V FITC+/PI+);3区:活细胞(Annexin V FITC-/PI-);4区:早期凋亡细胞(Annexin V FITC+/PI-)。记录4个区细胞比例并对各组不同时间的凋亡率进行比较。
1.7 MDA、SOD测定 选取对数生长期的H9c2心肌细胞,并调整细胞的数量为104/孔,接种于96孔板,24 h后分别加入精胺,处理条件同1.6,参照试剂盒说明书测定细胞培养液中MDA、SOD。
1.8 荧光显微镜下观察H9c2心肌细胞的形态变化 选取处于对数生长期的H9c2心肌细胞并调整细胞的数量为105/孔,接种于6孔板中,24 h后分别加入精胺,处理条件同1.6,然后进行如下操作:预冷PBS溶液洗涤2次,在细胞中加1×Binding buffer工作液,再加入5 μl Annexin V-FITC和5 μl PI,轻轻混匀,室温避光孵育15 min后荧光显微镜下观察细胞形态学变化。使用显微镜上的蓝光和绿光通道分别观察FITC和PI。被Annexin V-FITC结合的细胞显示浆膜上有绿色光环。丧失细胞膜完整性的细胞,细胞核呈现红色,膜上有绿色光环。
1.9 统计学方法 采用SPSS 22.0统计学软件进行数据分析。计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 心肌细胞存活率 空白对照组不同时间点细胞存活率比较,差异无统计学意义(P>0.05)。100 μmol/L组、200 μmol/L组、400 μmol/L组不同时间点细胞存活率比较,差异有统计学意义(P<0.05);其中24 h细胞存活率高于12、48 h,差异有统计学意义(P<0.05);12 h及48 h细胞存活率比较,差异无统计学意义(P>0.05)。处理时间12 h:四组细胞存活率比较,差异有统计学意义(P<0.05);空白对照组细胞存活率高于100 μmol/L组、200 μmol/L组及400 μmol/L组,差异有统计学意义(P<0.05);100 μmol/L组细胞存活率与200 μmol/L组比较,差异无统计学意义(P>0.05);100 μmol/L组、200 μmol/L组细胞存活率高于400 μmol/L组,差异有统计学意义(P<0.05)。处理时间24 h:四组细胞存活率比较,差异有统计学意义(P<0.05);空白对照组与200 μmol/L组细胞存活率比较,差异无统计学意义(P>0.05);空白对照组细胞存活率高于100 μmol/L组、400 μmol/L组,差异有统计学意义(P<0.05);100 μmol/L组细胞存活率低于200 μmol/L组,高于400 μmol/L组,差异有统计学意义(P<0.05);200 μmol/L组细胞存活率高于400 μmol/L组,差异有统计学意义(P<0.05)。处理时间48 h:四组细胞存活率比较,差异有统计学意义(P<0.05);空白对照组细胞存活率高于100 μmol/L组、200 μmol/L组及400 μmol/L组,差异有统计学意义(P<0.05);100 μmol/L组细胞存活率低于200 μmol/L组,高于400 μmol/L组,差异有统计学意义(P<0.05);200 μmol/L组细胞存活率高于400 μmol/L组,差异有统计学意义(P<0.05),见表1。
表1 四组不同时间的细胞存活率比较(±s,n=3)Table 1 Comparison of cell survival rates in four groups at three different treatment times
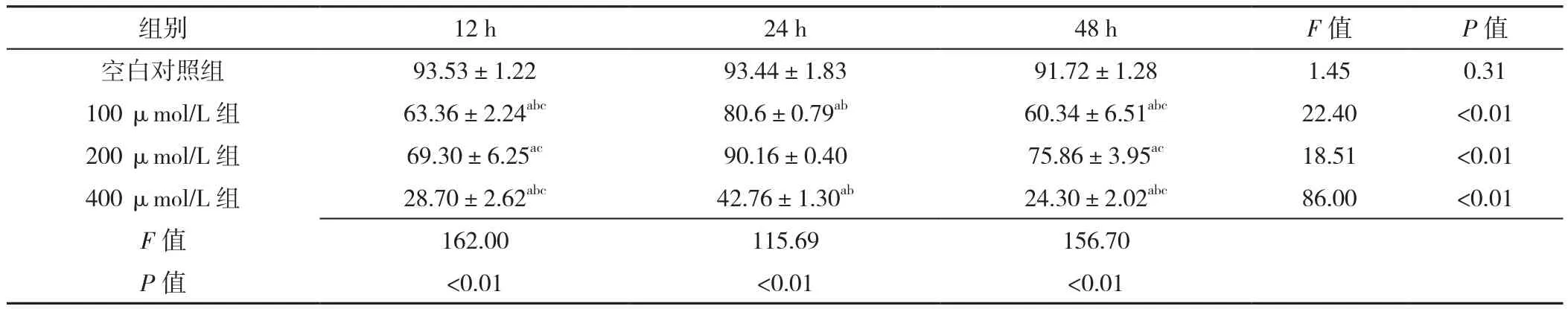
表1 四组不同时间的细胞存活率比较(±s,n=3)Table 1 Comparison of cell survival rates in four groups at three different treatment times
注:与空白对照组比较,aP<0.05;与200 μmol/L组比较,bP<0.05;与处理时间24 h比较,cP<0.05
组别 12 h 24 h 48 h F值 P值空白对照组 93.53±1.22 93.44±1.83 91.72±1.28 1.45 0.31 100 μmol/L 组 63.36±2.24abc 80.6±0.79ab 60.34±6.51abc 22.40 <0.01 200 μmol/L 组 69.30±6.25ac 90.16±0.40 75.86±3.95ac 18.51 <0.01 400 μmol/L 组 28.70±2.62abc 42.76±1.30ab 24.30±2.02abc 86.00 <0.01 F值 162.00 115.69 156.70 P值 <0.01 <0.01 <0.01
2.2 心肌细胞凋亡率 处理时间0 h:四组细胞凋亡率比较,差异有统计学意义(P<0.05);辐射+200 μmol/L精胺组、辐射+100 μmol/L精胺组细胞凋亡率高于空白对照组,差异有统计学意义(P<0.05);辐射+200 μmol/L精胺组、辐射+100 μmol/L精胺组细胞凋亡率高于单纯辐射组,差异有统计学意义(P<0.05);辐射+200 μmol/L精胺组细胞凋亡率低于辐射+100 μmol/L精胺组,差异有统计学意义(P<0.05);处理时间为12 h组、24 h组、48 h组细胞凋亡情况同处理时间为0 h组。空白对照组不同时间点细胞凋亡率比较,差异有统计学意义(P<0.05);其中0 h细胞凋亡率低于12 h、48 h,差异有统计学意义(P<0.05);0 h细胞凋亡率与24 h比较,差异无统计学意义(P>0.05);12 h细胞凋亡率低于24 h,差异有统计学意义(P<0.05);12 h细胞凋亡率与48 h比较,差异无统计学意义(P>0.05);24 h细胞凋亡率低于48 h,差异有统计学意义(P<0.05)。辐射+200 μmol/L精胺组不同时间点细胞凋亡率比较,差异有统计学意义(P<0.05);其中24 h细胞凋亡率低于0 h、12 h和48 h,差异有统计学意义(P<0.05);12 h细胞凋亡率低于0、48 h,差异有统计学意义(P<0.05);24 h细胞凋亡率低于48 h,差异有统计学意义(P<0.05)。辐射+100 μmol/L精胺组不同时间点细胞凋亡率比较,差异有统计学意义(P<0.05);其中24 h细胞凋亡率低于0、48 h,差异有统计学意义(P<0.05);24 h细胞凋亡率与12 h比较,差异无统计学意义(P>0.05);12 h细胞凋亡率低于0、48 h,差异有统计学意义(P<0.05);0 h细胞凋亡率与48 h比较,差异无统计学意义(P>0.05)。单纯辐射组不同时间点细胞凋亡率比较,差异有统计学意义(P<0.05);其中0 h细胞凋亡率低于12、24、48 h,差异有统计学意义(P<0.05);12 h细胞凋亡率低于24、48 h,差异有统计学意义(P<0.05);24 h细胞凋亡率低于48 h,差异有统计学意义(P<0.05),见表2。
表2 四组不同时间的细胞凋亡率比较(±s,n=3)Table 2 Comparison of apoptosis rate in four groups at four different treatment times
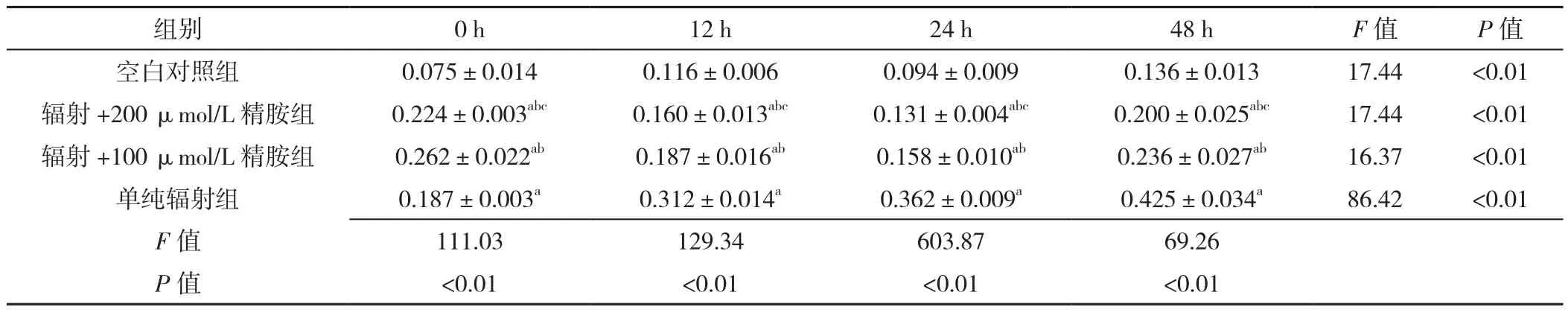
表2 四组不同时间的细胞凋亡率比较(±s,n=3)Table 2 Comparison of apoptosis rate in four groups at four different treatment times
注:与空白对照组比较,aP<0.05;与单纯辐射组比较,bP<0.05;与辐射+100 μmol/L组比较,cP<0.05
组别 0 h 12 h 24 h 48 h F值 P值空白对照组 0.075±0.014 0.116±0.006 0.094±0.009 0.136±0.013 17.44 <0.01辐射 +200 μmol/L 精胺组 0.224±0.003abc 0.160±0.013abc 0.131±0.004abc 0.200±0.025abc 17.44 <0.01辐射 +100 μmol/L 精胺组 0.262±0.022ab 0.187±0.016ab 0.158±0.010ab 0.236±0.027ab 16.37 <0.01单纯辐射组 0.187±0.003a 0.312±0.014a 0.362±0.009a 0.425±0.034a 86.42 <0.01 F值 111.03 129.34 603.87 69.26 P值 <0.01 <0.01 <0.01 <0.01
2.3 MDA水平及SOD活性 处理时间为12 h时:四组MDA水平比较,差异有统计学意义(P<0.05);空白对照组MDA水平低于辐射+200 μmol/L精胺组、辐射+100 μmol/L精胺组、单纯辐射组,差异有统计学意义(P<0.05);单纯辐射组MDA水平低于辐射+100 μmol/L精胺组,差异有统计学意义(P<0.05);单纯辐射组与辐射+200 μmol/L精胺组MDA水平比较,差异无统计学意义(P>0.05);辐射+100 μmol/L精胺组MDA水平高于辐射+200 μmol/L精胺组,差异有统计学意义(P<0.05)。处理时间为24 h时:四组MDA水平比较,差异有统计学意义(P<0.05);空白对照组MDA水平低于辐射+200 μmol/L精胺组、辐射+100 μmol/L精胺组、单纯辐射组,差异有统计学意义(P<0.05);单纯辐射组MDA水平与辐射+100 μmol/L精胺组比较,差异无统计学意义(P>0.05);单纯辐射组MDA水平高于辐射+200 μmol/L精胺组,差异有统计学意义(P<0.05);辐射+100 μmol/L精胺组MDA水平高于辐射+200 μmol/L精胺组,差异有统计学意义(P<0.05)。处理时间为48 h时:四组MDA水平比较,差异有统计学意义(P<0.05);空白对照组MDA水平低于辐射+200 μmol/L精胺组、辐射+100 μmol/L精胺组、单纯辐射组,差异有统计学意义(P<0.05);单纯辐射组MDA水平与辐射+100 μmol/L精胺组比较,差异无统计学意义(P>0.05);单纯辐射组MDA水平高于辐射+200 μmol/L精胺组,差异有统计学意义(P<0.05);辐射+100 μmol/L精胺组MDA水平高于辐射+200 μmol/L精胺组,差异有统计学意义(P<0.05)。
处理时间为12 h时:4组SOD活性比较,差异有统计学意义(P<0.05);空白对照组SOD活性高于辐射+200 μmol/L精胺组、辐射+100 μmol/L精胺组、单纯辐射组,差异有统计学意义(P<0.05);单纯辐射组SOD活性高于辐射+100 μmol/L精胺组,差异有统计学意义(P<0.05);单纯辐射组SOD活性高于辐射+200 μmol/L精胺组,差异有统计学意义(P<0.05);辐射+100 μmol/L精胺组SOD活性低于辐射+200 μmol/L精胺组,差异有统计学意义(P<0.05)。处理时间为24 h时:四组SOD活性比较,差异有统计学意义(P<0.05);空白对照组SOD活性高于辐射+200 μmol/L精胺组、辐射+100 μmol/L精胺组、单纯辐射组,差异有统计学意义(P<0.05);单纯辐射组SOD活性低于辐射+100 μmol/L精胺组、辐射+200 μmol/L精胺组,差异有统计学意义(P<0.05);辐射+100 μmol/L精胺组SOD活性低于辐射+200 μmol/L精胺组,差异有统计学意义(P<0.05)。处理时间为48 h时:4组SOD活性比较,差异有统计学意义(P<0.05);空白对照组SOD活性高于辐射+200 μmol/L精胺组、辐射+100 μmol/L精胺组、单纯辐射组,差异有统计学意义(P<0.05);单纯辐射组SOD活性与辐射+100 μmol/L精胺组比较,差异无统计学意义(P>0.05);单纯辐射组SOD活性低于辐射+200 μmol/L精胺组,差异有统计学意义(P<0.05);辐射+100 μmol/L精胺组SOD活性低于辐射+200 μmol/L精胺组,差异有统计学意义(P<0.05),见表3。
表3 四组不同时间SOD、MDA比较(±s,n=3)Table 3 Comparison of SOD and MDA levels in four groups at three different treatment times
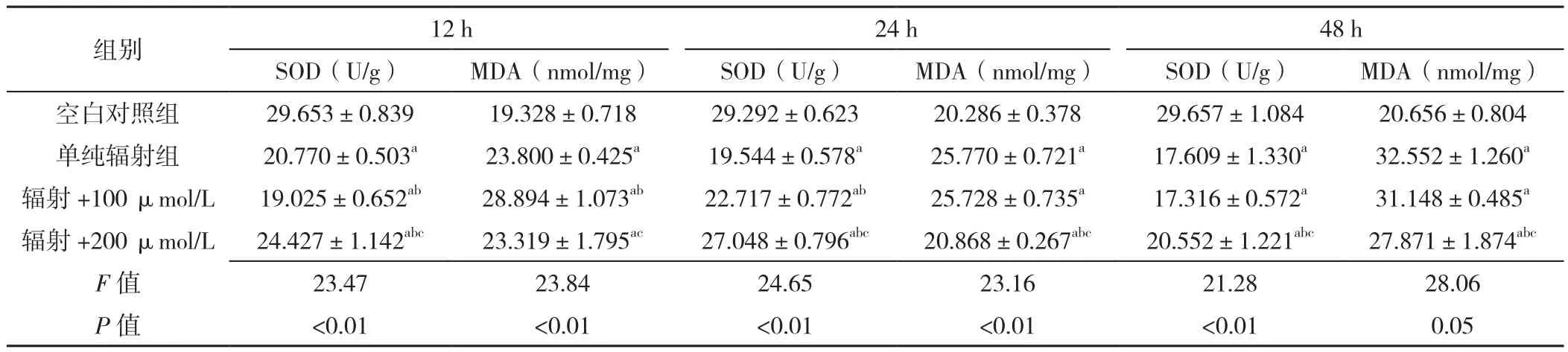
表3 四组不同时间SOD、MDA比较(±s,n=3)Table 3 Comparison of SOD and MDA levels in four groups at three different treatment times
注:SOD=超氧化物歧化酶,MDA=丙二醛;与空白对照组比较,aP<0.05;与单纯辐射组比较,bP<0.05;与辐射+100 μmol/L组比较,cP<0.05
组别 12 h 24 h 48 h SOD(U/g) MDA(nmol/mg) SOD(U/g) MDA(nmol/mg) SOD(U/g) MDA(nmol/mg)空白对照组 29.653±0.839 19.328±0.718 29.292±0.623 20.286±0.378 29.657±1.084 20.656±0.804单纯辐射组 20.770±0.503a 23.800±0.425a 19.544±0.578a 25.770±0.721a 17.609±1.330a 32.552±1.260a辐射 +100 μmol/L 19.025±0.652ab 28.894±1.073ab 22.717±0.772ab 25.728±0.735a 17.316±0.572a 31.148±0.485a辐射 +200 μmol/L 24.427±1.142abc 23.319±1.795ac 27.048±0.796abc 20.868±0.267abc 20.552±1.221abc 27.871±1.874abc F值 23.47 23.84 24.65 23.16 21.28 28.06 P值 <0.01 <0.01 <0.01 <0.01 <0.01 0.05
2.4 荧光显微镜观察细胞形态的变化 给予X线照射24 h后,空白对照组H9c2心肌细胞形态呈长梭形,细胞核形态完整,染色均匀;B为辐射+200 μmol/L精胺组、C为辐射+100 μmol/L精胺组、D为单纯辐射组的H9c2心肌细胞出现不同程度的变化,如细胞形态变圆,细胞核碎裂,染色不均匀等,其中200 μmol/L精胺组的细胞形态最接近空白对照组细胞,变化程度较轻,见图1。
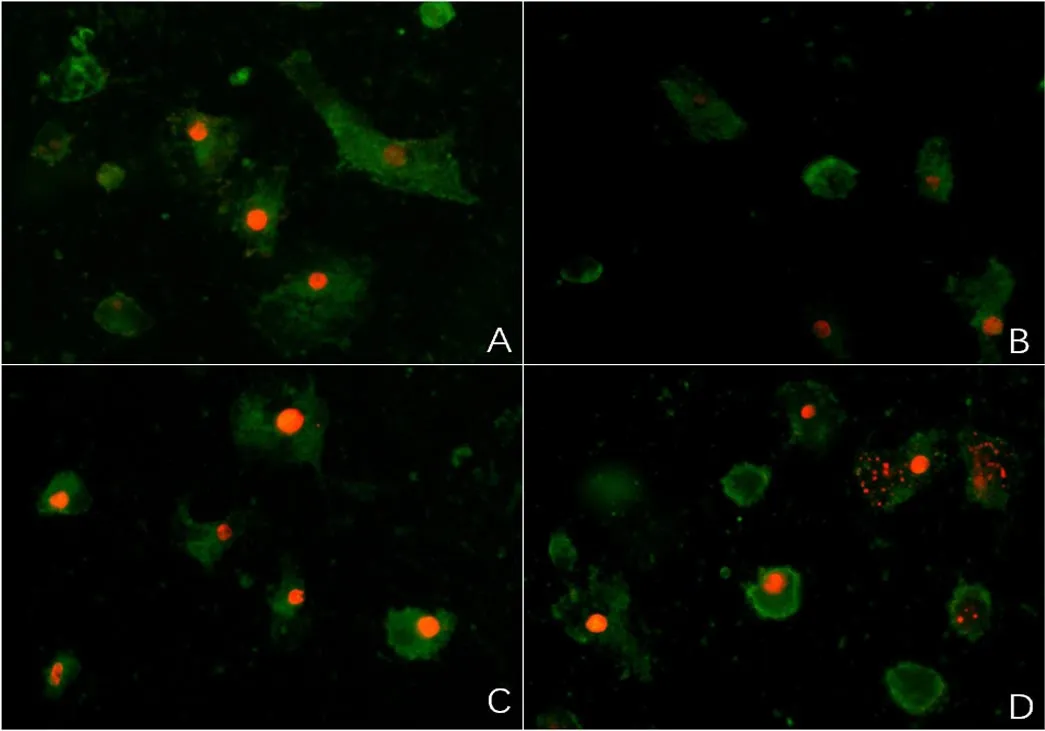
图1 各组细胞双染荧光图(×200)Figure 1 Morphology of cells stained with double immunofluorescence in four groups
3 讨论
放射治疗被越来越多地应用到恶性肿瘤的治疗中,并且成了治疗恶性肿瘤的重要方式。但在治疗过程中,由于射线没有精确的选择性,在通过一系列物理、化学甚至生物过程作用于肿瘤细胞导致其死亡的同时也会对肿瘤周围正常组织细胞造成损伤甚至凋亡,引起病变周围、病变以外的器官和组织的放射损伤,产生各种放疗并发症和毒副作用,即靶外放射损伤。恶性肿瘤的治愈率不断提高,随着肿瘤患者的远期生存时间不断延长,对肿瘤患者的关注由延长患者的生存期向患者的远期生活质量上倾斜,由放射治疗导致的靶外器官的放射损伤开始成为医学上亟待解决的问题。
精胺(天然多胺的一种)是一类带高密度正电荷的脂肪族的小分子化合物,主要参与多胺的代谢,具有调控细胞的生长、分化和凋亡的功能,在调节染色质状态、维持核酸、基因表达和离子通道的稳定性等方面也具有重要作用[5]。精胺普遍存在于人体细胞中,其代谢异常会导致一些细胞的病理变化[6-7],影响多种疾病的演变[8-11]。在活细胞内,外源性精胺可以通过拮抗氧化应激、诱导自噬等途径保护细胞免受氧化应激损伤[12-15]。放射线作用于心肌细胞可产生大量的自由基[16],从而触发氧化应激反应[17],导致心肌细胞损伤。有研究表明,外源性精胺可通过降低辐射诱导的DNA-蛋白质交联产物,来增强对DNA的保护,从而减少辐射给细胞带来的氧化损伤[18]。也有研究表明,精胺可以减弱P38/JNK等激酶的磷酸化形式表达,从而减少ROS积累和降低氧化应激反应[19],进而减少细胞的凋亡。精胺是否可以保护正常心肌细胞免受或降低辐射所致氧化损伤,目前相关报道甚少。
本研究结果显示,精胺对心肌细胞具有放射防护作用。对于正常细胞,精胺浓度可影响细胞的代谢过程,对细胞产生不同作用。不同浓度的外源性精胺亦会产生不同的效应,如血管环收缩、内皮细胞损伤、心肌细胞保护或损伤等生理或病理变化[20]。CCK8实验结果显示,精胺浓度为200 μmol/L且处理时间为24 h时,心肌细胞的存活率达到90%以上,与空白对照组相比心肌细胞的存活率无明显差异,可知200 μmol/L是心肌细胞生长的安全药物浓度。基于精胺浓度200 μmol/L是细胞的安全药物浓度,100 μmol/L组细胞存活率较空白对照组及200 μmol/L组低,但24 h时也达到了80.6%,而精胺浓度为400 μmol/L时心肌细胞损伤严重,12 h及48 h时存活率不到30%,即使在24 h时存活率也仅有42.8%。以上结果说明,不同浓度的外源性精胺对心肌细胞的效应是不同的,而且作用的时间不同效应也不同。因此为探究不同浓度外源性精胺对辐射损伤心肌细胞的作用,在后续试验中选用精胺药物浓度为100 μmol/L 和 200 μmol/L。
细胞凋亡是受到严格调控的细胞死亡方式,相关研究证实细胞凋亡的异常对心血管疾病的发生具有重要影响[21]。本研究结果显示,X线照射对于H9c2心肌细胞具有明确的损伤作用,精胺处理细胞后其凋亡率显著降低,辐射防护作用与浓度及时间有关。浓度为200 μmol/L精胺处理组的细胞凋亡率较100 μmol/L精胺处理组低。不同精胺浓度处理的细胞凋亡率均在24 h达到最低,24 h后细胞凋亡率增高,可能与时间有关。精胺对于辐射损伤的心肌细胞的保护作用可能与其对细胞凋亡机制的影响有关。近年来国内外相关报道提示,精胺可通过上调抗凋亡蛋白B淋巴细胞瘤-2(Bcl-2)基因的表达,下调 Bax、 Caspase-3、Caspase-9等细胞凋亡关键酶的表达,来降低各种病理因素导致的心肌细胞的凋亡[22-23],但精胺对辐射所致氧化损伤心肌细胞凋亡的具体机制还有待进一步研究。
自由基和活性氧是电离辐射重要产物,而氧化应激在辐射损伤的发生中起重要作用[24]。MDA是脂质过氧化的主要产物,MDA水平的高低可以反映机体脂质过氧化速率和程度,也能间接反映出细胞过氧化损伤的程度。SOD是机体的抗氧化酶,对机体的氧化和抗氧化平衡起着至关重要的作用,能清除超氧阴离子自由基(O2-)、保护细胞免受损伤。SOD活力高低间接反映了机体清除氧自由基的能力,而MDA水平的高低又间接反映了机体细胞受自由基攻击的严重程度。在本研究中,辐射+200 μmol/L组SOD活力明显下降,而MDA水平显著升高,其作用效果可能与精胺能够抑制自由基的产生、脂质过氧化,提高内源性抗氧化酶的活力,阻止活性氧对细胞膜的损伤,同时提高细胞内钠钾泵活力、降低心肌细胞内钙超载等机制有关[25-26]。
荧光显微镜以核碎裂、核浓缩为凋亡特征定性观察细胞。本研究结果显示,空白对照组细胞核形态规整,染色均匀;在X线处理24 h时,单纯辐射组细胞可见明显的细胞核浓缩及碎裂、染色质染色不均。200 μmol/L精胺处理后的心肌细胞细胞核形态较规整、部分碎裂,染色较均匀,其细胞形态比100 μmol/L精胺处理组的细胞更接近正常细胞。
综上所述,精胺对心肌细胞的辐射损伤具有保护作用,其保护作用与药物作用时间及浓度有关。其保护作用可能与精胺影响细胞凋亡过程、抑制脂质过氧化程度、提高内源性抗氧化酶的活力、减轻活性氧对细胞的损伤等机制相关。
本实验仅观察了一定浓度的精胺对辐射致损伤的心肌细胞存在保护作用,但未探究其中具体保护机制,也未对其他正常组织细胞进行观察,但为对正常细胞的辐射防护提供了新思路,后期将进行进一步探索。
作者贡献:许超进行论文的构思与设计,文章的可行性分析;杜霄负责文献/资料收集、数据整理、论文撰写;涂彧负责论文的修订,英文的修订;周菊英负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
