急性主动脉夹层患者入院时血钠水平与其术后30天院内死亡的相关性研究
2021-09-16王洪岩赵永波刘晓苏鹏张瑾瑾马烁潘哲史珏鑫侯芳芳张娜娜郑晓慧刘楠张菱马冬
王洪岩,赵永波,刘晓,苏鹏,张瑾瑾,马烁,潘哲,史珏鑫,侯芳芳,张娜娜,郑晓慧,刘楠,张菱,马冬*
急性主动脉夹层(acute aortic dissection,AAD)是病死率很高的大血管急症,患者在接受内科和外科治疗前死亡风险每小时增加1%[1]。尽管诊断和治疗技术在不断发展,但是AAD患者的住院死亡率仍然保持在30%以上[2]。已报道血钠水平的异常升高与多种疾病的死亡风险呈正相关,如重型颅脑损伤[3]、动脉瘤蛛网膜下腔出血[4]和神经系统疾病[5]。一项美国住院患者的研究报告表明,血钠水平>142 mmol/L与死亡率升高有关,不同程度的高钠血症(包括轻度、中度和较高水平)均与住院死亡率相关[6]。即使在健康人群中,血钠水平>138 mmol/L同样与较高的疾病死亡风险相关,特别是血钠水平超过145 mmol/L时更为显著[7-8]。临床上AAD患者的电解质紊乱很容易被忽略,并且目前仍未检索到入院时血钠水平与AAD患者住院死亡率关系的报道。因此,本研究旨在通过回顾性研究方法探讨入院时血钠水平与AAD患者术后住院死亡的关系及其影响因素。
1 对象与方法
1.1 研究对象 连续收集2015年1月至2019年12月在河北医科大学第四医院接受手术治疗的AAD患者的临床资料。所有AAD患者经CT血管造影(CTA)或磁共振血管成像(MRA)确诊,发病时间≤14 d[9],且年龄≥18岁。排除标准:(1)结缔组织疾病、妊娠、创伤性夹层;(2)之前接受过主动脉夹层手术或伴有其他同期手术;(3)合并其他主动脉疾病,如主动脉瘤、主动脉壁间血肿等;(4)合并肾脏相关疾病,如急性肾损伤、肾功能不全等;(5)感染性疾病;(6)资料缺失。本研究经华北理工大学伦理委员会批准(NO.2017011)。
1.2 临床资料
1.2.1 基本信息 通过病历系统收集患者基本信息,包括性别、年龄、既往史(高血压、糖尿病、冠心病、创伤史、手术史)、吸烟(指现在每天或偶尔使用任何烟草制品,或者过去每天或偶尔吸烟,而截至目前停止吸烟)、饮酒(指有饮酒习惯且饮酒频率≥2次/周)、入院时生命体征(收缩压、舒张压、心率)、Stanford分型、住院时长。
1.2.2 入院时实验室检查结果 包括丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、肌酐、尿素氮、血糖、α-羟丁酸脱氢酶(α-HBDH)、血小板计数、白细胞计数、中性粒细胞计数、淋巴细胞计数、单核细胞计数、中性粒细胞与淋巴细胞比值(NLR)、血钠、血钾、血氯、血钙等指标。实验室检查结果均来自AAD患者入院时采集的首份静脉血样。
1.2.3 术后住院结果 AAD患者的住院结果从病历中获得,以住院期间全因死亡为观察终点。
1.3 统计学方法 采用SPSS 25.0软件进行数据分析。根据入院时血钠水平的四分位数,将患者分为4组(Q1~Q4)。计数资料以相对数表示,多组间比较采用χ2检验或Fisher's确切概率法,组内两两比较采用LSD法。符合正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Kruskal-Wallis H检验。采用Cox回归模型分析探讨入院时不同血钠水平AAD患者与其术后院内死亡率的关系以及AAD患者术后院内死亡的影响因素,构建3个模型:未调整模型,即不调整协变量;适度调整模型,即仅调整年龄和性别变量;完全调整模型,即在适度调整的基础上调整Stanford分型、高血压、糖尿病、冠心病、吸烟、饮酒、血糖及α-HBDH。采用Kaplan-Meier法绘制不同血钠水平组的生存曲线,生存曲线比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 AAD患者临床资料比较 依据纳入标准和排除标准,最终纳入研究的AAD患者共415例,病例筛选流程见图1。依据入院时血钠水平的四分位数分为4组(Q1组:≤136 mmol/L,Q2组:137~138 mmol/L,Q3组:139~140 mmol/L,Q4组:≥141 mmol/L),4组年龄、Stanford A型比例、Stanford A型死亡率、院内死亡率、尿素氮水平、中性粒细胞计数、单核细胞计数和血氯水平比较,差异均有统计学意义(P<0.05);其中Q4组中性粒细胞计数高于其他3组,Q3、Q4组院内死亡率均高于Q1组,差异有统计学意义(P<0.05),见表1。
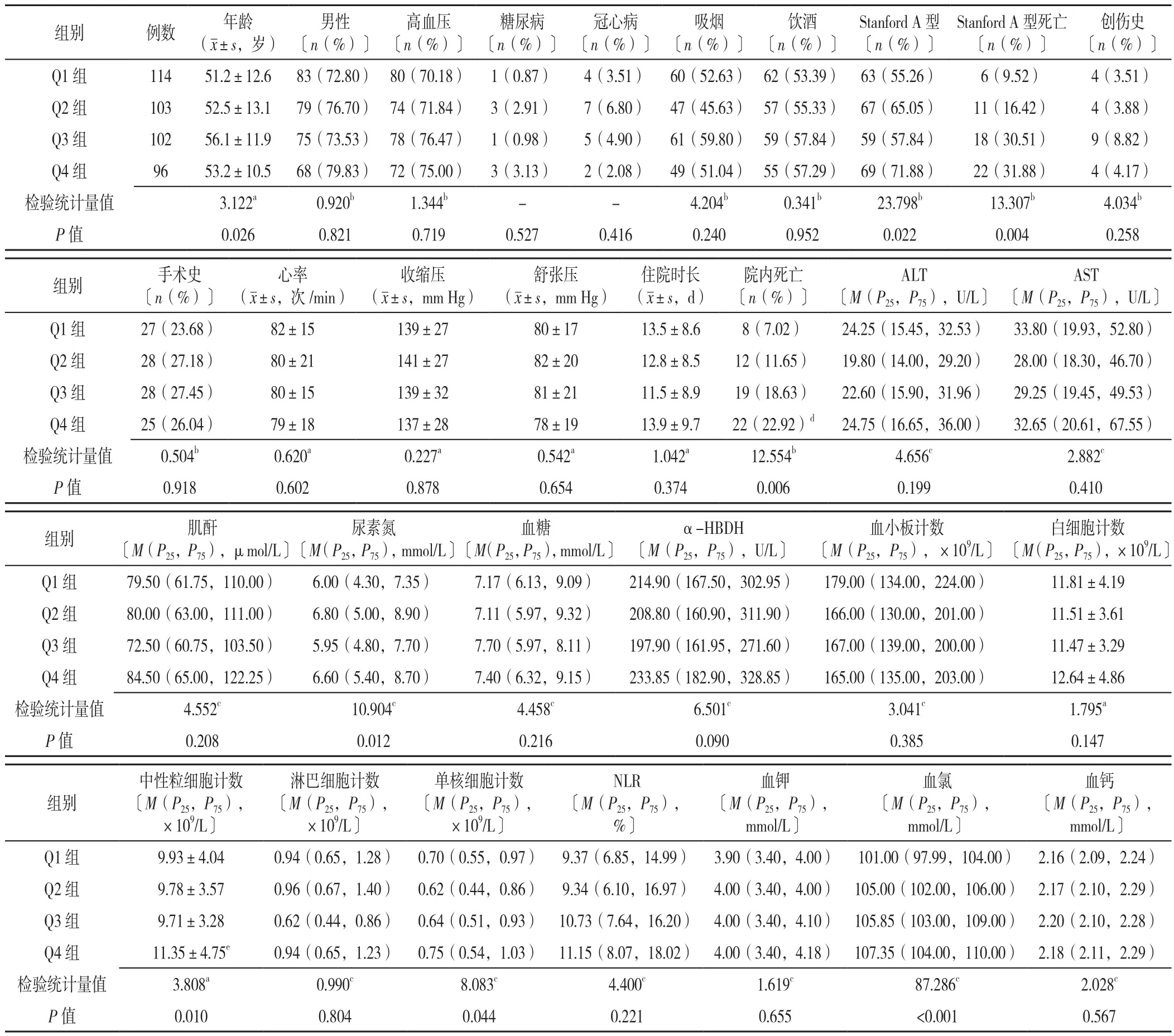
表1 AAD患者临床资料比较Table 1 Comparison of clinical data of AAD patients
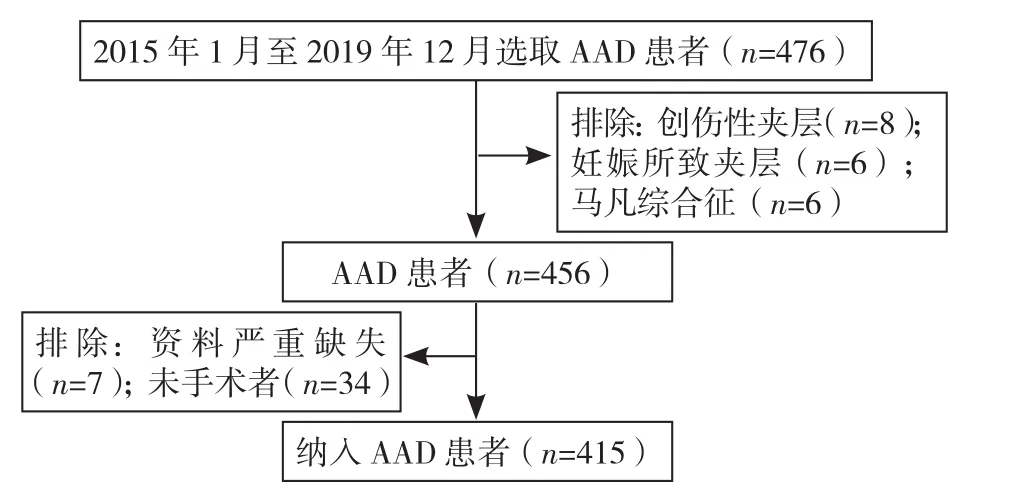
图1 AAD病例筛选流程图Figure 1 Flow chart of the enrollment of AAD patients
2.2 生存曲线分析 利用Kaplan-Meier绘制不同血钠水平下AAD患者术后30 d的生存曲线。结果显示,4组AAD患者术后30 d生存率比较,差异有统计学意义(χ2=10.994,P=0.012);Q1组生存率与Q2组比较,差异无统计学意义(χ2=1.411,P=0.235),与Q3组、Q4组比较,差异均有统计学意义(χ2=6.282,9.632;P=0.012,0.002),见图2。
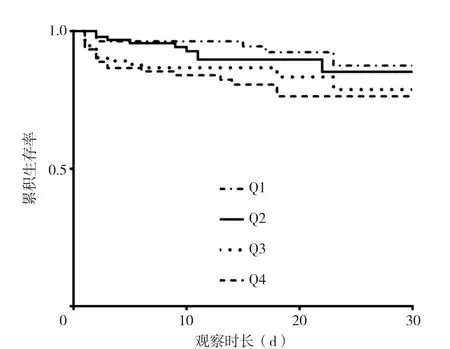
图2 不同血钠水平组的生存曲线Figure 2 Kaplan-Meier curves for in-hospital postoperative 30-day cumulative survival in AAD patients in quartile groups of admission serum sodium
2.3 入院时不同血钠水平与AAD患者术后院内死亡率的关系 未调整模型,Q3、Q4组AAD患者术后院内死亡率高于Q1组(P=0.012,0.004),Q3、Q4组的死亡风险分别是Q1组的2.890倍和3.253倍;适度调整模型后,Q3、Q4组AAD患者术后院内死亡率高于Q1组,差异有统计学意义(P=0.015,0.004),Q3、Q4组的死亡风险分别是Q1组的2.825倍和3.241倍;完全调整模型后,Q3、Q4组AAD患者术后院内死亡率仍高于Q1组(P=0.015,0.007),Q3、Q4组的死亡风险分别是Q1组的3.086倍和3.370倍。Q2组在三个模型中的死亡风险与Q1组比较,差异均无统计学意义(P>0.05),见表2。
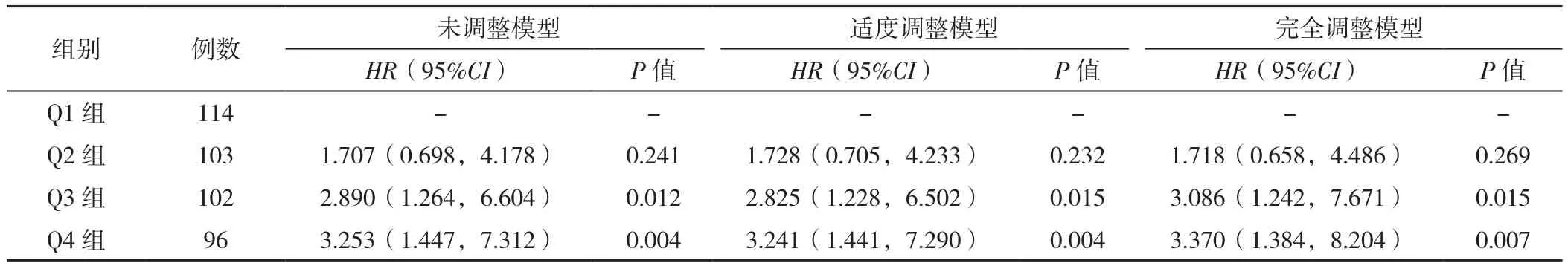
表2 不同血钠水平组院内死亡风险的Cox回归模型分析Table 2 Cox regression model analysis for the risk of in-hospital postoperative 30-day mortality in AAD patients in quartile groups of admission serum sodium
2.4 AAD患者术后院内死亡影响因素的Cox回归模型分析 以是否死亡(赋值:死亡=1,存活=0)为因变量,以年龄(赋值:实测值)、性别(赋值:男性=1,女性=0)、高血压(赋值:有=1,无=0)、糖尿病(赋值:有=1,无=0)、冠心病(赋值:有=1,无=0)、吸烟(赋值:有=1,无=0)、饮酒(赋值:有=1,无=0)、Stanford 分型(赋值:Stanford A型=1,Stanford B型=0)、创伤史(赋值:有=1,无=0)、手术史(赋值:有=1,无=0)、心率(赋值:实测值)、收缩压(赋值:实测值)、舒张压(赋值:实测值)、ALT(赋值:实测值)、AST(赋值:实测值)、肌酐(赋值:实测值)、尿素氮(赋值:实测值)、血糖(赋值:实测值)、α-HBDH(赋值:实测值)、血小板计数(赋值:实测值)、白细胞计数(赋值:实测值)、中性粒细胞计数(赋值:实测值)、淋巴细胞计数(赋值:实测值)、单核细胞计数(赋值:实测值)、NLR(赋值:实测值)、血钠(赋值:实测值)、血钾(赋值:实测值)、血氯(赋值:实测值)、血钙(赋值:实测值)为自变量,进行单因素Cox回归模型分析,结果显示,Stanford 分型、收缩压、舒张压、肌酐、血糖、α-HBDH、血钠、血钙与AAD患者术后院内死亡可能相关(P<0.05),见表3;然后再以单因素分析差异有统计学意义的变量为自变量,进行多因素Cox回归模型分析,结果显示,Stanford A型〔HR=3.634,95%CI(1.638,8.086),P=0.002〕、血糖〔HR=1.077,95%CI(1.025,1.132),P=0.002〕、α-HBDH〔HR=1.001,95%CI(1.001,1.002),P<0.001〕、血钠〔HR=1.068,95%CI(1.029,1.109),P=0.001〕是AAD患者术后院内死亡的影响因素。
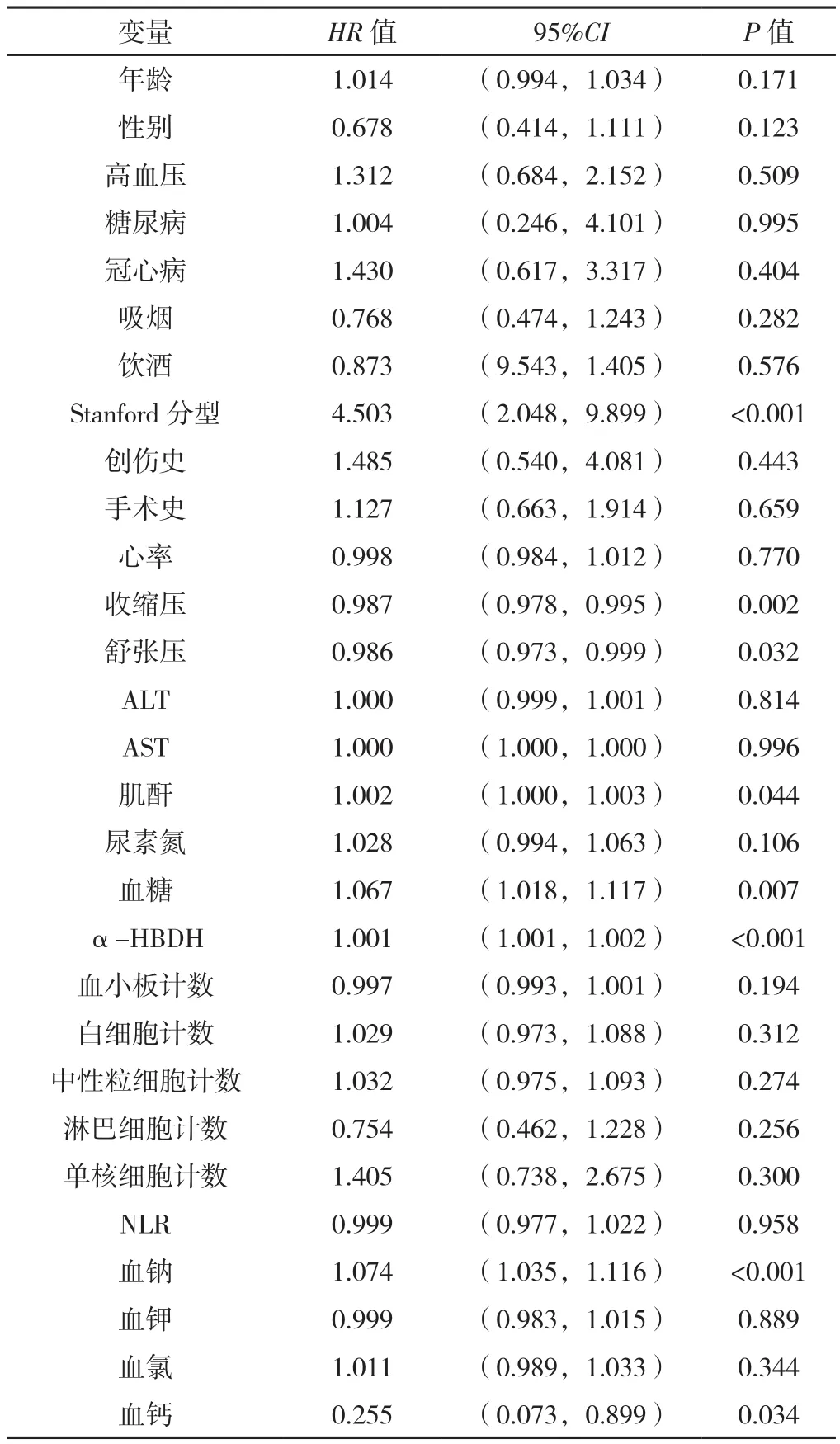
表3 AAD患者术后院内死亡的单因素Cox回归模型分析Table 3 Univariate Cox regression analysis for in-hospital postoperative 30-day mortality in AAD patients
3 讨论
本研究评估了415例AAD患者入院时血钠水平与术后院内死亡的关系,结果显示当AAD患者入院血钠水平较高时,其术后院内死亡风险增加。即使调整了性别、年龄、Stanford分型、高血压、糖尿病等混杂因素,高血钠水平仍与住院死亡相关。
AAD是一种致命的心血管疾病[10]。由于自发性AAD发生和发展的潜在机制尚不清楚,针对这些患者的筛查或预防策略尚未制定[11]。既往研究发现,术前肌酐、尿酸、血清肌腱蛋白-C和炎性因子均与AAD术后死亡相关[12-15]。此外,较差的器官灌注和血流动力学状况,如低血压、休克、心包填塞、脉搏不足和肾衰竭,可进一步增加AAD患者的死亡率[16]。
血钠在参考范围内或高于参考范围,是脱水和高盐消耗的常见后果[7],与左心室收缩力降低、外周胰岛素抵抗增加和神经肌肉紊乱有关[17]。高钠摄入或过量醛固酮会增加与T淋巴细胞和巨噬细胞相关的局部和全身炎性反应[18]。有研究报道,血钠水平变化可能会影响血管功能,如OBERLEITHNER等[19]研究发现,在培养的人内皮细胞中,将钠水平从135 mmol/L升高到145 mmol/L后的几分钟内,细胞硬度增加了20%,这与一氧化氮的形成和内皮型一氧化氮合酶活性的降低有关,表明血钠水平的改变可能会影响血管内皮功能,从而控制血管张力。DMITRIEVA等[20]研究发现,血钠水平可显著预测冠心病的10年风险,并证明细胞外钠水平的轻微升高会增加内皮细胞中促炎递质的表达及其黏附特性,并伴随着血管生物学的改变,从而促进心血管疾病的发展。ANZAI等[21]发现主动脉夹层外膜中大量的中性粒细胞聚集导致主动脉夹层发生以及随后的主动脉破裂。同样在本研究中,血钠水平最高的AAD患者(Q4组)的中性粒细胞计数明显高于其他3组,提示血钠可能通过中性粒细胞诱发和/或促进主动脉夹层的形成和发展,但其具体的分子机制有待进一步研究。
根据既往文献报道[6-8]得知,即便患者没有被诊断为高钠血症(血钠水平>145 mmol/L),参考范围内的血钠水平仍会影响住院患者的死亡率,因此,本研究按照AAD患者入院时血钠检测结果的四分位数进行分组。另外,入院时血钠检测报告结果均为整数值,且分布较为集中,致使各组样本量有少许差异,但本研究结果同样显示,Q3(血钠水平为139~140 mmol/L)和Q4(血钠水平≥140 mmol/L)组术后院内死亡率明显高于Q1(血钠水平≤136 mmol/L)组(P<0.05),即血钠水平≥139 mmol/L时,会增加AAD患者术后的院内死亡率。生存曲线结果显示,术后短期生存率从Q1到Q4组呈现递减趋势(P=0.012),Q3、Q4组的生存率低于Q1组。
AAD依据发病部位分为Stanford A型和Stanford B型主动脉夹层,其中A型相较B型更为凶险,死亡率高达90%。尽管在影像学、围术期护理和外科技术方面取得了重大进步,此分型患者手术死亡率在过去20年中仍保持在10%~30%相对不变[22]。ABDELHAMEED等[23]报道Stanford A型主动脉夹层患者术后早期死亡率为15.4%。本研究结果显示,Stanford A型主动脉夹层患者的住院死亡率较高,为22.09%(57/258),血钠升高的Stanford A型主动脉夹层患者术后死亡率也较高(Q1组为9.52%、Q2组为16.42%、Q3组为30.51%、Q4组为31.88%,P=0.004),提示入院时血钠水平可能与Stanford A型术后早期死亡有关。
AAD围术期强烈的应激反应常伴随应激性高血糖,可导致严重的围术期并发症[24],而且血糖是AAD发生的独立相关因素[25]。本研究结果显示,入院血糖是AAD患者院内死亡的独立危险因素(HR=1.077,P=0.003)。α-HBDH是一种心肌酶,可以用于心肌梗死的诊断[26],也与腹股沟动脉粥样硬化的发生有关[27],而动脉粥样硬化与AAD的发生、发展有关[28],本研究结果得出α-HBDH是AAD患者院内死亡的影响因素,但具体原因有待进一步研究。
另外,本研究有一定局限性。第一,本研究是一项单中心研究,未来仍需进行多中心研究,来更充分证明入院时血钠水平与AAD患者术后院内死亡的关系。第二,本研究仅观察了入院时血钠水平对AAD患者短期预后的影响,对长期预后的影响有待研究。
综上所述,入院时血钠水平与AAD患者术后院内死亡相关,高水平的血钠可能会增加其术后院内的死亡率,临床上应该对入院时血钠水平较高的AAD患者给予足够重视。
作者贡献:王洪岩、马冬进行文章的构思与设计,进行结果的分析与解释,进行论文及英文的修订;王洪岩、赵永波、马冬进行研究的实施与可行性分析;王洪岩、刘晓、苏鹏、张瑾瑾、马烁、潘哲、史珏鑫、侯芳芳、张娜娜、郑晓慧、刘楠、张菱进行数据收集;王洪岩进行数据整理,统计学处理,撰写论文;马冬负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
