高血压脑出血后血红蛋白对NO、Peroxynitrite的影响及临床意义
2021-09-16谢腾刘华明李斌张纯伟罗宝昌袁红刚喻小平刘文黄志军
谢腾,刘华明,李斌,张纯伟,罗宝昌,袁红刚,喻小平,刘文,黄志军
(湖北省汉川市人民医院/武汉大学人民医院汉川医院神经外科,湖北 汉川 431600)
0 引言
高血压脑出血是一种常见的,危害极大的脑血管疾病。作为脑卒中高发国家,我国高血压脑出血年发病率高达50.6/10万~80.7/10万。位居我国老年人三大死亡原因之首[1]。然而,到目前为止高血压脑出血缺乏根本有效的治疗方法。血肿周围脑水肿的形成与发展是脑出血患者病情恶化、致残、致死的主要原因,也是评估脑出血患者神经功能预后的可靠指标[2]。研究表明,脑出血后红细胞崩解所释放的血红蛋白(Hb)可能是导致血脑屏障损伤的重要病理介质之一,能够诱导、加重脑水肿形成,但是其潜在的分子机制仍不明确。一氧化氮(NO)是一种具有双重作用的调节分子,由一氧化氮合酶 (主要包括神经元型一氧化氮合酶(nNOS),诱导型一氧化氮合酶(iNOS)和内皮型一氧化氮合酶(eNOS))以L-精氨酸为底物合成。在氧化应激情况下,NO与超氧阴离子(O2-)所形成的代谢产物过氧化亚硝酸盐(peroxynitrite)是一种毒性大、破坏性极强的氧化硝化产物。在多种中枢神经系统疾病,如脑缺血、脑栓塞、创伤性脑损伤及急性细菌性脑膜炎中,大量产生的peroxynitrite可导致明显的血脑屏障破坏、脑水肿形成及神经功能缺损。然而,高血压脑出血后Hb对NO/ peroxynitrite的影响仍不明确。本研究拟探讨高血压脑出血后Hb对NO、Peroxynitrite的影响及临床意义,为今后高血压脑出血的治疗提供进一步的理论依据。
1 材料与方法
1.1 实验试剂、仪器和动物
血红蛋白(美国sigmal公司,批号:H7379),一氧化氮检测试盒(硝酸还原酶法,南京建成生物工程研究所),鼠抗3-硝基酪氨酸抗体(美国Abcam公司),兔抗claudin-5(美国Novus公司),驴抗鼠荧光二抗-594(美国Invitrogen公司),3-硝基酪氨酸Elisa检测试剂盒(美国Abcam公司),GAPDH(美国CST公司)(大鼠多功能脑立体定向仪(美国Stoelting公司),BCA蛋白浓度测定试剂盒(碧云天生物技术研究所),石蜡切片机(德国Leica公司),多功能酶标仪(美国Molecular Devices公司),激光共聚焦荧光显微镜及成像系统(日本OLYMPUS公司)。SPF级健康成年雄性SD大鼠140只,体质量280~300 g,由广东省医学实验动物中心提供。
1.2 实验分组及模型制作
按随机数字表法将SD大鼠分为假手术(Sham)组和高血压脑出血(HICH)组,每组按观察时间不同再分为6h、12h、1d、2d、3d和7d 共6个亚组。动物模型建立:参照Zeng等[3]方法制备大鼠高血压脑出血模型。用内径0.2 mm的银夹狭窄双侧肾动脉造成大鼠肾血管性高血压,术后60d形成稳定的高血压后,在立体定位下向肾血管性高血压大鼠右侧尾状核(前囟前0.2 mm,矢状缝右3.0 mm,深6mm) 缓慢匀速注入20uL血红蛋白(浓度:150g/L),诱导肾血管性高血压脑出血大鼠模型。造模后大鼠左侧前肢回收屈曲,右侧前肢伸展;向左侧推大鼠时阻力较右侧降低;有向左侧旋转的行为。判断为造模成功,否则为失败。假手术组大鼠按同法造成肾血管性高血压后,向右侧尾状核内注入等量生理盐水。
1.3 实验方法
1.3.1 ELisa法检测脑组织及血清中3-硝基酪氨酸变化
麻醉大鼠后,打开胸腔,心脏穿刺抽取2mL全血,室温下静置2h,离心(4000转,10min)取上清,储存于-80℃冰箱备用。同时,断头取脑,取Hb损伤处周围脑组织约100mg,加入等量生理盐水捣碎、匀浆,3000 转离心30min取上清,同法储存备用。Elisa检测方法如下:往预先包被3-NT抗体的微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤,然后底物TMB显色。用多功能酶标仪在450nm 波长下测定吸光度(OD)值,计算样品浓度。
1.3.2 硝酸还原酶法检测脑组织及血清中NO含量
血清及脑组织制备方法同Elisa检测。按照硝酸还原酶法测定血清和脑组织中NO水平。采用BCA法测定脑组织中的蛋白浓度。血清中NO含量表示为μmol/L,脑组织中NO含量表示为μmol/gprot。
1.3.3 免疫荧光检测3-硝基酪氨酸的表达、细胞定位及其与紧密连接蛋白claudin-5的位置关系
石蜡切片制作:麻醉大鼠后并固定,先后用生理盐水和4%多聚甲醛溶液行心脏灌注。切取损伤处脑组织,于4%多聚甲醛溶液中浸泡24h后,按照常规石蜡包埋法制成石蜡标本并切片,切片厚度为3-5μm,捞片、风干后备用。免疫荧光检测:石蜡切片脱蜡至水,在柠檬酸缓冲液(0.01 mol/L)中给予微波热修复25-30min,血清封闭后滴加一抗,4℃孵育12-24h,PBS溶液冲洗后滴加相应荧光二抗,37℃孵育1h。荧光显微镜或共聚焦显微镜下观察、拍照、分析。荧光双染(3-Nitrotyrosine与CD68;3-Nitrotyrosine与Claudin-5)时,两种一抗混匀后再孵育,相应的荧光二抗也需混匀孵育。
1.3.4 Westernblot法检测脑组织中紧密连接蛋白claudin-5的表达变化
大鼠深度麻醉后,断头取脑,取Hb损伤处及周围脑组织约100mg,-80℃冰箱或液氮中保存备用。组织标本经匀浆、裂解、超声破碎、离心后,采用Bradford法蛋白定量。蛋白裂解液依次经过电泳、转膜、孵育一抗(claudin-5:1:800)及二抗、显影及定影。GAPDH(1:1000)作为内参。凝胶成像系统扫描并分析claudin-5蛋白表达变化。
1.3.5 脑组织水含量测定
在不同时间点深度麻醉大鼠、断头取脑,沿中线切开左右两侧大脑半球,去除小脑和脑干后,用电子分析天平称量造模侧鼠脑半球湿重。将脑组织放入烤箱中烘烤(100℃,持续24h),再次用电子天平称其干重。脑组织含水量(%)=[(湿重—干重)/湿重]×100%。
1.4 统计学方法
采用SPSS 19.0软件进行统计学分析,计量资料用均数±标准差(mean±SD)表示,两组间比较采用t检验,多组间比较采用ONE-WAY方差分析,多重比较用LSD-t检验或Dunnett’s T3检验。3-NT水平与脑水含量和神经功能缺损之间的相关性采用Spearman秩相关分析,以*P<0.05为差异有统计学意义。
2 结果
2.1 不同时间点脑组织中脑水含量的变化
与Sham相比,HICH组高血压大鼠脑水含量从6h开始逐渐升高,24h达到最大值,维持在较高水平直至3d,后逐渐下降。HICH组大鼠在各时间点脑水含量均明显高于Sham组,差异有统计学意义(P<0.05),如表1所示。(不同时间点的Sham组中,脑水含量变化差异无统计学意义,P>0.05)。
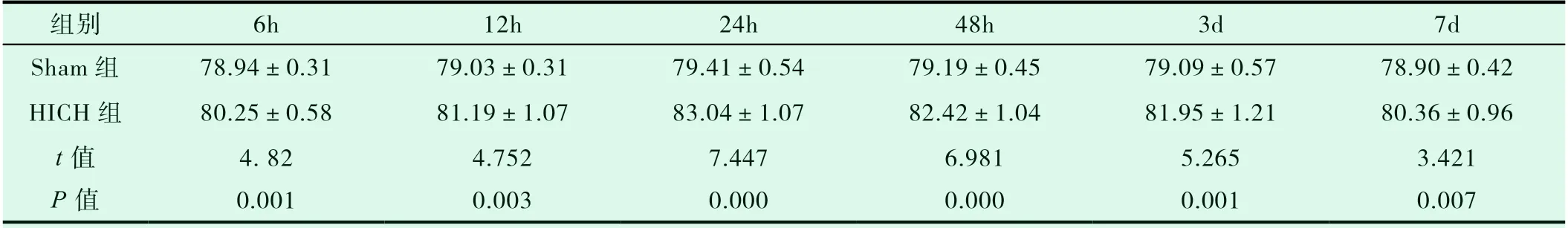
表1 术后不同时间点两组大鼠脑水含量变化 (mean ± SD)
2.2 不同时间点血清及脑组织中NO水平变化
Sham 6h组和HICH组各时间点血清及脑组织中NO水平变化见表2。HICH组血清中NO在6h开始下降,12h明显降低,随后24h至48h又相对增加但仍低于假手术组;在3d时降至最低,而7天时又有所回升。与Sham 6h相比,HICH组12h、24h、48h、3d和7d时血清中NO含量均显著降低,差异有统计学意义(P<0.05)。而脑组织中NO在6h也开始下降,但12h时开始升高,3d时达到最高值,而在7d时又明显下降但仍高于Sham 6h组。与Sham 6h组相比,HICH组12h、24h、48h和3d脑组织中NO含量均显著升高,差异有统计学意义(P<0.05)。
2.3 不同时间点血清及脑组织中peroxynitrite水平变化
由于过氧化亚硝酸盐(peroxynitrite)具有不稳定性,3-nitrotyrosine(3-NT)可作为peroxynitrite产生可靠的生物学标志[4]。如表2所示,Elisa检测结果提示HICH注入后6h高血压大鼠血清中的3-NT水平开始增加,后逐渐上升,在第48h达到峰值,然后逐渐下降;而脑组织中的3-NT水平呈现相同的趋势,不同的是其在第3d达到峰值。不同HICH组血清和脑组织中的3-NT水平与Sham 6h组之间差异有统计学意义(P<0.05)。此外,免疫荧光观察显示脑组织中3-NT也呈现相似的表达趋势(如图1所示);荧光双染显示3-NT主要表达在CD68阳性的小胶质细胞/巨噬细胞中,如图2所示。
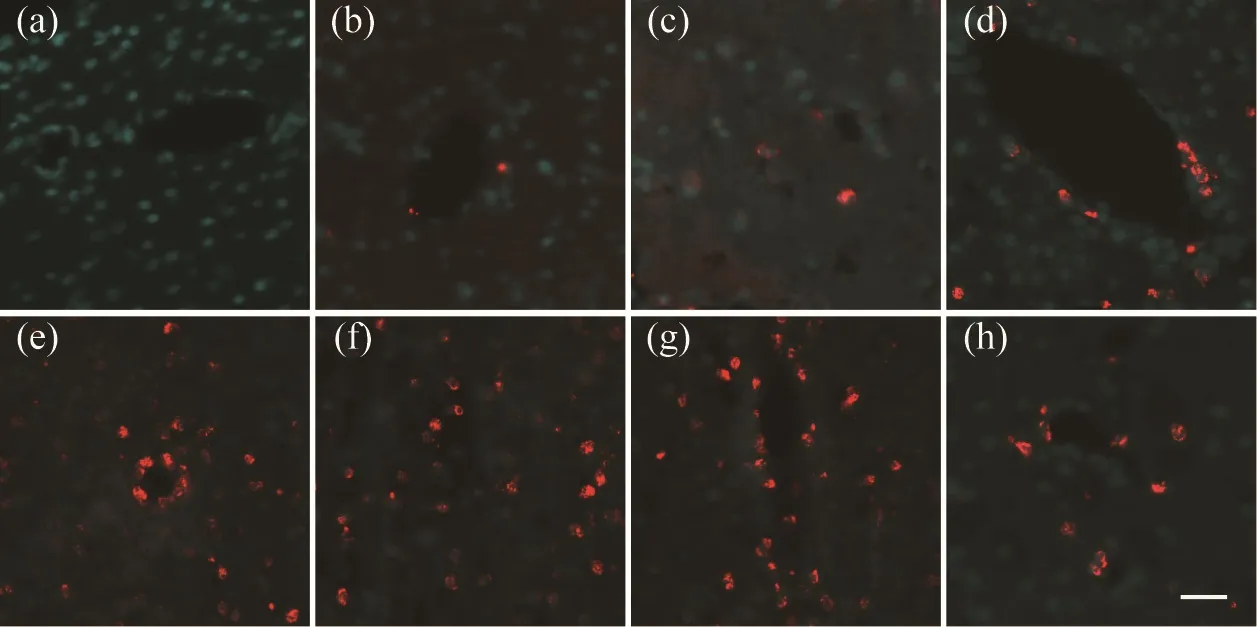
图1 高血压脑出血(HICH)后不同时间点3-NT的表达
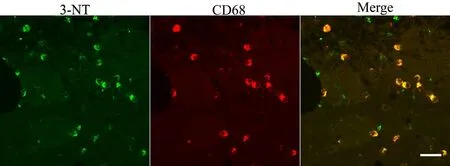
图2 3-硝基酪氨酸(3-NT)的细胞定位
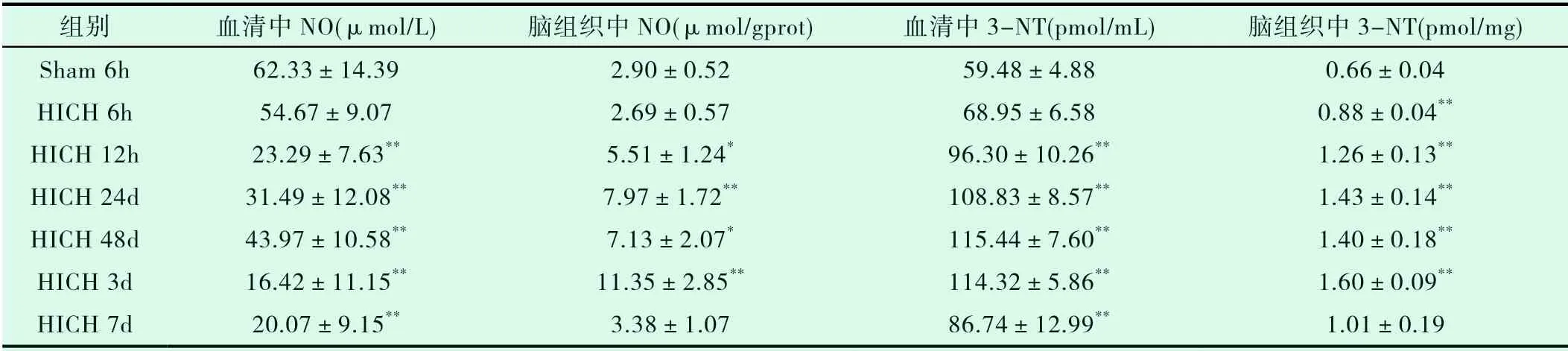
表2 各组高血压脑出血大鼠中脑组织和血清中NO、3-NT水平比较(mean±SD)
2.4 紧密连接蛋白claudin-5的表达、分布变化及其与3-NT的位置关系
Claudin-5与3-NT荧光双标显示(图3A),在Sham 3d组中,表达完整、连续的claudin-5血管周围无明显的3-NT表达;而在HICH 3d组中,血肿周围脑组织血管壁上claudin-5表达、分布明显减少,而其毗邻部位却发现大量密集的3-NT产生。此外,WesternBlot结果也提示,在HICH 3d,血肿周围组织中紧密连接蛋白claudin-5表达也明显减少(图3B),差异有统计学意义(P<0.01),提示3-NT的形成与血脑屏障破坏之间可能存在紧密联系。
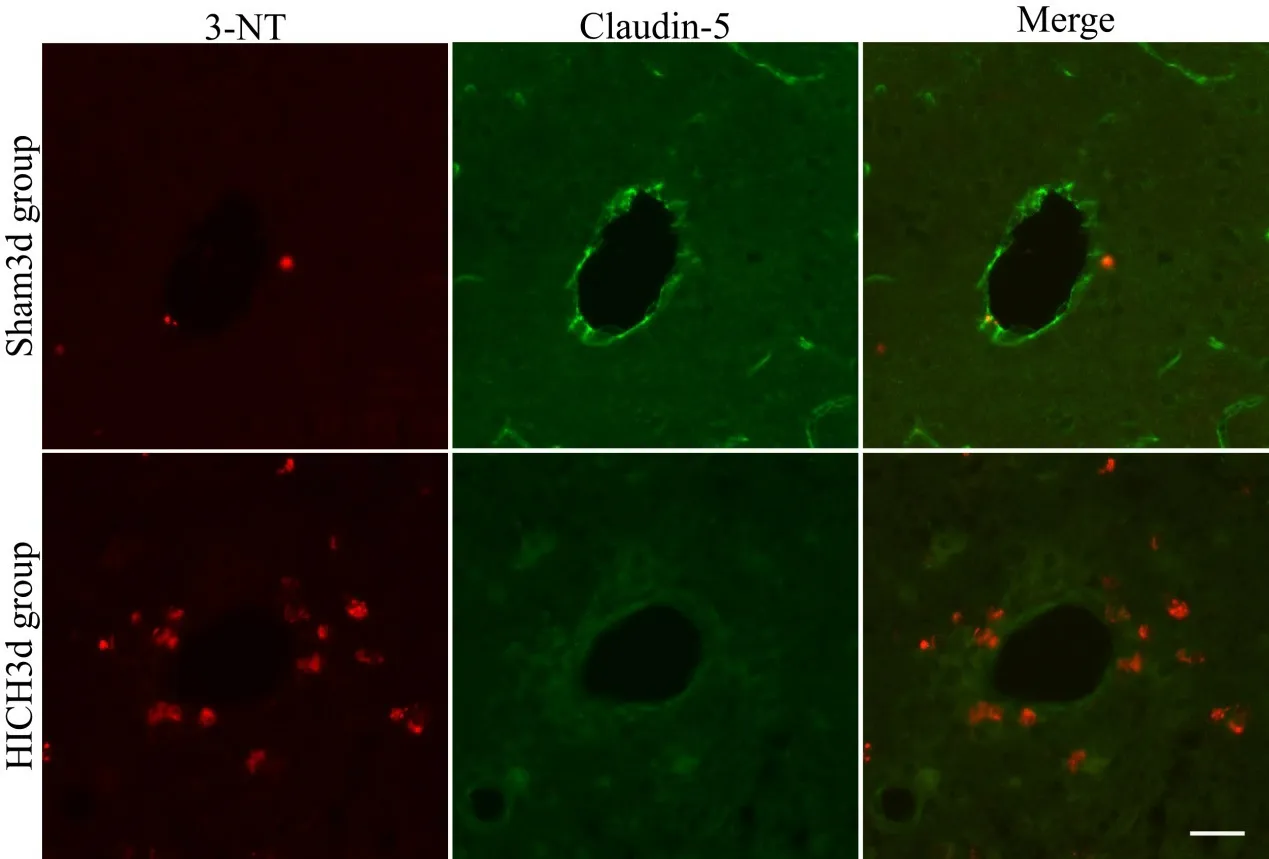
图3 A Sham 3d组和HICH 3d组中3-NT与Claudin-5的荧光双标(标尺=30um)
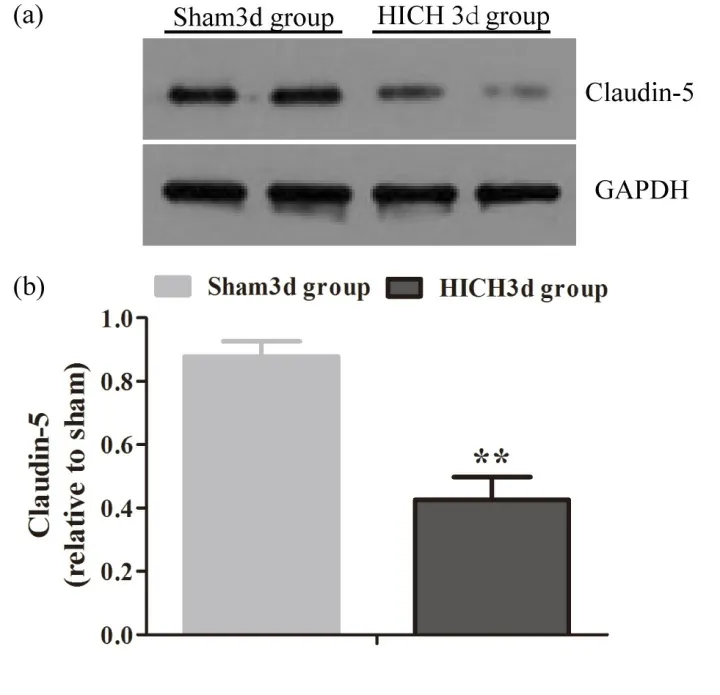
图3 B Westernblot检测Sham 3d组和HICH 3d组中Claudin-5的表达水平
2.5 相关性分析
不同时间点HICH大鼠脑水含量变化与脑组织中3-NT含 量 变 化(r=0.771,P=0.001,4A)和 血 清 中3-NT水 平 变化(r=0.824,P=0.001,4B)之间均有显著正相关性。不同时间点HICH大鼠脑水含量变化与脑组织中NO含量变化之间也存在显著正相关性(r=0.592,P=0.001,4D),而与血清中NO水平变化之间则存在一定的负相关性(r=-0.327,P=0.034,4E)。不同时间点HICH大鼠血清中3-NT含量变化与脑组织中的3-NT水平有显著的正相关性(r=0.922,P=0.001,图4C)。
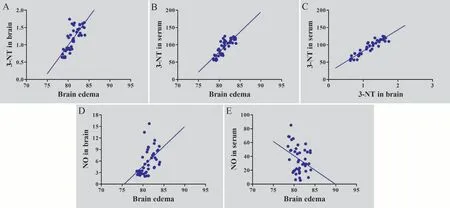
图4 不同指标间相关性分析
3 讨论
高血压脑出血(HICH)是最常见的脑血管病之一,也是神经外科最常见的急危症之一[5]。在我国,高血压脑出血约占急性脑血管病的20%—30%,其致死率和致残率均占脑血管病患者的首位[6]。脑水肿的形成是脑出血后最严重的并发症,而且相对增加的水肿程度被认为是可靠的预测神经功能缺损指标[7]。报道显示,红细胞崩解所产生的Hb能够诱导、加重脑水肿形成[8],但是其潜在的分子机制仍不明确。
一氧化氮(NO)是一种具有双重作用的调节分子,既有神经血管保护功能,也可发挥神经毒性作用,主要取决于其来源、浓度以及周围微环境中的氧化还原状态。据Chiang报道,在脑出血患者脑脊液中NO含量明显升高且与临床预后呈负相关[9]。而Rashid等证实在急性中风患者中,血浆NO水平是降低的,且其降低的程度与中风的严重程度和预后密切相关[10]。我们的实验研究发现,高血压脑出血大鼠脑组织中的NO含量在多数时间点呈现升高趋势,而血清中NO水平在不同时间点却大部分是降低的。其主要原因可能是:(1)高血压本身可导致内皮功能不良及内皮来源的NO合成减少[10]; (2)NO与血液中的氧合血红蛋白结合而被清除或被血管中的中性粒细胞消耗所致[11];(3)在氧化应激情况下,激增的活性氧和活性氮类代谢产物Peroxynitrite不仅可消耗大量NO(本实验中大鼠脑组织和血清中的Peroxynitrite水平均明显增加)而且可明显抑制eNOS或iNOS表达与活化[12-14];(4)异常的或脱偶联eNOS直接产生O2-与血液中的NO反应产生Peroxynitrite所致[12]。此外我们也发现,高血压脑出血大鼠脑组织中的NO产生水平与大鼠脑出血后脑水含量之间有明显的正相关性;而血清中的NO产生水平与大鼠脑水含量之间则存在一定的负相关性,与前人研究结果基本一致[9,10]。由此我们可知,高血压脑出血后血清中NO水平不一定与脑组织的NO水平一致。
在氧化应激情况下,NO与超氧阴离子(O2-)结合可迅速产生过氧化亚硝酸盐(peroxynitrite)。近年来,越来越多的证据显示:NO的细胞毒性作用主要取决于Peroxynitrite的形成[4];此外也有研究提示:peroxynitrite可能是真正介导脑出血后持续性脑损伤的原因[15,16]。其主要理由是:Peroxynitrite具有很强的特异性的反应性以及具有强大的侵袭能力(主要表现为高的扩散率和高的细胞膜穿透率)[17,18]。据报道,Peroxynitrite渗透系数比超氧化物快约400倍,在其被质子化或者清除前,它可以对其周围6个细胞直径范围内的微环境产生损伤性影响[17]。脑出血后脑水肿的形成主要包括细胞毒性水肿和血管源性水肿。相似地是,Peroxynitrite也涉及上述两种类型的水肿形成,主要解释如下:(1) Peroxynitrite可直接激活MMP-9或通过硝化修饰MMP-2的半胱氨酸残基导致其活化,从而间接破坏BBB,导致血管源性脑水肿[19,20]; (2) Peroxynitrite能够硝化细胞色素C还原酶(复合体Ⅲ)和ATP合酶(复合体Ⅴ)等,从而损伤细胞的能量代谢;此外,Peroxynitrite能够修饰Na-K-ATP酶的半胱氨酸残基,抑制Na-K-ATP酶的活性,从而导致胞浆离子失衡及伴随的细胞毒性脑水肿[4]。在我们的研究中,Hb注入高血压大鼠脑内后,脑水含量从6h开始增加,24h达到最大值,维持在较高水平直至3-7d,后逐渐下降。有趣地是,高血压大鼠脑出血后,脑组织中3-NT水平变化与脑水含量之间具有明显的相关性。此外,荧光双标分析显示,HICH后3d,3-NT表达明显的部位,毗邻血管表达的claudin-5则明显减少,这表明peroxynitrite的产生可能是导致BBB破坏的主要原因之一,而BBB的破坏则可加重脑水肿的形成。研究证实,通过peroxynitrite清除剂FeTPPS清除脑出血后产生的过多peroxynitrite,可明显抑制血肿周围MMP-9的活化,改善脑出血后神经血管损伤[21]。因此,我们推测Peroxynitrite很可能是高血压脑出血后Hb介导脑水肿形成的主要原因。
大量的证据显示,在多种继发性中枢神经损伤中,Peroxynitrite可导致BBB破坏、内皮功能失调、神经元及胶质毒性等。通过抑制或清除Peroxynitrite,可以逆转或减轻其损害作用,如改善BBB通透性增加,减轻脑水肿形成及改善神经功能缺损等[12,21,22]。我们的研究发现,高血压脑出血大鼠血清中3-NT在不同时间点表达水平与脑组织中的3-NT水平有明显的相关性。更有意义地是,血清中的3-NT水平与脑水含量的变化之间也具有显著的相关性。因此,我们推测Peroxynitrite可能是一个可靠的判断HICH后脑水肿严重程度的生物学指标。
