基于网络药理学探讨清胰汤治疗急性胰腺炎的作用机制
2021-09-16王夏雨施继禹贾傲杨振伟崔云峰
王夏雨,施继禹,贾傲,杨振伟,崔云峰
(1.天津医科大学研究生院,天津 300070;2.天津市南开医院肝胆胰外科,天津 300100)
急性胰腺炎(acute pancreatitis,AP)是临床中较为常见的外科急腹症之一,具有发病急、进展快的特点,经常出现局部和全身并发症,病情较重者可发生全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),甚至出现器官功能的衰竭[1]。目前尚没有针对AP发病的特效药物,治疗多以对症支持治疗为主[2]。中药因其多靶点的药理活性特征,在治疗AP的实践中相较于西药具有更佳的疗效和预后价值[3]。清胰汤(QingyiTang,QYT)及其加减方作为全国广泛运用的AP治疗方剂,在临床实践过程中疗效显著[4]。现已有研究显示QYT可通过抗凋亡、减少坏死、减轻炎症反应等途径起到治疗AP的作用[5],但其具体治疗靶点、作用机制仍待探索。本文以网络药理学为基础,探讨QYT治疗AP的潜在分子机制,并对通过筛选得到的重要生物学进程进行实验验证,以期为QYT治疗AP的分子机制提供理论依据。
1 材料和方法
1.1 建立QYT化合物数据库 通过BATMANTCM中药系统药理数据库,依次检索QYT全方中药(柴胡、黄芩、延胡索、黄连、木香、白芍、大黄、芒硝)化学成分。根据BATMAN-TCM数据库中药物动力学参数,得到活性成分作为候选化合物及靶点。去重后得到与有效成分关联的靶点1 853种,构建QYT化合物数据库。
1.2 AP预测靶点的筛选 通过Gene Cards数据库(https://www.genecards.org/)以“acute pancreatitis”为关键词检索,筛选收集AP相关靶点,并将疾病数据库靶点信息进行整理。
1.3 QYT对AP的共同靶点获取 将QYT药物靶点与疾病靶点于Venny在线软件作图工具平台(https://bioinfogp.cnb.csic.es/tools/venny/)录入取交叉,得到药物与疾病发生作用的共同靶点。
1.4 “中药-活性成分-靶点”网络模型构建 将QYT全部中药活性成分靶点和AP疾病靶点蛋白导入至Cytoscape3.7.1软件,生成“中药-活性成分-靶点”的网络图。
1.5 药物-疾病靶点蛋白相互作用网络构建 将筛选得到的“QYT-AP”活性化合物成分共同靶蛋白录入STRING 11.0[6](https://string-db.org/)数据库,分析得到蛋白-蛋白互相作用(protein-protein interaction,PPI)网络。
1.6 功能富集分析 将QYT治疗AP的作用靶点,以Gene Symbol的格式导入DAVID(https://david.ncifcrf.gov/)进行基因本位论功能(gene ontology,GO)富集分析和京都基因与基因组百科全书通路富集分析(Kyoto encyclopedia of genes and genomes,KEGG)。设定阈值P<0.05,筛选具有显著性差异的生物学过程和通路。
1.7 动物实验
1.7.1 药物和仪器 雨蛙肽及脂多糖购自Sigma;中药QYT[柴胡5 g,黄芩3 g,胡黄连3 g,白芍5 g,木香3 g,延胡索3 g,生大黄(后下)5 g,芒硝3 g]购自天津市南开医院药房,采取水煎法制备药物:药液比例为1:1的QYT浓缩液;α-淀粉酶(AMS)试剂盒(淀粉-碘比色法)购自南京建成生物工程研究所;LC3、P62、β-actin抗体均购自Abcam公司。石蜡组织块包埋机、病理切片机、摊片机、烘片机、病理染色机、全自动玻璃盖片机、显微镜均为美国Leica公司。
1.7.2 实验动物准备及分组24只体重为20~22 g雄性健康C57 BL/6小鼠(SPF级),购自北京华阜康生物科技股份有限公司[小鼠许可证号:SCXK(京)2014-0004],饲养于天津市南开医院试验动物中心。适应性喂养1周后,将小鼠随机分为正常对照组8只,AP模型组(AP组)8只,QYT+AP模型组(QYT组)8只。全部小鼠在自由饮水条件下禁食12 h后开始实验。依据文献[7],采取雨蛙肽及脂多糖腹腔注射方法制备小鼠AP模型。对AP组、QYT组小鼠腹腔注射雨蛙肽(50 μg/kg),每小时1次,连续注射7次;在第7次注射的同时给予脂多糖(10 mg/kg)腹腔注射。QYT组在第1次雨蛙肽注射前1 h及第7次雨蛙素注射后1 h,予以QYT(10 mL/kg)灌胃。正常对照组小鼠予以同等次数、剂量的生理盐水腹腔注射及灌胃。
1.7.3 标本采集与检测 末次注药后12 h处死小鼠,收集小鼠血清样本。使用血清淀粉酶试剂盒检测血清淀粉酶含量,严格按照说明书操作进行;切取胰腺组织标本,一部分进行固定、包埋、切片、HE染色,封片后于光学显微镜下观察各组胰腺组织结构并依照Schmidt病理评分标准[8]对其严重程度进行评分。
1.7.4 胰腺组织自噬情况检测 取小鼠胰腺组织1 mm3于4℃条件下用2.5%戊二醛固定2 h,经锇酸固定、乙醇脱水、丙酮浸润、3%醋酸铀-柠檬酸铅双染色后切片等步骤,于透射电镜下观察胰腺组织并拍照。
1.7.5 自噬相关蛋白表达检测 另取部分小鼠胰腺组织,于含PMSF的RIPA裂解液中充分匀浆裂解,进行BCA蛋白定量检测蛋白浓度后,采用Western印迹法检测自噬标志蛋白LC3Ⅱ、LC3Ⅰ、P62蛋白表达情况,经SDS-PAGE电泳、PVDF转膜、封闭、发光成像等步骤,用Image J软件分析灰度值以获知蛋白表达水平。
1.8 统计学处理 所有数据采用Graph Pad Prism8.0.2软件进行处理,计量资料用±s表示,通过单因素方差分析比较各组间差异,P<0.05表示差异具有统计学意义。
2 结果
2.1 QYT化学成分数据库及化学成分作用靶点数据库的筛选 通过BATMAN-TCM数据库检索清胰汤全方8味中药,以Inference Score>20为筛选条件,柴胡共找到81种化合物,大黄58种,白芍35种,木香66种,黄芩63种,胡黄连23种,延胡索46种,芒硝(Na2SO4·10H2O)化合物信息未得到。删除重复值后,得到QYT中含有的214个化合物,并收集活性化合物的对应蛋白靶点,删除重复值后总共获取1 853个蛋白靶点。
2.2 AP疾病靶点数据库 通过在Gene Cards、CTD数据库中检索AP,选取Inference Score>20分的蛋白靶点,筛选得到疾病相关靶点为1 000个。
2.3 QYT-AP共同靶点的筛选 在Venny 2.1在线软件作图工具平台上输入1 853个药物靶点、1 000个疾病靶点,绘制韦恩图,两者取交集后获得药物-疾病共同靶点145个,见图1。
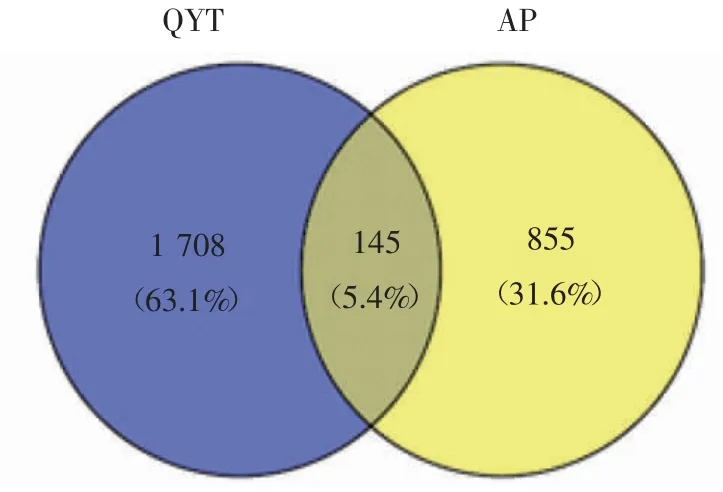
图1 QYT与AP靶点韦恩图Fig 1 Venn diagram of the target intersection of QYT and AP
2.4 QYT中药物活性化学成分和靶点QYT中有214个化合物,其中作用于145个药物-疾病共同靶点的化合物有121个,前30个化合物见表1。
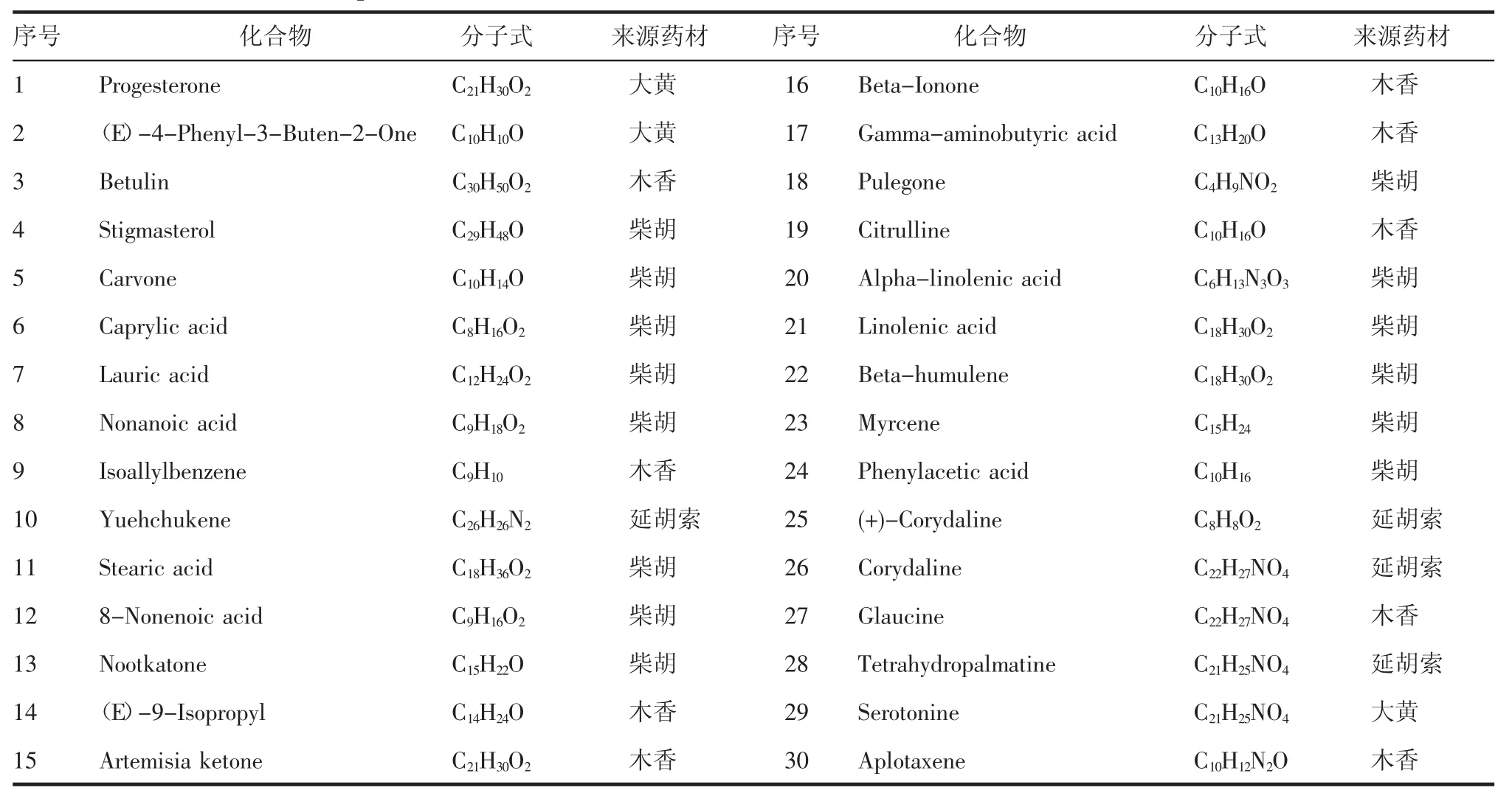
表1 QYT化合物表Tab 1 Basic information of compounds from QYT
2.5 QYT干预AP的PPI网络图 将145个QYT干预AP的靶点导入STRING数据库,设置可信度(interaction score)为0.7,得到PPI网络图,见图2。根据拓扑指标度值(degree)调节节点颜色深浅以突出核心靶点,Degree结果显示白细胞介素6(interleukin 6,IL6)、信号转导与转录激活因子(signal transducer and activator of transcription,STAT)3、肿瘤抑制蛋白53(tumor suppressor 53,TP53)、丝氨酸/苏氨酸激酶1(serine/threonine kinase 1,AKT1)、丝裂原活化蛋白激酶3(mitogen-activated protein kinase 3,MAPK3)等为QYT干预AP的核心靶点。

图2 QYT治疗AP的PPI网络Fig 2 PPI network of QYT in treating AP
2.6 GO生物学功能分析 通过DAVID数据库对145个共同靶点进行GO功能分析,根据FDR<0.05进行筛选,共得到富集信息1 310条,其中生物学过程(biological process,BP)1 190条,分子功能(molecular function,MF)62条,细胞组成(cellular compo nent,CC)58条;BP、MF和CC前10条富集信息见图3。MF分析可看出靶点主要涉及载体活性,染色质DNA结合,羰基还原酶等分子功能。CC分析得出靶点主要涉及线粒体、线粒体基质、细胞质等细胞成分。BP分析得出靶点主要涉及核因子(NF)-κB正向调节、炎症反应、MAPK激活、JAK-STAT级联反应等生物学过程。
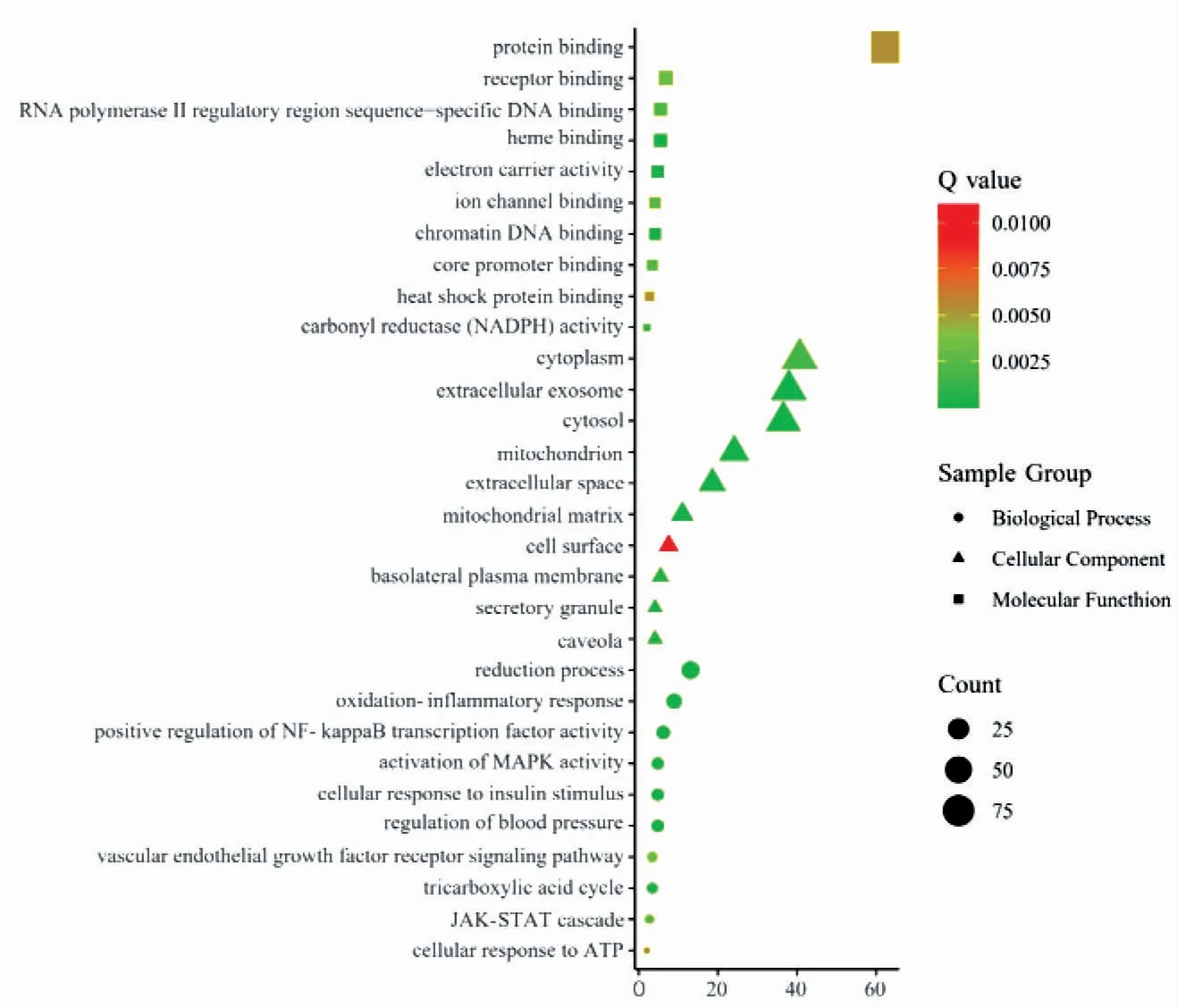
图3 QYT干预AP靶点GO功能富集Fig 3 GO function enrichment of QYT in treating AP
2.7 KEGG通路富集分析KEGG分析得到67条通路信息,依P值排序居前10位的结果见表2。
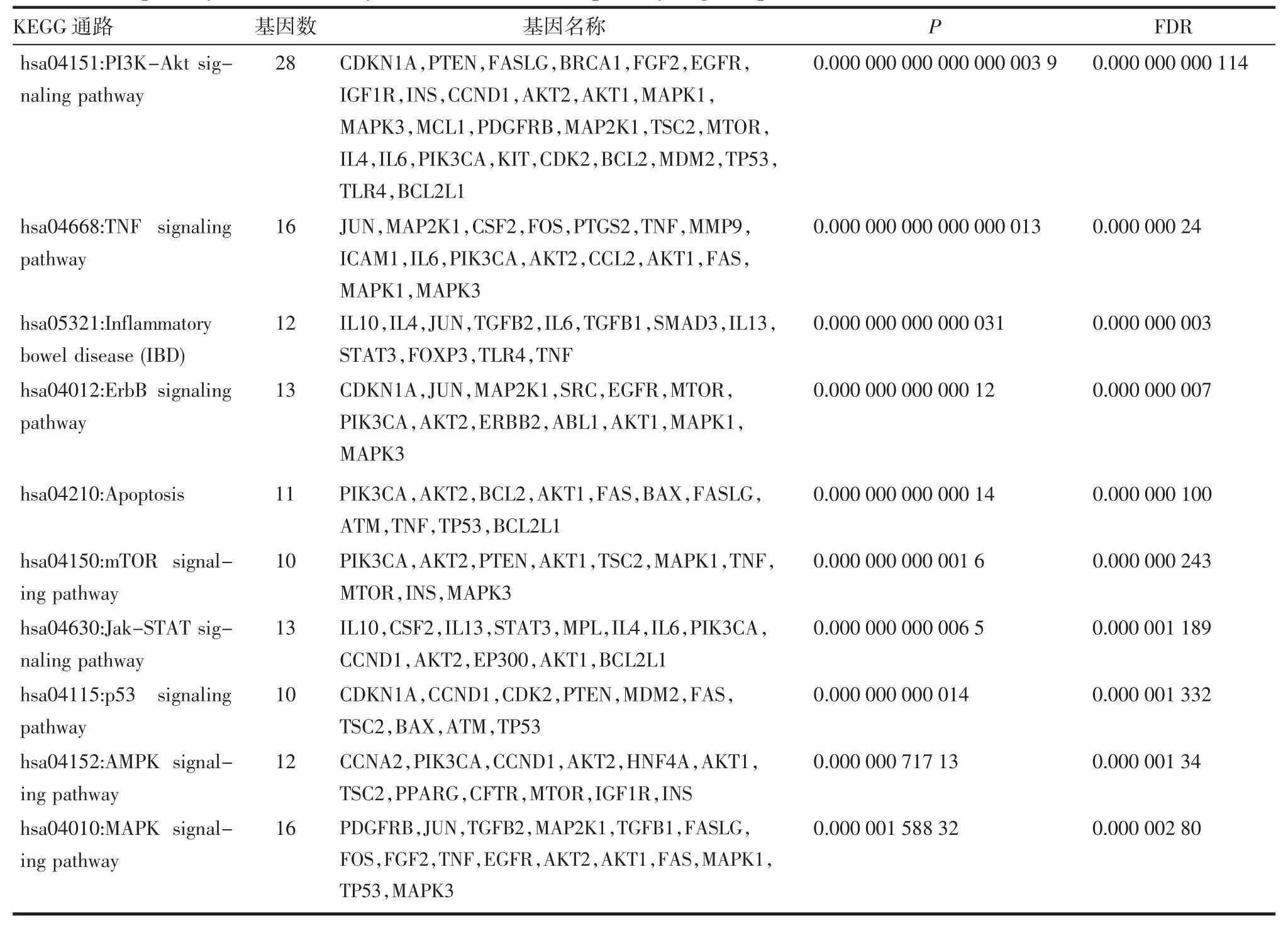
表2 KEGG富集分析潜在相关通路(前10位)Tab 2 KEGG pathway enrichment analysis for candidate related pathway targets(top10)
2.8 动物实验部分
2.8.1 各组小鼠血清淀粉酶结果 与正常对照组相比,AP组小鼠血清淀粉酶显著升高,差异有统计学意义(P<0.05),QYT组血清淀粉酶明显低于AP组,差异有统计学意义(P<0.05),见表3。
表3 各组小鼠血清淀粉酶含量比较(±s)Tab 3 Comparison of serum amylase levels between groups(±s)
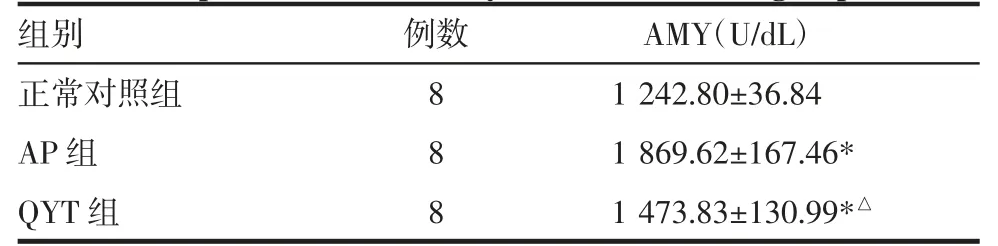
表3 各组小鼠血清淀粉酶含量比较(±s)Tab 3 Comparison of serum amylase levels between groups(±s)
注:AP组:急性胰腺炎模型组;QYT组:QYT给药+AP模型组;AMY:血清淀粉酶;与正常对照组比较,*P<0.05;与AP组比较,△P<0.05
?
2.8.2 胰腺组织病理变化HE结果可见正常对照组胰腺结构基本完整,组织被膜完整,细胞结构正常,排列紧密,无水肿和炎症浸润;AP组胰腺腺泡水肿,小叶结构破坏,间隔增宽,胰腺组织不同程度水肿坏死,伴大量炎性细胞浸润,胰腺导管内可见出血;QYT组也可见胰腺组织损伤,但程度明显较AP组降低,见图4。
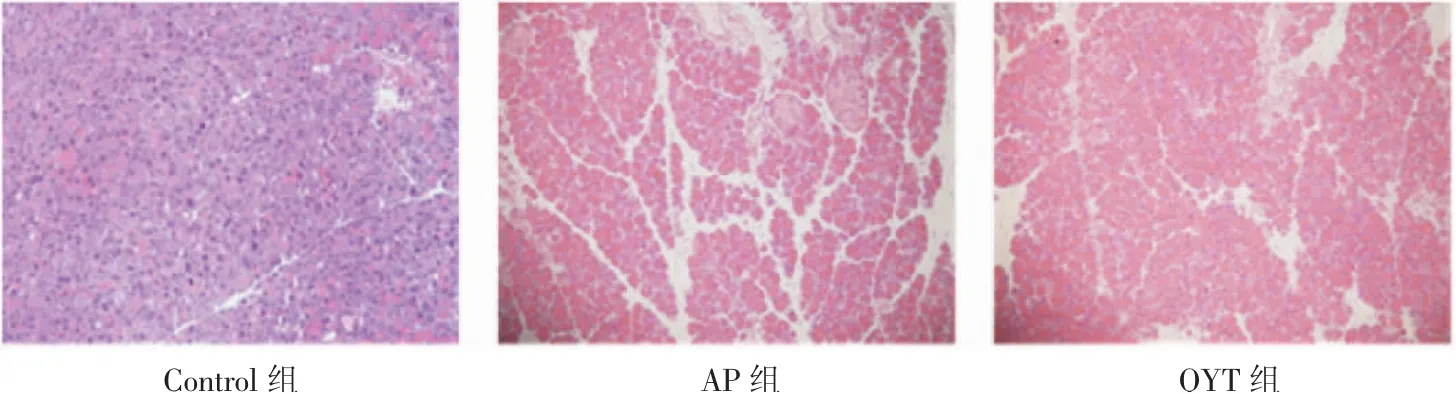
图4 各组小鼠胰腺组织HE染色(100×)Fig 4 HE staining of pancreatic tissues of all groups(100×)
2.8.3 胰腺组织病理评分 与正常对照组相比,AP组胰腺组织病理评分均明显升高,具有统计学意义,与AP组相比,QYT组各项病理评分均明显降低,具有统计学意义(表4)。
表4 各组小鼠胰腺病理评分(±s)Tab 4 Pancreatic pathology score of mice in all groups(±s)
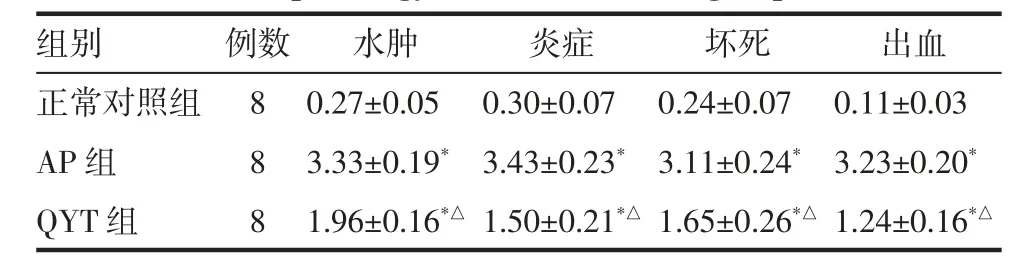
表4 各组小鼠胰腺病理评分(±s)Tab 4 Pancreatic pathology score of mice in all groups(±s)
注:AP组:急性胰腺炎模型组;QYT组:清胰汤给药+急性胰腺炎模型组;与正常对照组相比,*P<0.05;与AP组比较,△P<0.05
?
2.8.4 小鼠胰腺组织电镜结果 如图5所示,电镜下观察到正常对照组的腺泡细胞结构规则,基底区粗面内质网丰富;AP组中,细胞结构破坏,胞质内自噬空泡明显增多,酶原颗粒增加,个别可见细胞核固缩,线粒体肿胀、嵴消失;QYT组的胰腺腺泡细胞超微结构病理改变程度明显轻于AP组,细胞结构较为完整,酶原颗粒较正常对照组增多。
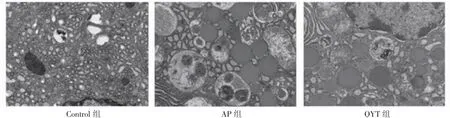
图5 各组小鼠胰腺组织超微结构电镜图(25 000×)Fig 5 Electron microscopy images of pancreatic tissues in all groups(25 000×)
2.8.5 蛋白印迹实验 与正常对照组相比,AP组小鼠胰腺组织的LC3Ⅱ/Ⅰ比值、P62表达水平均明显升高(均P<0.001);与AP组相比,QYT组中LC3Ⅱ/Ⅰ比值、P62表达水平降低(均P<0.001),见图6。
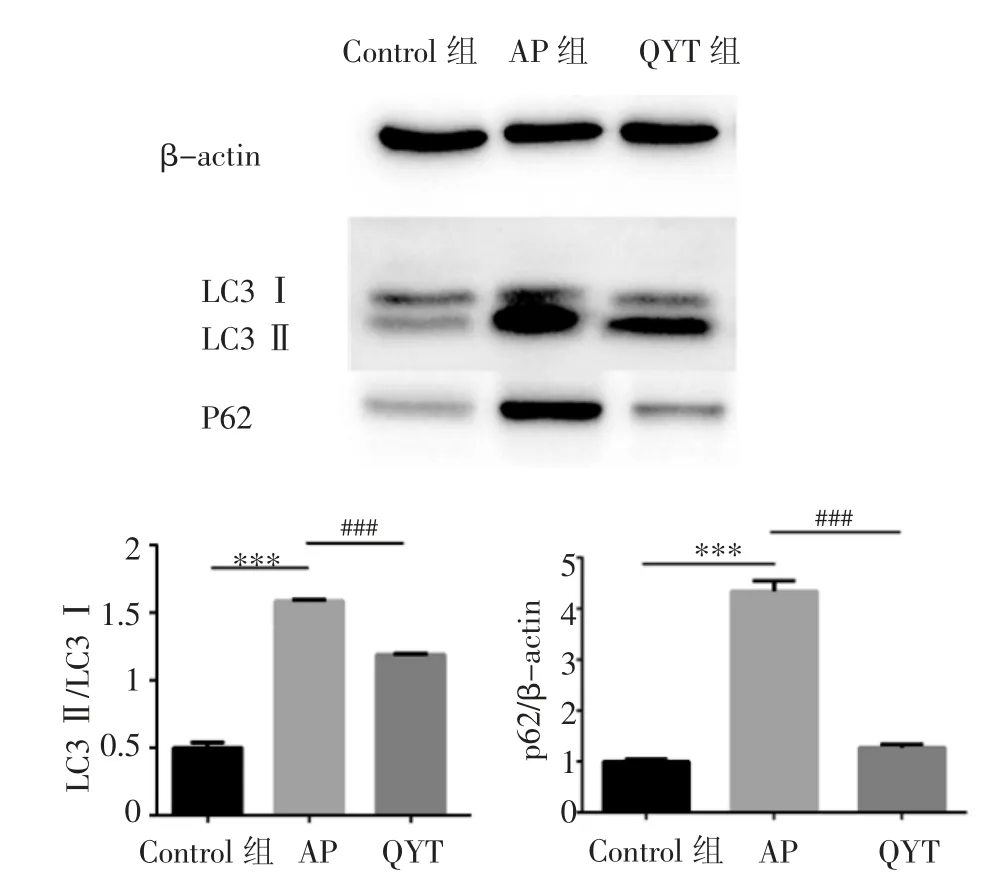
图6 各组胰腺组织中自噬标志蛋白表达Fig 6 Expression of autophagy marker protein in pancreatic tissues in all groups
3 讨论
自噬作为分解代谢的过程,是维持细胞稳态的重要方式之一,在胰腺炎中,自噬被激活但溶酶体降解这一过程被抑制,自噬体形成增加与溶酶体降解降低之间的不平衡导致自噬通量阻滞,会导致严重的腺泡细胞变性和胰蛋白酶原激活,导致AP的发生[9]。现有研究证明,QYT可通过抗凋亡,减少坏死,减轻炎症反应等多途径发挥治疗AP的作用,其中包括通过改善肠屏障通透性缓解AP的炎症反应[10],减少肠道内毒素的产生和吸收,缓解AP引起的肠道屏障损伤[11],及通过减少Ⅱ型肺泡上皮细胞的凋亡来减少重症AP诱导的急性肺损伤等[12]。但对QYT治疗AP作用机制的研究相对孤立,基于分子机制的研究较少,故本研究通过网络药理学的技术方法,对于QYT治疗AP的作用机制进行分析,结果发现自噬是QYT干预AP的途径之一。
通路富集分析结果显示,QYT治疗AP的信号通路共67条,其中涉及磷脂酰肌醇3激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K-Akt)、肿瘤坏死因子(tumor necrosis factor,TNF)、炎症性肠病(IBD)、细胞凋亡、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、Janus激酶/STAT、P53、腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)、MAPK等通路。其中PI3K/Akt/mTOR信号转导途径被认为是自噬启动和调节的主要途径[13]。PI3K通过磷酸化Akt,影响下游从而调节自噬。有研究表明mTOR激活后发生自噬,溶酶体重整可关闭自噬小体的形成,导致溶酶体重新形成,进入下一轮自噬[14]。AMPK通过磷酸化mTORC1等自噬相关蛋白来直接促进自噬,或通过调节转录因子下游的自噬相关基因的表达来间接促进自噬,硫化氢通过AMPK/mTOR途径过度激活自噬而加重AP[15];自噬与p53之间存在重要关系,p53激活自噬,自噬也可以通过为DNA复制和修复提供底物来抑制p53激活[16]。在QYT与AP靶点作用的活性化学成分中,大黄中的大黄素(emodin),可通过抑制PI3K/Akt/mTOR信号通路诱导自噬[17]。大黄中的大黄酸(rhein)通过产生ROS经Fas死亡途径和线粒体途径诱导caspase依赖性凋亡,减弱自噬[18]。STRING结果显示,药物-疾病靶点主要作用于TP53、STAT3、IL-6、AKT1等靶点,IL-6通过多种互补机制调控自噬,包括抑制mTORC1的靶标和激活Akt,刺激LC3的转化和自噬体的形成,增加自噬酶产生。有研究表明miR-148a通过下调IL-6/STAT3信号转导抑制自噬而作用于AP[19]。STAT3可作为由IL-6激活的急性期基因转录增强子,通过上调自噬的负调节剂或下调必需的自噬基因,导致自噬抑制[20]。
动物实验结果证实,在雨蛙素联合脂多糖诱导的AP小鼠模型中,经QYT治疗后AP小鼠的炎症减轻,自噬反应减弱。
综上所述,QYT可能通过调节自噬发挥治疗AP的作用。但QYT干预自噬过程的具体通路仍不明确,需进一步完善体内外实验,进行通路和具体作用靶点的验证,为临床的合理应用以及新治疗方法提供思路依据。
