组织蛋白酶B介导人参多糖联合顺铂对肝癌细胞增殖抑制作用的研究
2021-09-15郭林娜姚立杰王璐璐李国锋姜杨金海峰何军
郭林娜,姚立杰,王璐璐,李国锋,姜杨,金海峰,何军
齐齐哈尔医学院基础医学院,黑龙江齐齐哈尔 161006
人参对中枢神经系统、人体免疫系统、消化系统、心血管系统等有一定的功效[1]。人参的活性成份为多糖和皂苷,有研究表明人参多糖具有抗肿瘤、免疫调节、抗疲劳、降血糖、抗辐射等作用[2-3]。人参多糖的抗肿瘤作用的研究,近几年也备受学者关注,如对舌癌、膀胱癌、乳腺癌、肝癌等肿瘤细胞的增值具有抑制作用[4-8]。文献表明:顺铂能与线粒体、溶酶体等多种细胞器作用而产生细胞毒性[9],参与增殖、迁移等多种生物学功能[10],对肿瘤细胞起到杀伤作用。其中溶酶体是自噬溶酶体的组成部分[11],组织蛋白酶B(cathepsin B)作为组织蛋白酶家族成员之一,是溶酶体酶复合物的组成部分,参与溶酶体介导的自噬细胞死亡过程。因此,cathepsin B的表达多少可间接反映细胞自噬的情况。为了探索人参多糖增强顺铂对人肝癌HpeG2细胞杀伤作用的机制是否与组织蛋白酶B的表达水平有关系,该研究于2018年3月—2019年3月间利用CCK8细胞增殖检测实验和Western blot蛋白印迹实验,对人参多糖增强顺铂对人肝癌HpeG2细胞杀伤作用及机制进行初步研究,现报道如下。
1 材料与方法
1.1 实验材料
培养细胞用超净工作台SW-CJ-1FDA,371气套式二氧化碳细胞培养箱,观察细胞倒置显微镜IMT-2,Multiskan Ascent型多功能酶标仪。人肝癌HpeG2细胞由哈尔滨医科大学第一附属医院实验室提供。CCK8同仁化学研究所(批号JQ701);顺铂注射液(国药准字H53021740,2 mL:10 mg);一抗、二抗,北京中杉金桥生物技术有限公司提供(批号20150610),其他分析纯为国产或进口。
1.2 方法
1.2.1 细胞培养取人肝癌HepG2细胞复苏,培养基为DMEM,并添加10%小牛血清及双抗(100U/mL青霉素和100μg/mL链霉素),取4 mL配制好的培养基,加入常规培养瓶中,放置于37℃,5%CO2的培养箱内培养,1 d换液1次。3 d左右传代1次。取对数生长期的细胞进行其他实验。
1.2.2 实验分组实验设顺铂组、GPS组、GPS+顺铂组、E-64+GPS+顺铂组、E-64+顺铂组。用培养基将GPS注射液稀释为80 mg/L浓度组,空白对照组加培养基,用培养基将顺铂注射液稀释为2.5、5、10、15、20μg/mL。实验培养时间为24 h。
1.2.3 细胞增殖检测(CCK8比色实验)取对数生长期的人肝癌HpeG2细胞,0.25%胰酶消化、吹打、离心,血球仪计数,用培养液稀释制备成1×104/mL的人肝癌HpeG2细胞悬液,取96孔板,设1列为空白对照组,1列为GPS组,1列为GPS+顺铂组,1列为E-64+GPS+顺铂组,每列设4个复孔。空白对照组每孔接种100μl人肝癌HpeG2细胞悬液,加入80 mg/L的人参多糖20μl,顺铂组分别加浓度为2.5、5、10、15、20μg/mL的试剂200μl(确定IC50为:15 mg/L,以此浓度完成实验),E-64μM,37℃,5%CO2的培养箱内培养24 h取出培养板,吸出孔内多余培养液,向各孔内加120μl培养液和15μl CCK8,再放入培养箱培养1 h后取出,置全自动酶标仪上,调整波长为490 nm,测吸光度A值,各组A值除以空白对照值组A值,计算空白顺铂组、GPS组,GPS+顺铂等组细胞抑制率。细胞抑制率=[1-(GPS组A值/对照组A值)]×100%。
1.2.4 Western blot检测法第一步细胞裂解:取GPS+顺铂组、E-64+GPS+顺铂组的人肝癌HpeG2细胞,用0.25%的胰酶消化细胞,收集至EP管内,向EP管内加100μl细胞裂解液,冰上裂解30 min,4℃14 000 g离心10 min,取上清加入EP管做好标记。第二步蛋白定量:将蛋白标准品稀释及人肝癌HpeG2细胞样品蛋白分别加入96孔板上,每组设4个复孔,每孔加BCA200μl,37℃孵育30 min,置自动酶标仪中检测570 nm波长的A值,根据A值与浓度之间的关系,绘制标准曲线,计算样品的蛋白浓度,用细胞裂解液将样品蛋白浓度调整为2μg/μl,100℃加热5 min,冷却后-20℃冰箱保存。最后Western blot检测法检测:根据抗体要求配置浓缩胶和分离胶,按18μl每孔蛋白样品上样,先在电压100 V,电泳时间30 min后,改为110 V,电泳时间为2 h,转膜电压70 V,时间根据蛋白分子量大小而定,5%的脱脂奶粉封膜1 h,丽春红染色3 min,用TBST洗膜3次,5 min/次,按1∶500加一抗,4℃冰箱过夜,第2 d,TBST洗膜2次,5 min,按1∶5 000滴加二抗,室温下孵育2 h,ECL发光、显影、定影,以β-actin为内参蛋白,计算出每种检测蛋白的相对表达量。
1.3 统计方法
采用SPSS 13.0统计学软件进行数据分析,计量资料的表达方式为(±s),组间比较采用单因素方差分析,应用Dunnet-t检验进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 人参多糖联合顺铂增强顺铂对人肝癌HepG2细胞的杀伤作用
CCK8结果表明:人参多糖与人肝癌HepG2细胞作用24 h后,对其增殖抑制率为(12.69±1.64)%,人参多糖联合顺铂与人肝癌HepG2细胞作用24 h后,对其增值抑制率为(54.27±2.11)%,顺铂单独与人肝癌HepG2细胞作用24 h后,对其增值抑制率为(48.28±1.26)%,GPS+顺铂组对人肝癌HepG2细胞的增殖抑制率显著高于顺铂组,差异有统计学意义(t=4.219,P<0.05)。见图1。

图1 GPS和顺铂对于人肝癌HepG2细胞增值抑制率(n=3)Figure 1 Inhibitory effects of GPS and CISPLATIN on proliferation of human hepatocellular Carcinoma HepG2 cells(n=3)
2.2 组织蛋白酶抑制剂E-64减轻GPS联合顺铂对人肝癌HepG2细胞的杀伤作用
顺铂组、E-64+顺铂组、GPS+顺铂组及E-64+GPS+顺铂组与人肝癌HepG2细胞作用24 h后用CCK8法检测增 值 抑 制 率 分 别 为 (49.28±1.83)%、(50.61±1.18)%、(53.88±1.36)%、(47.37±0.98)%,表明组织蛋白酶抑制剂E-64在一定程度上抑制了GPS+顺铂组对人肝癌HepG2细胞的杀伤作用,E-64+GPS+顺铂组与GPS+顺铂组比较差异有统计学意义(t=6.727,P<0.05),而顺铂组与E-64+顺铂组比较差异无统计学意义(t=1.781,P=0.105)。见图2。
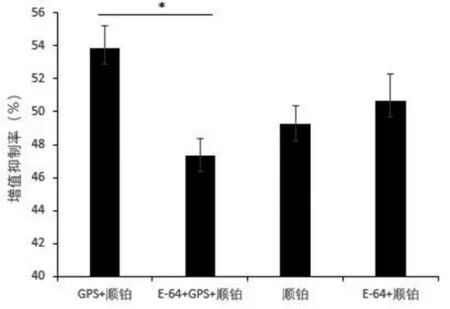
图2 E-64、人参多糖和顺铂对于人肝癌HepG2细胞增值抑制率(n=3)Figure 2 Inhibitory effects of E-64,Ginseng polysaccharide and Cisplatin on proliferation of Human Hepatoma HepG2 cells(n=3)
2.3 GPS联合顺铂对人肝癌HepG2细胞的cathepsin B表达的影响
Western blot检测结果:GPS联合顺铂处理24 h后对人肝癌HepG2细胞中的cathepsin B组织蛋白酶活性表达逐渐上调(1.78±0.23),与顺铂单独作用组(1.27±0.17)相比,人参多糖联合顺铂组可以上调cathepsin B表达,差异有统计学意义(t=3.089,P<0.05)。见图3。

图3 GPS和顺铂对于人肝癌HepG2细胞的cathepsin B表达的影响(n=3)Figure 3 Effects of GPSand cisplatin on the expression of Cathepsin B in human hepatocellular carcinoma HepG2 cells(n=3)
3 讨论
原发性肝细胞癌(HCC)是全世界人民面临的主要健康问题,是目前全球范围内发病率和致死率最高的恶性肿瘤之一,且男性发病率相比女性发病率更高,恶性肿瘤致死率排名第2位[12-13]。目前的治疗手段以手术切除为根治性的治疗手段,术后5年生存率为50%~70%[14],然而肝癌的发病隐匿、发展比较快,绝大部分肝癌患者确诊时已经是中晚期,失去根治性手术治疗的最佳时期。虽然,肝癌的手术适应证不断放宽,但是,仍有部分中晚期患者无法进行根治性手术[15]。中晚期肝癌患者则主要以局部消融、介入治疗,全身化疗、局部放射治疗等为主。可是,肝癌对化疗药物的敏感性不高,制约了化疗在肝癌治疗中的应用。这一点在肝癌的治疗指南中可以有所了解:多种指南均未把全身化疗作为一线治疗方案推荐[16]。有专家认为,肝癌对化疗敏感性降低,可能是由于患者本身的基础病肝硬化,使肝脏本身的血流动力学发生改变,导致作用肝癌细胞的化疗药物浓度较少。总之,对肝癌的化疗抵抗机制了解不足。但对于肝癌晚期患者而言,无论是静脉化疗还是动脉化疗,对于延长患者的生命就变得尤为重要。那么,如何增强肝癌对化疗的敏感性也就成为提高患者生存期的重点。目前,化疗药物联合中药制剂在肿瘤化疗中广泛使用,因为,中药制剂可增加化疗药物的作用,而且减少化疗药的不良反应及耐药性[17]。中药制剂多数为天然植物药物的提取物,具有安全性高且低毒性的特性,期待能提高化疗药物的敏感性。
该实验CCK8结果表明GPS联合顺铂对人肝癌HepG2细胞增殖抑制作用明显高于顺铂组,增值抑制率为(54.27±2.11)%。此结果与李安等[18]报道的人参多糖联合奥沙利铂对肝癌细胞的增值抑制作用明显增加的结果相似,同等浓度下抑制率为58%左右。提示人参多糖可能提高铂类化疗药物对肝癌的敏感性。既往研究表明[19],cathepsin B作为溶酶体中重要的蛋白水解酶,存在于多种细胞的溶酶体和巨噬细胞中,在细胞凋亡过程中发挥重要作用,同时溶酶体对细胞自噬作用正常进行也非常重要,cathepsin B参与细胞凋亡是因为cathepsin B可将Bcl-2家族中Bid蛋白切割成tBid蛋白,tBid蛋白具有更强大的促进细胞凋亡的能力。而cathepsin B参与细胞自噬作用则是因为自噬体需与溶酶体形成自噬溶酶体,才能启动自噬过程。所以,自噬体和溶酶体的动态平衡保证了细胞自噬的正常进行。又有文献报道E-64能够抑制溶酶体内部释放的包括cathepsin B在内的等多种组织蛋白酶活性。因此,为了进一步验证GPS在GPS+顺铂对人肝癌HepG2细胞杀伤作用增强的机制,该实验在GPS+顺铂组加入了组织蛋白酶抑制剂E-64。实验结果证明:GPS+顺铂组加入组织蛋白酶抑制剂E-64,下调了GPS联合顺铂对人肝癌HepG2细胞的增殖抑制作用。说明组织蛋白酶可能介导人参多糖联合顺铂对肝癌细胞增殖抑制作用。为证实组织蛋白酶的表达是否与人参多糖增敏顺铂对肝癌的杀伤作用有关,该实验进一步检测了GPS+顺铂组及顺铂组人肝癌HepG2细胞内cathepsin B的表达情况,结果表明:GPS+顺铂组的cathepsin B表达与顺铂组相比较有所上升(1.78±0.23),而GPS+顺铂组细胞增殖抑制率也有所提高。这与涂龙霞等[20]报道的TRAIL提高人胃腺癌SGC-7901细胞凋亡率,可能是通过提高cathepsin B蛋白表达率(1.25±0.08),促进细胞凋亡的结论一致。因此,提示人参多糖可以增强顺铂对人肝癌HepG2细胞的杀伤作用,其机制可能是人参多糖上调了细胞内组织蛋白酶cathepsin B表达而实现的。人参多糖+顺铂组的cathepsin B表达较顺铂组提高,可能使cathepsin B介导的自噬及凋亡作用增强,进而增强了顺铂对人肝癌HepG2细胞的杀伤作用。而该实验中加入组织蛋白酶抑制E-64后人参多糖+顺铂组对人肝癌HepG2细胞增殖的抑制减少,因此,可推测组织蛋白酶抑制E-6[4]抑制了cathepsin B的表达,导致人参多糖联合顺铂组对人肝癌HepG2细胞的杀伤作用减弱。进一步证明cathepsin B的表达上调可能与人参多糖增强顺铂对人肝癌HepG2细胞的杀伤作用有关[21]。
综上所述,人参多糖对顺铂的抗肿瘤活性起到协同作用,同时,由于人参多糖对氧化应激损伤的正常肝细胞具有保护作用,可以减轻化疗药物顺铂对正常肝细胞的毒副作用。为人参多糖联合顺铂在临床上治疗原发性肝癌中晚期患者提供理论支持。但更深入的机制需要进一步研究、探讨。
