以次生代谢物产量为目标的西兰花毛状根培养技术体系优化
2021-09-14张秀民马绍英杨洁包金玉张晓玲田鹏路亚琦李胜
张秀民 马绍英 杨洁 包金玉 张晓玲 田鹏 路亚琦 李胜
(1. 甘肃农业大学生命科学技术学院,兰州 730070;2. 甘肃农业大学基础实验教学中心,兰州 730070)
西 兰 花(Brassica oleracea L var. italica Planch)属十字花科芸薹属甘蓝种,以无数花梗和花蕾组成的花球为主[1],因含有硫代葡萄糖苷(glucosinolate,GLS)、类胡萝卜素和酚类等丰富的生物活性化合物而备受关注[2]。萝卜硫苷(glucoraphanin,GRA)是属于脂肪族GLS的一种[3],GRA其本身并不具有生物活性,但当植物细胞受到损伤或破坏时,与存在于特殊的成纤维细胞-芥子细胞中的黑芥子酶(myrosinase,MYR)发生酶解[4],进而形成多种化合物,如异硫氰酸盐、腈和硫氰酸盐等物质[5]。萝卜硫素(sulforaphane,SF)是异硫氰酸盐的一种,是迄今为止在蔬菜中发现具有强抗癌、防癌作用的次生代谢产物[6-7]。
茉莉酸甲酯(methyl jasmonate,MeJA)是一种带有特殊香气的物质,分离自茉莉花精油[8]。作为诱导子,MeJA不仅可以在细胞膜间内源信号转导中起作用,而且能够提高植物次生代谢产物含量[9]。已有研究表明,外源添加MeJA可以增加西兰花和其他芸苔属作物GLS含量,增强癌症化学预防和抗氧化活性[10]。目前,SF及GRA主要从西兰花种子和幼苗中获得,成本高且产量低。前期本课题组已成功建立西兰花毛状根培养体系,研究发现西兰花毛状根中SF含量显著高于西兰花无菌苗,分别是西兰花无菌苗叶片、幼根的13、31.28倍[11]。然而,由植物细胞生物合成的具有高效利用价值的大多数代谢物都储存在细胞内,从复杂的植物细胞或组织中提取纯化代谢物质成本高昂,严重障碍大规模生产。主动性释放可以在植株整个生命周期内产生高产量的植物次生代谢物质,可解决由次生代谢物在细胞或组织中大量积累带来的反馈抑制,并促进其下游产物的提纯;与植物组织的提取溶剂相比,自主性释放的分泌物是相对简单的混合物,这使得化学物质的分离变得更容易[12]。本实验室前期研究发现,西兰花毛状根经MeJA处理使得毛状根中SF大量释放到MS液体培养基中,且液体培养基中SF的释放量是毛状根中SF含量的12.3倍[13]。已有研究表明,MeJA处理水飞蓟细胞悬浮液可提高水飞蓟素的含量并使其释放到液体培养基中[14],María Perassolo等[15]研究表明,100 μmol/L的MeJA能够提高茜草毛状根中的蒽醌类化合物含量并使其释放至液体培养基中,但MeJA诱导西兰花毛状根中GRA和SF释放研究未见报道。
本研究通过外源添加MeJA诱导西兰花毛状根,在单因素实验基础上,以接种量、pH、培养温度为自变量,以西兰花毛状根培养体系中GRA和SF总产量为响应值,利用Design-expert8.0.6软件设计响应面实验,为揭示西兰花毛状根次生代谢物GRA和SF释放机理奠定基础。
1 材料与方法
1.1 材料
以甘肃农业大学生命科学技术学院植物组织培养实验室“中青9号”西兰花无菌苗叶片经发根农杆菌“ATCC15834”诱导获得的毛状根及其液体培养基为实验材料。
1.2 方法
1.2.1 MeJA处理西兰花毛状根 将西兰花毛状根统一转接于新配置MS液体培养基,西兰花毛状根在静止期(18-21 d)产生SF并少量释放,21 d为最佳收获时间,且在添加10 mmol/L MeJA时显著增加培养基中SF含量,因此选择西兰花毛状根生长至第18 天添加MeJA[13]。在各个处理条件下,采集MeJA处理的样本,用蒸馏水冲洗干净,滤纸吸取多余水分,于-20℃冰箱保存,作为后续GRA和SF活性成分提取的实验材料。设置3次重复试验。
1.2.2 单因素实验 单因素实验设计见表1。
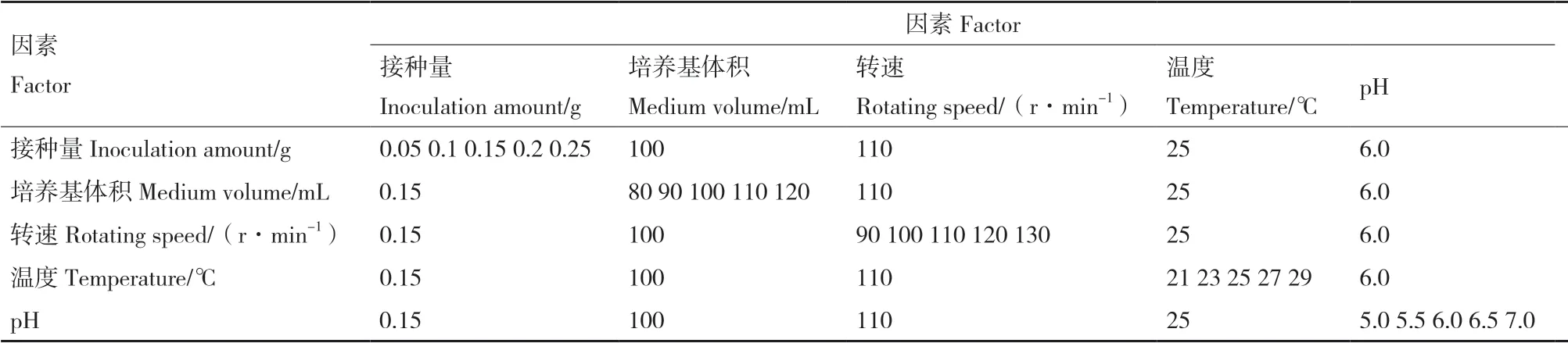
表1 单因素实验设计Table 1 Single factor experimental design
1.2.3 响应面试验 在单因素实验的基础上,采用响应面分析法中的Box-Behnken Design建立数学模型,选取培养温度(℃)、毛状根接种量(g)以及pH为自变量,以西兰花毛状根中GRA及SF总产量为指标进行优化实验设计,设计三因素三水平响应面实验(表2)。

表2 Box-behnken试验因素水平表Table 2 Box-behnken test factor levels
1.2.4 西兰花毛状根培养体系GRA和SF的提取与检测 西兰花毛状根培养体系GRA的提取及检测参考包金玉[13]的方法,SF的提取及检测参考包金玉[13]的方法。
1.2.5 黑芥子酶活性的测定 参照Burow的方法略作改进[16],取0.5 g各处理的西兰花毛状根,用3 mL 0.1mol/L pH6.5磷酸盐缓冲液在冰浴下研磨,超声波浸提20 min,4℃下10 000×g离心15 min,上清液即为粗酶液。粗酶液中蛋白质含量采用考马斯亮蓝蛋白质试剂盒测定(中国南京建成生物有限公司)。取200 μL粗 酶 液 与200 μL 2 mmol/L sinigrin(Sigma,CAS:3952-98-5)混合,于37℃水浴反应15 min,然后转移至沸水浴中5 min停止反应,用葡萄糖试剂盒(中国南京建成生物有限公司)测定葡萄糖含量。以每分钟被MYR转化生成1 nmol葡萄糖为1个酶活力单位(U/mg protein)。
2 结果
2.1 单因素实验结果
2.1.1 接种量对西兰花毛状根培养体系中GRA和SF释放的影响 接种量影响西兰花毛状根的增殖,而增殖又会影响GRA和SF的合成。随着接种量增加,毛状根中GRA产量、培养基中SF产量和毛状根中SF产量均呈现先升高后降低的趋势;MYR的活性也随接种量的增大而升高(图1)。毛状根接种量为0.15 g时,毛状根中GRA产量显著高于其他处理,达1 105.13 μg/flask,是培养基中GRA产量的34.07倍;此时培养基中SF产量显著高于其他处理,可达840.57 μg/flask,是毛状根中SF产量的29.95倍。培养基中SF的产量远高于毛状根中,而GRA在毛状根中的产量比在培养基中的高。因此,可以初步得出,当接种量为0.15 g时,毛状根中的GRA在MYR的作用下大部分转化为SF,使其释放到培养基中,从而使得培养基中的GRA释放量减少,此时毛状根中77.31%的SF释放到培养基中。因此控制毛状根的接种量为0.15 g时,有助于SF向培养基中释放。

图1 接种量对西兰花毛状根培养体系中GRA和SF释放的影响Fig. 1 Effects of inoculation amount on the GRA and SF release in broccoli hairy root culture system
2.1.2 转速对西兰花毛状根培养体系中SF和GRA释放的影响 转速在液体悬浮系统中既影响着培养物的物理状态也影响着生理状态。在西兰花毛状根细胞培养悬浮体系中,不同的剪切力会影响西兰花毛状根的增殖,进而影响次生代谢物的合成。如图2所示,转速为110 r/min时,毛状根中GRA产量显著高于其他处理,达879.62 μg/flask;培养基中GRA和SF产量均显著高于其他处理,分别为37.07 μg/flask和958.54 μg/flask,此时培养基中SF产量是毛状根中SF产量的53.69倍。伴随转速增大,毛状根受到的剪切力也同步增大,使得GRA和MYR发生反应,产生大量SF,导致SF和GRA向培养基中释放,同时,培养基中的溶氧量也影响毛状根的生长。因此可以初步得出,毛状根中GRA和SF的释放和剪切力相关,并且转速为110 r/min时,GRA和SF的释放量最大。
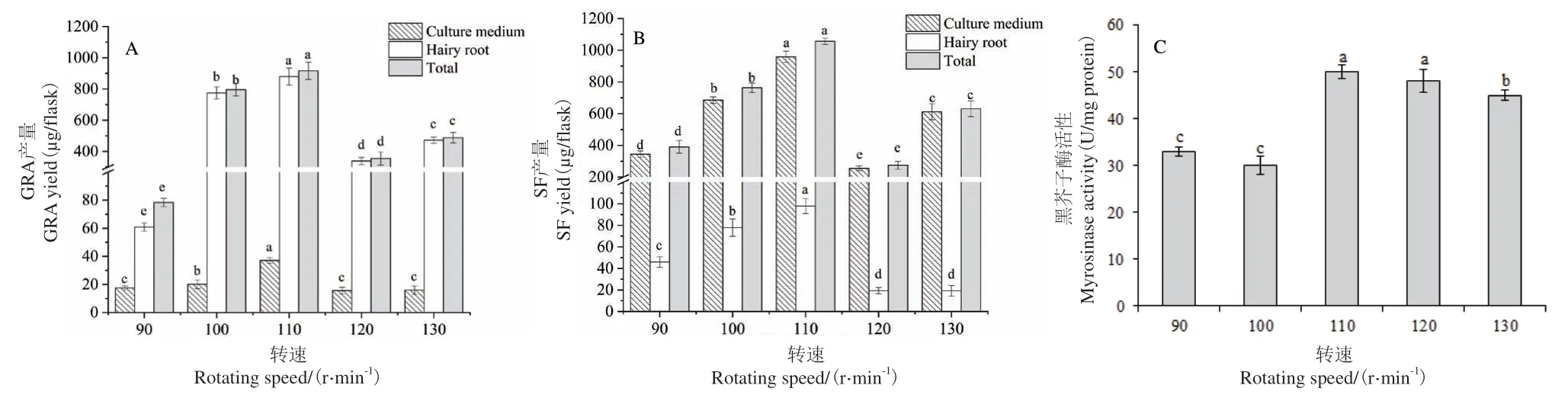
图2 转速对西兰花毛状根培养体系中GRA和SF释放的影响Fig. 2 Effects of rotating speed on the GRA and SF release in broccoli hairy root culture system
2.1.3 pH对西兰花毛状根培养体系中SF和GRA释放的影响 pH值的变化主要影响到细胞质膜电位,从而影响细胞质膜透性,使细胞内外物质的交流发生变化,特别是在pH 4-6之间时更加明显。如图3所示,随着pH的增加,西兰花毛状根培养体系中GRA和SF产量整体呈现先升高后降低的趋势,且随着pH的增大,SF的总产量逐渐减小。pH为6.0时,此时毛状根中GRA产量为830.50 μg/flask,是培养基中GRA的23.43倍;pH为5.5时,培养基中SF产量显著高于其他处理,达到930.51 μg/flask,是毛状根中SF的13.31倍。由于酸碱度影响毛状根的生长发育以及次生代谢物的合成,此时毛状根中的GRA大部分经由MYR水解转变为SF并释放到培养基中,少部分继续留在毛状根中。因此可以初步得出,酸碱度可以在一定程度上影响GRA和SF向培养基中的释放,且当pH为5.5时,SF向培养基中释放量达到最大。

图3 pH对西兰花毛状根培养体系中GRA和SF释放的影响Fig. 3 Effects of pH on the GRA and SF release in broccoli hairy root culture system
2.1.4 培养温度对西兰花毛状根培养体系中SF和GRA释放的影响 如图4所示,随着培养温度的升高,西兰花毛状根培养体系中GRA和SF的产量随着温度的升高呈现先升高后降低的趋势,而MYR的活性随着温度的升高随之增大。当温度为25℃时,毛状根中GRA的产量显著高于其他处理,达1 032.78 μg/flask,此时培养基中SF产量也达到最高为752.06 μg/flask,是毛状根中SF产量的6.7倍。培养温度过低不利于毛状根的生长增殖,进而影响次生代谢物的生物合成,由此可得出,毛状根在不同生长温度下其增殖状况及次生代谢物的合成也随之不同。因此控制培养温度为25℃时,有利于毛状根中GRA的合成积累,有助于毛状根中SF向培养基中释放。

图4 培养温度对西兰花毛状根培养体系中GRA和SF释放的影响Fig. 4 Effects of culture temperature on the GRA and SF release in broccoli hairy root culture system
2.1.5 培养基体积对西兰花毛状根培养体系中SF和GRA释放的影响 根据本实验室前期研究,培养基体积会影响GRA和SF的合成,可能是培养基中营养需求差异所导致的。如图5所示,西兰花毛状根培养体系中GRA和SF产量由于培养基的体积增大整体呈现先升高后降低的趋势。培养基体积为100 mL时,毛状根中及培养基中GRA产量均显著高于其他处理,分别为713.33 μg/flask和158.68 μg/flask。培养基体积为110 mL时,MYR的活性达到最大,MYR与GRA水解生成SF,使SF释放至培养基中,此时培养基中SF的产量也显著高于其他处理,达911.95 μg/flask。培养基体积增大,锥形瓶中的含氧量减少,影响毛状根生长发育。因此可以初步得出,由于培养基体积增加导致培养基中含氧量减少,毛状根受到低氧胁迫导致SF含量增大并向培养基中释放。因此控制培养基体积为100 mL时,有助于毛状根中GRA和SF的生物合成,而培养基体积为110 mL时,有助于SF向培养基中释放。

图5 培养基体积对西兰花毛状根培养体系中GRA和SF释放的影响Fig. 5 Effects of medium volume on the GRA and SF release in broccoli hairy root culture system
2.2 响应面实验优化结果分析
2.2.1 响应面实验分析 由以上单因素实验结果可得出,各个因素对西兰花毛状根中GRA总产量的影响顺序为:培养温度>接种量>pH>培养基体积>转速;对西兰花毛状根中SF总产量的影响顺序为:pH>接种量>培养温度>培养基体积>转速,综合单因素实验结果,选取对毛状根中GRA和SF总产量有显著影响的培养温度(℃)、pH以及毛状根接种量(g)3个因素为自变量,采用响应面分析方法进行试验设计,以-1、0、1分别代表变量的水平,响应面分析方案及实验结果见表3。
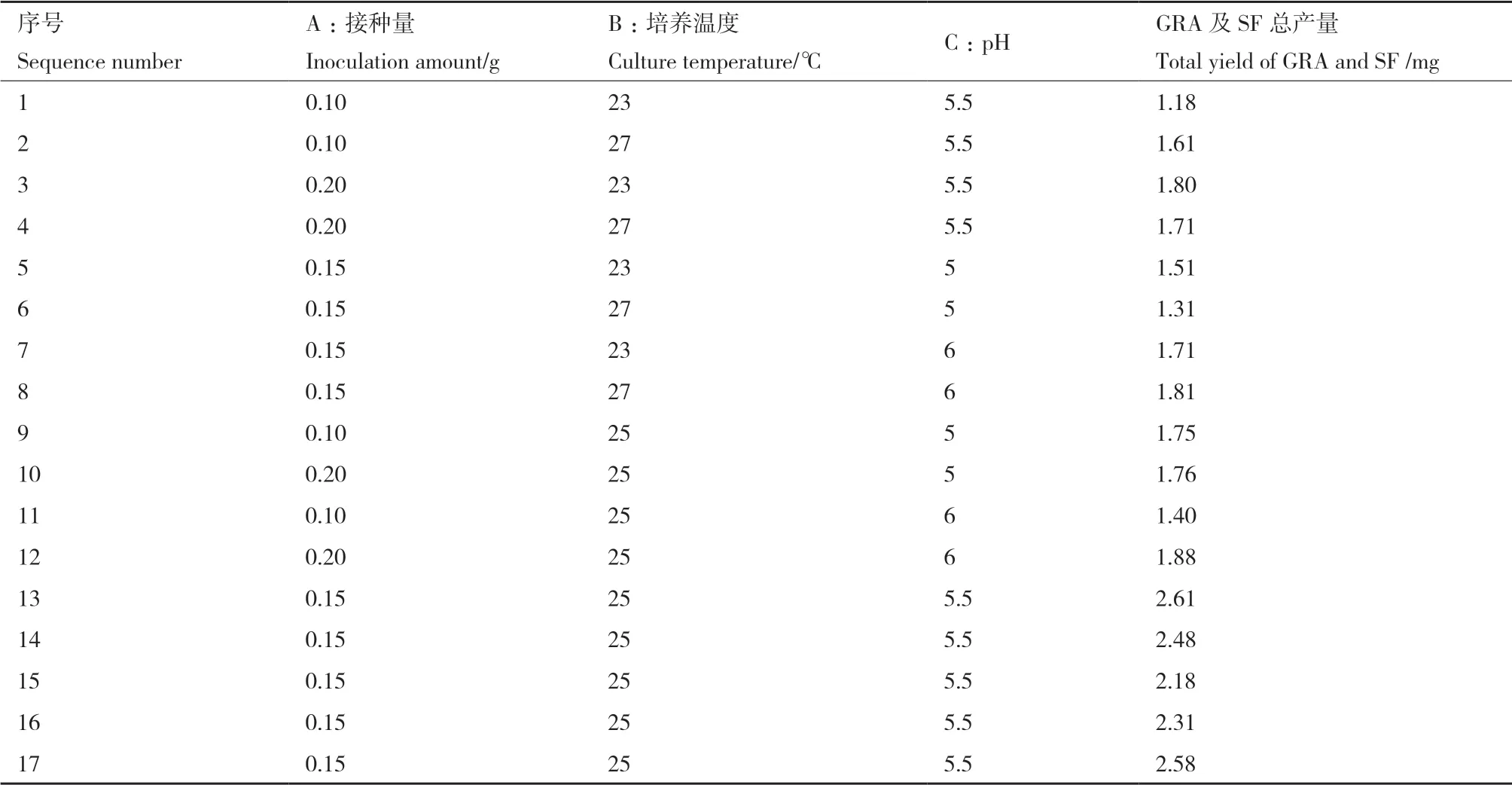
表3 响应面设计与实验结果Table 3 Response surface design and experimental results
2.2.2 二次回归方程模拟及方差分析 用DX8.0.6响应面软件对表2中的实验结果进行分析,得到二次回归模型方程:Y=+2.43+0.030A+0.15B+0.059C-0.13AB+0.075AC+0.12BC-0.48A2-0.37B2-0.36C2
对回归方程进行方差分析,由表4可知,模型显著性检验P<0.05,表明模型显著,具有统计学意义。失拟项P值为0.3701>0.05,失拟不显著。模型的校正决定系数R2Adj为0.8629,能解释约86.29%的响应值变化,决定系数R2为0.9091,拟合程度良好,实验误差小。从单因素水平观察,其影响顺序为:接种量>pH>培养温度。在有交互作用存在的条件下,对西兰花毛状根GRA和SF总产量的影响顺序为AB>BC>AC。利用该回归方程确定最佳培养条件:毛状根接种量为0.15g,培养温度为25.44℃,pH为5.56,在此条件下进行验证实验,重复3次,西兰花毛状根中GRA和SF总产量为2.08 mg/flask,回归模型预测理论总产量为2.44 mg/flask,验证值低于预测值,其相对误差为1.8%,因此该回归方程具有可行性。
2.2.3 各元素交互作用 回归方程显示,各因素之间存在交互作用,图6-8响应面图反映了各因素在西兰花毛状根培养过程中对响应值的影响,投影为等高线图,响应面的坡度陡峭程度直观反映了各因素对响应值的影响。从表4中可得,二次项A2、B2和C2对总产量均具显著性影响(P<0.01)。
图6 Y=f(A,B)的响应面Fig. 6 Responsive surface plot of Y=f(A,B)
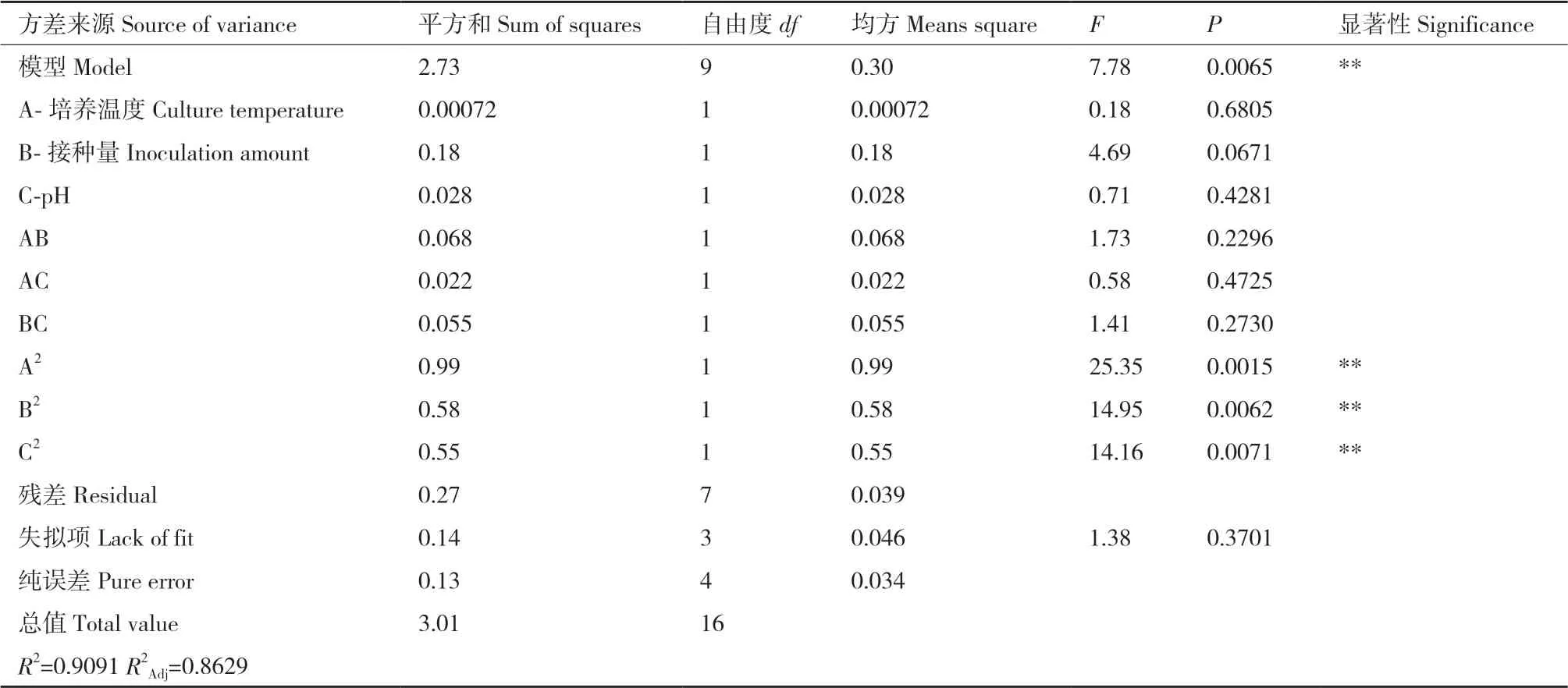
表4 响应面方差分析Table 4 Analysis of variance response surface
3 讨论
MeJA是诱导子的一种,会刺激植物并影响植物体内次生代谢物的合成与积累[17]。王瑜等[18]研究发现MeJA处理王不留行毛状根能显著促进黄酮苷产生。孙际薇[19]研究发现MeJA能有效刺激曼陀罗毛状根中东茛菪碱、茛菪碱成分迅速积累并向培养基中释放。Cacho等[20]研究发现在水飞蓟悬浮培养体系中添加MeJA后水飞蓟素在液体培养基中的量提高了2倍。在本研究中,通过外源添加MeJA,不仅显著促进了西兰花毛状根中GRA和SF的积累,而且使GRA和SF大量释放至液体培养基中,为GRA和SF的提取提供便利,极大降低了整个提取过程的成本。在植物细胞受到损伤或破坏时,存在于液泡中的GRA与存在于芥子素细胞的MYR发生酶解反应,得到酶解产物SF,在毛状根中GRA的含量远远高于SF,液体培养基中SF的含量远远高于GRA,说明SF可能是一个积累的过程,SF对GRA合成的反馈抑制效应较GRA本身强,加速了SF的释放,从而促进毛状根中GRA的大量合成[21]。
接种量影响离体植物器官的生长发育,接种量过多或过少都不利于毛状根的生长[22]。本研究结果表明,随着接种量的增大,毛状根SF释放量呈先增后降的趋势,推断这是由于SF对GRA的合成反馈抑制效应比GRA强,加速了SF的释放。此外,毛状根群体效应也是影响SF和GRA释放的因素,伴随接种量的增大,群体效应导致西兰花毛状根中GRA和SF释放量增大,但接种量过大,会导致培养体系中营养物质缺乏,影响毛状根的正常生长[23]。
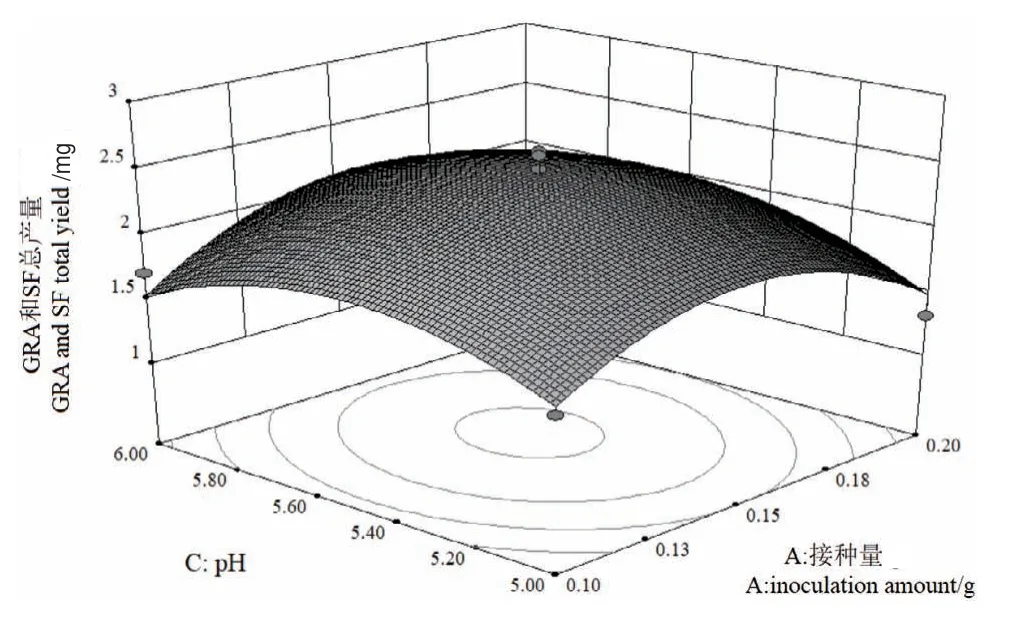
图7 Y=f(A,C)的响应面Fig. 7 Responsive surface plot of Y=f(A,C)
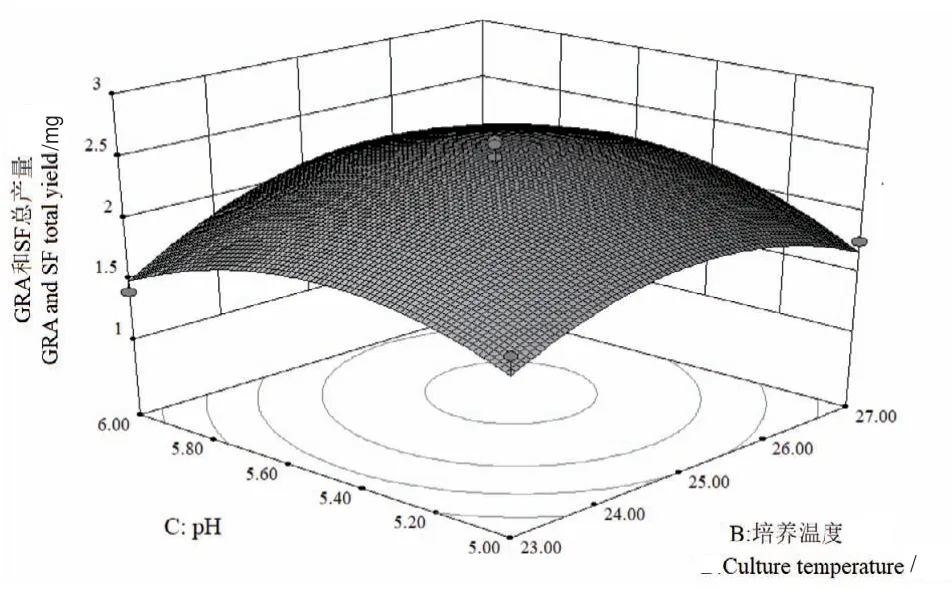
图8 Y=f(B,C)的响应面Fig. 8 Responsive surface plot of Y=f(B,C)
培养基的体积决定培养基中营养成分以及容器中的含氧量。韩昱姝[24]研究扩大培养基体积对金铁锁毛状根次生代谢物的影响,发现2 L生物反应器相较于1 L三角瓶生物量和皂苷含量增加却不多的原因是通气量不足等因素造成。袁金玲等[25]在进行孝顺竹愈伤组织悬浮培养条件优化时得出在200 mL三角瓶中培养基体积为50 mL时,悬浮细胞有较好的增殖能力以及优良的增殖状态。本研究结果表明,当培养基体积为100 mL时,SF向培养基中的释放量达到最大;当培养基体积为110 mL时,GRA向培养基中释放量达到最大,这可能是由于培养基体积增加导致培养基中含氧量减少,使得毛状根中次生代谢物释放到培养基中,当培养基体积过少时,培养基中溶氧量增加,但不能为毛状根提供充足的营养物质。Cai等[12]的研究结果也表明葡萄悬浮培养细胞培养基体积增大,释放到培养基中白藜芦醇的量增大。
剪切力也是液体培养中一个不可忽视的影响因素。毛状根悬浮培养是在恒温振荡器中进行的,当毛状根与玻璃器皿瓶壁长时间摩擦导致细胞破碎后,GRA与MYR在液体环境下接触发生水解反应[26]。随着转速增加,剪切力增强,毛状根受损增大,使得SF的释放量提高。本研究结果表明,当转速为110 r/min时,SF和GRA向培养基中的释放量达到最大。
伴随毛状根的生长,培养基中的微环境发生了变化,随之pH也发生变化,研究结果表明毛状根在偏酸性环境中生长更好,这与赵生琴[27]研究结果相似。叶国洪等[28]的研究表明,烟草细胞在培养基原始pH 4.0-8.0下均能生长,但在pH 6.0时细胞生长最好,CoQ10含量最高。GRA酶解后形成的糖苷配基中间体在pH 5-8范围内可重排得到SF等异硫氰酸盐[29]。本研究结果表明,当pH为5.5时,SF和GRA向培养基中释放量达到最大。
温度的变化不仅对植物光合生态生理的进行及有机化合物的生物合成有影响,还对植物内部因素(酶活性大小、呼吸作用)有较大的影响[30]。毛状根最适生长温度为20℃-28℃,李翠芳等[31]研究了新疆紫草毛状根在26℃条件下生长状况较好,低于或高于26℃,紫草毛状根的生长均受到不同程度的抑制;李春玲[32]研究了温度对水飞蓟毛状根增值的影响,当温度为26℃时,毛状根生长旺盛,其增值倍数相较于对照最高达31.67倍。而在本研究中,当培养温度为25℃时,GRA和SF总产量均达到最大且释放到培养基中的量也达到最大。
4 结论
在单因素实验基础上,接种量、pH以及培养温度对GRA和SF总产量影响显著,以西兰花毛状根培养体系GRA和SF总产量为响应值,利用Designexpert8.0.6得出最佳培养条件:毛状根接种量为0.15 g,培养温度为25.44℃,pH为5.56,在此条件验证得出:西兰花毛状根中GRA和SF总产量为2.08 mg/flask,与回归模型预测理论总产量2.44 mg/flask接近,其相对误差为1.8%。
