植物愈伤组织诱导过程中的表观遗传修饰研究进展
2021-09-14王建勇邹永梅葛言彬王凯席梦利
王建勇 邹永梅 葛言彬 王凯 席梦利
(1. 南京林业大学林学院,南京 210037;2. 福建农林大学海峡联合研究院/农学院,福州 350002;3. 江苏第二师范学院生命科学与化学 化工学院,南京 210013;4. 新疆玛纳斯县平原林场,昌吉回族自治州 832206)
表观遗传是指染色质结构中可遗传的改变,其不涉及DNA序列的变化,但深刻地影响基因表达和细胞功能。近年来,表观遗传学的研究进展,正不断刷新我们对生命现象的认识。已有研究表明,染色质状态的改变在控制细胞分化和脱分化中发挥重要作用[1]。植物组织培养正是利用细胞可以脱分化和再分化的特性,进行植物的快速繁殖及重要代谢产物的生产。其中植物细胞脱分化形成愈伤组织是组织培养的重要环节。愈伤组织是离体培养时,植物组织或器官中已分化的细胞,在外源激素的刺激下改变了原有的细胞命运,经细胞脱分化和不断增殖所形成的无特定结构、无明显极性的松散组织。愈伤组织的获得一般是将成熟的体细胞“逆转”到分化程度较低的状态并恢复其增殖能力[2]。在逆转过程中,大量的表观遗传修饰参与其中[1,3-8]。表观遗传修饰一般会引起染色质结构的改变,并伴随基因表达水平的变化。在动物方面,分化的细胞染色质呈现闭合状态,基因表达稳定,而未分化细胞的染色质处于开放状态,基因表达会发生动态的变化。表观遗传修饰参与到动物细胞从分化状态转变为脱分化状态的过程中,将染色质从闭合状态打开,结合调控因子,通过不同途径,影响下游基因的表达。在植物方面,虽然在玉米[9],拟南芥[10],小麦[11]和甜菜[12]中均已证实表观遗传通过改变基因表达和染色质结构影响植物细胞的命运转变,调控愈伤组织的形成,但是具体的表观修饰方式还没有统一的定论。本文综述了植物愈伤组织诱导过程中DNA甲基化,组蛋白修饰,小RNA及染色质重塑等常见表观遗传修饰的研究进展,总结了存在的问题并提出了植物愈伤组织诱导过程中表观遗传学研究的方向。
1 DNA甲基化
DNA甲基化是DNA化学修饰的一种,是真核生物中研究最深入的表观遗传标记。指在不改变DNA序列的前提下,DNA甲基化转移酶在胞嘧啶5'碳上通过共价结合的方式添加一个甲基基团形成5-甲基胞嘧啶[13-15]。常见类型可分为3种:CG、CHG和CHH(H = A,T或C)[16]。DNA甲基化可以提供超出植物基因组DNA序列以外的可遗传信息,如果甲基化水平不足会导致植株生长发育的异常。因此,DNA甲基化在沉默有害转座子插入,保护基因组稳定性,调节不同发育阶段和不同环境条件下的基因表达等方面发挥着重要作用[15,17]。
在植物的整个生长发育过程中,不同的时期,不同的发育阶段会伴随着特定基因的转录表达。植物DNA甲基化水平的改变在调控基因的表达和沉默方面起到了重要作用。基因甲基化状态一般分为3种类型:持家基因通常处于低甲基化状态或者不被甲基化,从而保证基因的稳定表达;诱导性基因则在不同发育阶段、组织特异性基因表达和外界胁迫时,转变为去甲基化状态;沉默基因通常处于高甲基化状态。植物愈伤组织诱导期间会发生DNA甲基化水平的改变,这主要是因为植物细胞在外界植物激素的诱导下脱分化形成愈伤组织时需要DNA甲基化的全局重编程。愈伤组织形成期间的甲基变化以DNA低甲基化事件为主,但局部DNA,尤其是部分器官决定基因常常需要超甲基化以刺激愈伤组织的形成,但物种之间存在显著差异[12,18-19]。
1.1 甲基转移酶与DNA甲基化
愈伤组织诱导过程需要抑制器官发生基因的表达,促进愈伤组织的形成,因此需要将这些基因的启动子区或编码区进行重新甲基化,使得器官发生基因表达沉默。植物体内甲基转移酶(methyltransferase1,MET1)主要维持基因组中重复及单拷贝序列CG位点的甲基化。MET1参与RNA介导的DNA甲基化(RdDM)途径,在MET1的作用下引起基因位点的甲基化。MET1的突变会导致部分基因的启动子区域去甲基化,使得该区域的染色质结构发生改变,对DNaseI 敏感性增强,有利于反式作用因子的结合,进一步活化基因,促进转录表达。Berdasco等[20]对野生型拟南芥和met1突变体叶片和根愈伤组织诱导过程中甲基化水平变化进行研究发现,在met1突变体诱导的愈伤组织中,筛选出505个差异表达基因,其中GLUTATHIONE S-TRANSFERASE TAU 10(GSTU10)、MITOGEN- ACTIVATEDPROTEINKINASE 12(MAPK12)、BETAXYLOSIDASE 1(BXL1)和WUSCHEL(WUS)等器官发生基因启动子区域的甲基化水平与野生型相比急剧下降,并伴随较低的愈伤诱导能力。Li等[21]也得到了相同的结果,在拟南芥met1突变体中,WUS启动子区域的DNA甲基化水平的下降引起WUS基因表达的上调,从而造成愈伤组织诱导能力的下降。
1.2 DNA序列差异影响甲基化程度
植物基因组中不同DNA序列的甲基化敏感性不同,造成了异染色质区域如着丝粒区域、核糖体RNA编码序列、转座子的序列更容易被甲基化。转座子作为一种DNA重复序列很容易发生甲基化的改变。组织培养作为一种外界胁迫,会招募转座子富集到基因附近的区域,进而发生超甲基化现象,引起基因表达沉默。Stelpflug等[22]在筛选玉米幼胚和愈伤组织之间的差异甲基化区域时发现,低甲基化主要富集在不含转座子的区域,促进愈伤组织发育特异性基因的表达,而未扩散的LTR附近呈现超甲基化现象,抑制附近基因的表达。Gozukirmizi等[23]将大麦成熟胚置于添加4 mg/L麦草畏的愈伤组织诱导培养基上培养发现,相对于4 d的幼苗,LTR转座子在诱导15 d和30 d的愈伤组织中出现超甲基化的现象。
基因在总基因组中仅占据一小部分,非编码DNA会影响基因的精确调控以及干扰基因的转录。DNA甲基化作为一种有效机制可以长期沉默非编码DNA,调控基因的表达。前期的研究成果表明:在组织培养过程中甲基化的丢失要多于甲基化的获得,且DNA甲基化的这种改变主要发生在愈伤组织诱导的前期,植物激素作为一种诱导因子,诱导相关基因的去甲基化,促进愈伤组织发育特异性基因的表达来应对外界环境的变化。虽然甲基转移酶与DNA序列差异都会影响甲基化水平,但还有很多因素如培养方式的差异也会影响不同的甲基化模式,因此在未来的研究工作中需要更加深入地探讨愈伤组织诱导过程中DNA甲基化的分子机制。
2 组蛋白修饰
组蛋白修饰是在核小体的组蛋白N尾上发生的化学修饰,包括甲基化、乙酰化、磷酸化、泛素化和小泛素相关修饰物(small ubiquitin-related modifier,SUMO)等。与DNA甲基化这种稳定的表观修饰相比,组蛋白修饰具有更好的可塑性。组蛋白修饰能够影响染色质结构,控制DNA的可及性,调节转录活性,并可遗传给子细胞,在植物发育的各个阶段均发挥重要作用[24-29]。
组蛋白修饰主要发生在基因的转录起始区和基因本身,以调节基因的表达。与已分化的体细胞相比,在脱分化的愈伤组织细胞中,激活性组蛋白修 饰 如H3K4me3、H3K36me3、H3ac和H2Aub显著富集,而抑制性组蛋白修饰如H3K9me2/me3和H3K27me2/me3明显减少[30]。
2.1 组蛋白乙酰化修饰促进愈伤组织形成
组蛋白乙酰化修饰主要依靠组蛋白乙酰化转移酶和组蛋白脱乙酰化酶共同维持动态平衡。组蛋白乙酰化修饰的改变一般会影响植物开花、胚胎发育和愈伤组织诱导。其作用机制主要是促进正电荷中和,增大与DNA之间的排斥力,诱导部分染色质呈现开放状态,促进转录因子的结合,提高基因的表达水平。前期研究工作表明,在植物愈伤组织诱导过程中组蛋白乙酰化的上调表达有助于愈伤组织的形成。Lee、Xu和Furuta等[7-8,31-32]将拟南芥叶片置于愈伤组织诱导培养基上,组蛋白脱乙酰基因HISTONE DEACETYLASE9(HDA9)在培养96 h后开始上调表达,激活生长素途径基因LATERAL ORGAN BOUNDARIES-DOMAIN 17(LBD17),LEAFYCOTYLEDON 1(LEC1),伴随APETALA(AP2),NAM/ATAF1/CUC2(NAC)和BASIC/HELIX-LOOP -HELIX(bHLH)等转录因子家族基因不同程度的表达,进而触发组蛋白的脱乙酰化,引起细胞状态的动态变化,从而使细胞恢复分裂能力,形成愈伤组织。而hda9-1突变体细胞脱分化的能力明显下降,其愈伤组织鲜重与野生型相比下降约30%,也说明了HDA9在促进愈伤组织形成中的重要作用。Zhang等[33]发现将水稻hda710突变体与中华11号的成熟合子胚置于诱导培养基上18 d后,相对于中华11号,hda710的愈伤组织形成明显受阻,细胞团更小,愈伤组织鲜重降低50%。
2.2 组蛋白去甲基化促进愈伤组织形成
组蛋白甲基化主要发生在H3、H4组蛋白的氨基酸残基上,主要是增加氨基酸残基之间的疏水作用力。组蛋白甲基化对基因表达的影响主要依赖于被修饰的位置,如激活性组蛋白修饰H3K4me3和H3K36me3,抑制性组蛋白修饰H3K9me2/me3和H3K27me2/me3。愈伤组织的形成需要经历细胞命运的转变,在这个过程中大量的组蛋白修饰因子参与其中以调控细胞周期、染色质结构和DNA合成的相关基因上调表达进而促进愈伤组织的形成[31,34]。已有文献报道,拟南芥叶片向愈伤组织转变过程中需要先将组蛋白甲基化,抑制叶的身份特性,随后通过组蛋白的脱甲基化激活根的身份特性,促进愈伤组织的形成。Jumonji C domain-containing 30(JMJ30)蛋白是一种组蛋白去甲基化酶。JMJ30结合Auxin response factor 7(ARF7) 和ARF19形 成ARFJMJ30,并招募RABIDOPSIS TRITHORAX-RELATED 2(ATXR2)形成复合物,靶定LATERAL ORGAN BOUNDARIES -DOMAIN 16(LBD16)和LBD29基因启动子区域,抑制H3K9me3,激活H3K36me3,使LBD基因上调,提高细胞分裂活性,加速拟南芥叶片向愈伤组织的转变(图1)。Lee等[35]发现拟南芥jmj30-2突变体愈伤组织的鲜重与野生型相比下降15%。这些结果说明了组蛋白修饰影响了基因的表达,并调控愈伤组织的形成。LYSINE-SPECIFIC DEMETHYLASE 1-LIKE3(LDL3)通过特异性消除H3K4me2,影响下游基因的表达。LDL3在生长区域高表达以促进愈伤组织的形成。Ishihara等[36]将拟南芥ldl3-1和ldl3-2突变体幼苗的根置于愈伤组织诱导培养基上培养14 d后,H3K4me2特异性增加,愈伤组织形成能力显著下降。
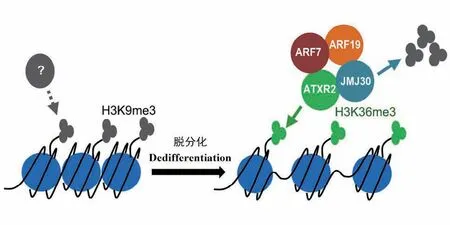
图1 JMJ30 介导的组蛋白去甲基化模式图[35]Fig.1 JMJ30-mediated demethylation of histone in callus formation[35]
2.3 组蛋白甲基化影响端粒长度
端粒作为染色体末端的DNA序列,对于维持植物染色体的稳定性发挥重要作用。动物中一般认为端粒长度会随着细胞分化而变短,但是在植物中这种情况并不相同。通常情况下,植物体细胞分化和衰老都会伴随端粒长度的变化,端粒长度的改变会引起植物发育异常和染色体融合频率的改变。
植物愈伤组织诱导伴随着细胞的脱分化,细胞的分裂过程中染色体的复制必然需要合成新的端粒。端粒长度的维持是一个非常复杂的过程,不仅有基因的参与,还有表观遗传修饰因子的影响。植物愈伤组织诱导过程中组蛋白修饰不仅影响基因的表达情况,还有可能影响端粒的长度[37-38]。Grafi和 Sováková等[38-39]在Columbia(Col)、Landsberg erecta(Ler)和Wassilevskija(Ws)3种生态型的拟南芥叶片愈伤组织诱导和继代培养期间,观测到H3K9me2、H3K4me3、H3K4me2和H3K27me3信号的强度发生改变,同时还发现愈伤组织的端粒长度与叶片中的相比发生了一定程度的增加,但两者之间的内在关系尚不清楚。有一种解释是,H3K9组蛋白甲基转移酶SUVH4/KYP 在植物愈伤组织诱导和端粒长度改变的过程中扮演重要角色。虽然SUVH4/KYP可以影响到端粒长度的改变,但是SUVH4/KYP并不直接控制端粒的长度变化,而是可能依赖于端粒替代性延长(alterative lengthening of telomere,ALT)机制。首先,SUVH4/KYP组蛋白甲基化转移酶对H3K9进行从头甲基化,并激活泛素蛋白水解途径中的相关基因;然后,诱导端粒区域的DNA进行重组,使得端粒长度增加;最后,较长的端粒有利于细胞重新进入细胞周期,促进细胞分裂,引起细胞脱分化形成愈伤组织[38-39]。虽然这种解释可以解析拟南芥中组蛋白修饰的改变与端粒长度之间的关系,但是值得注意的是这种现象并不具有普遍性,Gallego 和Fajkus等[40-41]在烟草叶片诱导愈伤组织的过程中并没有发现端粒长度的变化。因此两者之间并不是存在唯一的分子机制,还有其他的分子机制或影响因素需要进一步研究。
综合上述研究成果可知,表观修饰是细胞命运转变的基础,而组蛋白修饰在细胞命运转变过程中并不是单独起作用,需要与其他因子相互作用,逐步地精细调控相关基因表达以促进愈伤组织的形成,因此对于组蛋白修饰调控愈伤组织的形成需要从更多角度进行研究。
3 小RNA
小RNA(small RNAs)是指一类在植物中高度保守,长度在21-24 nt的单链RNA,通常调控基因转录后的表达,主要分为两类:microRNAs(miRNAs)和 small interfering RNAs(siRNAs)[42-44]。小RNA作为基因表达的负调控因子,广泛分布在植物基因组中,对调节植物生长发育、信号转导和胁迫响应等方面发挥关键作用。
3.1 小RNA调控DNA甲基化促进愈伤组织形成
小RNA可以通过DNA甲基化和染色质修饰介导转录沉默,以调控基因的表达,进而促进愈伤组织的形成。Liu等[45]研究发现玉米幼胚诱导愈伤组织过程中,基因启动子区域的甲基化水平增加,基因表达出现下调现象。同时还发现21 nt和22 nt小RNAs与甲基化水平存在较弱的相关性,而24 nt小RNA与DNA甲基化水平在愈伤组织中呈现正相关,而与对照组未诱导的幼胚中的DNA甲基化水平呈负相关。这种现象的出现可能与24 nt小RNA参与RNA介导的DNA甲基化途径有关。基因组上的重复序列通过RNA Pol II转录生成初级的前体mRNA,前体mRNA在Dicer-like 3的作用下进行剪接加工。U2 snRNP辅助因子(U2 snRNP auxiliary factor,U2AF)作为参与前体mRNA剪接的重要辅助因子,可以识别内含子富含U或UA的序列,实现前体mRNA的剪接。24 nt RNA可以通过靶定下游U2AF亚基引起可变剪接,利用甲基转移酶domains rearranged methyltransferase 2(DRM2)对其基因组序列进行甲基化修饰。DNA甲基化会导致基因的沉默,促进愈伤组织的形成。
3.2 小RNA通过影响激素信号途径调控愈伤组织形成
激素能参与植物不同的发育过程,如细胞分裂、器官形成和胁迫反应等不同的发育过程,小RNA可以通过靶定不同的基因协调激素应答途径,调控植物的生长发育。小RNA不仅可以促进愈伤组织的形成,还会抑制植物愈伤组织的形成。小RNA受到植物激素的诱导,miRNA抑制靶基因的表达,而后者直接调控植物的发育。Liu和Qiao等[42,46]认为miR160可以与AUXIN RESPONSE FACTOR10(ARF10)互作,通过对ARF10的可变剪切,抑制ARF10表达。ARF10进一步结合生长素响应元件(AuxREs)的启动子区域,影响生长素信号通路,抑制ARABIDOPSIS RESPONSE REGULATOR 15(ARR15)表达,即miR160间接提高ARR15表达,影响生长素信号途径,抑制愈伤组织形成。Liu等[42]将mARF10(miR160-resistant ARF10)突变体的下胚轴在转入愈伤组织诱导培养基48 h后,相对于野生型的下胚轴外植体来说,mARF10的愈伤组织起始更快,然而愈伤组织起始慢于Pro35S:miR160c突变体。这说明miR160可以间接抑制愈伤组织的形成。Zhang等[47]认为miR156通过靶定SQUAMOSA PROMOTER BINDING PROTEIN-LIKE9(SPL9,一类保守的DNA结合蛋白),并与B-ARABIDOPSIS RESPONSE REGULATORs(ARRs)相互作用抑制细胞分裂素响应途径,从而影响拟南芥根愈伤组织的形成。在愈伤组织诱导的初期miRNA156表达量突然下调,然后恢复到很高的水平,miRNA156可能负调控SPL9转录因子促进细胞脱分化,诱导愈伤组织的形成。这表明小RNA与细胞分裂素途径在调控愈伤组织中密切相关。
上述研究表明小RNA对于愈伤组织的诱导多以间接形式进行调控,如miRNA可以通过调控激素信号途径影响愈伤组织的形成。一种miRNA可以参加不同的激素信号途径,且不同的信号途径之间又具有相互作用,诱导细胞的脱分化。miRNA通过不同的途径调控下游信号,不同途径形成截然相反的作用。因此,未来的研究需要考虑到miRNA作用的多重性和交互性,继续挖掘更多小RNA的有效功能,可为小RNA调控愈伤组织形成的研究提供参考依据。
4 染色质重塑
染色质重塑是植物细胞命运转化过程中重编程的主要现象,涉及核小体的结构及其与DNA相对序列位置的改变,使组蛋白和DNA之间的结合状态变为“疏松”状态,增加了基因启动子区序列的可接近性,使反式作用因子如转录因子与之结合并启动基因转录,调节基因的表达[48]。
4.1 染色质重塑影响基因表达
染色质结构的改变可引起植物表型的改变,参与染色质结构和功能改变的因素相互作用,构成了染色质结构动态、随机和不确定性的变化,这种变化可以引起DNA可及性的改变,通过招募转录因子调控基因的表达。染色质重塑可以通过调节染色质的结构来影响基因的表达,因此染色质结构的重塑对于植物细胞的脱分化至关重要。Polycomb group(PcG)可以通过修饰染色质以抑制特定分化状态下基因的表达。Polycomb repressive complex 1(PRC1)和PRC2是PcG中两类重要的表观遗传修饰复合体,一般认为它们能催化抑制性组蛋白修饰H3K27me3的形成从而抑制基因表达,维持植物细胞的分化状态。Lee等[8]发现拟南芥PRC1或PRC2的 突 变 会 使LEAFY COTYLEDON 1(LEC1)、LEC2、AGAMOUS-LIKE 15(AGL15)、BABY BOOM(BBM)、WUSCHEL(WUS)和WUSCHEL RELATED HOMEOBOX 5(WOX5)异位表达使根自发形成愈伤组织。这说明了PcG可以调控H3K27me3修饰影响愈伤组织的形成。
4.2 染色质重塑影响细胞命运转变
染色质重塑可以通过抑制染色质的重新组装影响愈伤组织的形成。细胞可塑性是分化细胞获得新命运的能力。其中,脱分化形成愈伤组织就是一种细胞可塑性的表现形式,脱分化过程可分两个阶段:细胞极性的获得和重新进入S期。主要表现在分化细胞从G1期向S期的转变,该过程需要具有新命运细胞遗传物质的合成,为脱分化的细胞增殖做准备。异染色质蛋白1(heterochromatin protein 1,HP1)是异染色质的特征性蛋白,最初从果蝇多线染色体异染色质中被分离出来。组蛋白H3K9甲基化可以使HP1重新分布,抑制染色质的重新组装,诱导基因的沉默,引起分化细胞命运的转变[49]。Williams等[49]在研究拟南芥叶片原生质体诱导形成愈伤组织的过程中,发现异染色质区的HP1蛋白与retinoblastoma protein(pRb)结合,招募常染色质E2F的靶基因RIBONUCLEOTID REDUCTASE2(RNR2) 和PROLIFERATING CELL NUCLEAR ANTIGEN(PCNA),形成pRb/E2F靶基因的复合体,使E2F的靶基因上调表达,在激素处理72 h后促使细胞进入S期,引起细胞分裂增殖,从而诱导愈伤组织的形成。
分化细胞向全能性干细胞的命运转变在细胞生物学领域依然是一个研究热点。染色质重塑通过调控下游细胞周期调控基因的表达,最终影响植物细胞命运的转变。染色质重塑与细胞周期调控都有助于愈伤组织的形成,因此染色质重塑与细胞周期调控的结合研究有助于我们更好地理解植物愈伤组织形成的具体机制。
5 转座子
转座子又称跳跃基因,是一类可以移动的遗传因子,指基因组中可以改变位置的DNA序列。最早是由科学家芭芭拉·麦克林托克在研究玉米籽粒颜色变化中发现,并提出了著名的“Ac-Ds调控系统”。植物转座子主要分布在着丝粒和基因密集区,具有种类多,数量大的特点。通常可分为:I型转座子、II型转座子及Helitron转座子[12]。虽然转座子数量庞大,但只有少数转座子可以表达。转座子作为表观遗传调控的重要靶位点,影响基因的表达,在调控生长发育、应对环境变化和细胞命运转变等过程中发挥重要的作用。
5.1 转座子甲基化调控愈伤组织形成
在细胞发育过程中,愈伤组织诱导伴随着细胞命运的转变,细胞重新进入细胞周期。重新进入细胞周期需要合成大量的遗传物质,虽然遗传信息的稳定表达是至关重要的,但是具有活性的转座子在基因组间的跳跃常常影响基因的表达,如转座子插入到基因内部,则会引起基因的失活;当转座子插入到调控区,则会影响基因的表达。为了维持DNA复制的稳定性,对一些转座子进行失活,需要抑制性修饰如甲基化来维持遗传信息的稳定表达,当转座子插入到基因上游,将甲基化的修饰延伸到临近基因的调控区域,则会引起基因表达的下降。植物愈伤组织诱导过程中转座子就常伴随甲基化水平 的改变[12,50-55]。Zhang、Baucom、Wang和Lanciano等[56-59]在玉米愈伤组织诱导过程中,LTR转座子发生甲基化的改变。这表明LTR类型的转座子在玉米愈伤组织诱导过程中具有调控作用。但是在继代培养中Copia呈现正调控作用,而Gypsy呈现负调控作用。在水稻中,Saze等[60]也发现Gypsy中的Tos17在愈伤组织诱导过程中随着甲基化程度降低而逐渐被激活,并在继代培养中出现拷贝数增加的现象。这进一步说明由于LTR转座子甲基化抑制的不足,会造成不同表观遗传调控现象。
5.2 DNA甲基化和组蛋白修饰共同调控转座子 活性
DNA甲基化不仅可以单独调控转座子的表达,还可以与组蛋白修饰相互作用共同影响转座子的活性。在拟南芥中,组蛋白脱乙酰基酶HDA6对于转座子和胞嘧啶甲基化维持是必需的,HDA6通过调节组蛋白乙酰化和甲基化以及转座子的DNA甲基化状态使转座子沉默,有助于稳定基因表达状态。Lee等[30]认为DEFICIENT IN DNA METHYLATION 1(DDM1)、METHLTRANSFERASE 1(MET1) 和HISTONE DEACETYLASE 6(HDA6)三者形成蛋白复合体,通过调节组蛋白H3和H4的乙酰化以及组蛋白H3K4甲基化来保持转座子沉默,从而促进愈伤组织的形成。
转座子作为活跃的遗传因子,在植物基因调控方面发挥重要作用。植物基因组中含有大量的转座子元件,且种类丰富,在玉米等具有复杂基因组的植物中占比高达85%以上,转座子在基因组中的扩增和向基因密集区的转移为植物基因表达调控研究提供了广阔的空间。前期的研究证明了愈伤组织诱导期间基因表达的变化需要转座子的参与,但是需要在研究中充分考虑到不同类型的转座子在植物愈伤组织诱导过程中发挥的作用,降低转座子对细胞命运转变的影响。
6 总结与展望
植物离体组织或器官在外源激素的刺激下发生细胞命运的转变,即已经分化的成熟细胞逆转成脱分化的多能性干细胞。在脱分化过程中伴随着基因表达,染色质结构的改变,这些改变需要大量的表观遗传修饰参与其中,DNA甲基化,组蛋白修饰,小RNA,染色质重塑和转座子以不同的方式和机制影响愈伤组织的形成。尽管表观遗传调控植物愈伤组织诱导已有不少研究报道,但该领域的研究还处于初级阶段,笔者认为,以下4个方面还需进一步开展研究。
6.1 研究材料的局限性
植物愈伤组织诱导是植物组织培养的重要环节,尽管多种植物已成功诱导出了愈伤组织,但是仍有大量植物材料(如顽拗植物)不能诱导出愈伤组织。即使在已经诱导出愈伤组织的材料中依然存在很多难题,如单子叶植物可以诱导愈伤组织的外植体部位有限,裸子植物诱导相对于被子植物更加困难。在可以成功诱导愈伤组织的植物中,表观遗传学研究主要集中在拟南芥、玉米和水稻等模式植物,对于其他非模式植物开展的相关研究却非常有限。由于研究材料的类型不同,外植体的生理状态及取材时间的差异,常常会得到不同的实验结果。例如,全基因组范围的H3K27me3积累对于拟南芥叶片诱导愈伤组织是必需的,但是这种修饰对于根作为外植体却影响很小[48]。因此,应广泛开展不同植物及不同外植体在愈伤组织诱导过程中的表观遗传学研究,积累更多的实验结果,为揭示植物愈伤组织诱导过程中的表观遗传学规律奠定基础。
6.2 研究方法的局限性
表观遗传学的研究方法主要有chromatin Immunoprecipitation(ChIP),RNA binding protein Immunoprecipitation(RIP)和SmartFlare等。虽 然针对愈伤组织诱导过程有大量的表观修饰的研究,但是研究方法依然存在很多的局限性:一是使用的抗体相对较单一,无法全面反映植物体内的表观遗传修饰;二是种类繁多的小RNA及转座子的鉴定在很大程度上依赖于生物信息学的研究,对其功能研究却相对滞后,无法得知在愈伤组织诱导过程中的具体功能,尤其是可能存在相反的调控结果;三是研究方法主要集中在探究一种类型的表观遗传修饰,并没有将多个遗传修饰结合起来研究。因此,未来研究需要结合下一代的测序技术,如染色质转座酶可及性测序(assay for transponsase-accessible chromatin with high-throughput sequencing,ATACseq)、DNA亲和纯化测序(DNA affinity purification sequencing,DAP-seq)、单细胞技术和基因编辑技术等多种手段,并不断改进现有的研究方法,整合多组学、跨学科的研究手段,探寻能够全方面多维度反映植物愈伤组织诱导过程中的表观调控机制。
6.3 理论知识的缺乏
随着表观遗传研究的不断深入,大量的表观遗传修饰被发掘,并应用到生物学研究中,但是应用到植物愈伤诱导研究的表观遗传修饰只有少数几类,因此我们无法将现有零碎的知识整合起来全面地研究表观修饰所反映的内在机制。另外,表观遗传因子可以聚集在一起,受到上游不同基因的调控,同时又调节众多下游基因的表达,从而影响诸多的发育过程。这些复杂的信号通络,构成了立体的空间网络。目前的研究多集中在某个单一的信号通路上,对多种通路是否有相同的功能和多信号通路之间的相互作用探索不够深入。在未来的研究中需要建全动态的复杂表观调控网络,深化表观遗传对愈伤组织调控的理论知识。
6.4 分子机制的薄弱
现有的研究多集中在愈伤组织诱导过程中总DNA甲基化水平的改变,对于单基因甲基化水平的改变及如何精细化调节基因表达依旧不明确;组蛋白修饰之间相互作用比较复杂。例如,H3ac与H3K27me3皆可以拮抗激活根发育基因PLTs,又能协同抑制LECs基因。因此,可能存在其他的机制调控两者之间的关系;小RNA的研究主要集中在生长素和赤霉素方面,对于独脚金内酯等新型激素的研究还是空白,同时由于小RNA主要以家族形式存在,目前研究中的小RNA转基因材料只是表达水平下降,并不能真正反映小RNA的功能;植物体内多种染色质重塑复合体是如何特异性调节靶基因,以及如何与组蛋白修饰相互作用介导基因沉默的机制还有待研究;转座子的激活和沉默机制还需要具体分析。
细胞的分化和脱分化是植物生长发育的重要环节,愈伤组织作为分化细胞脱分化的产物,被广泛应用到生物学研究的多个领域[61]。在植物愈伤组织诱导过程中,分化细胞与脱分化形成的愈伤组织细胞,非胚性愈伤组织向胚性愈伤组织的定向诱导,需要平衡分化和脱分化的关系,从遗传和表观遗传协同的角度去理解并调控该发育过程。随着人们对植物发育机制的深入解析,未来将可能设计更强大的分子工具,进行植物组织培养的“私人订制”。
