细菌周质分子伴侣LolA研究进展
2021-09-14贺小丽郭磊周韩佳慧唐殷袁媛代其林平淑珍江世杰
贺小丽 郭磊周 韩佳慧 唐殷 袁媛 代其林 平淑珍 江世杰
(1. 西南科技大学生命科学与工程学院,绵阳 621010;2. 中国农业科学院生物技术研究所,北京 100081; 3. 中南大学生命科学学院,长沙 410078)
细菌脂蛋白是一种由脂质和蛋白质组成的膜锚定蛋白,该类蛋白以携带信号肽的前体形式在细胞质中合成,然后在内膜(IM)周质侧通过N端半胱氨酸的脂质修饰[1-6],经过3种酶的加工最终形成成熟的三酰化脂蛋白。细菌的脂蛋白涉及多种细胞功能,如细胞表面结构的生物发生和维持、底物的运输和药物的流出[7-10]。此外,部分蛋白分泌系统中也含有脂蛋白,致病性革兰氏阴性菌可以利用这些蛋白质分泌系统将蛋白质注入宿主细胞[11]。因此,理解脂蛋白的转运体系对于调节细菌与其宿主相互作用有重要意义。成熟脂蛋白通过Lol系统(Lipoprotein outer membrane localization)转移到外膜(OM)或者滞留在细菌内膜(IM)[11-13]。Lol系统由内膜上的ABC(ATP-binding cassette transporter)转运复合物LolCDE、周质伴侣分子LolA和外膜脂蛋白受体LolB组成,该系统的不同组分在脂蛋白向外膜的转运过程中发挥重要作用[13-15]。伴侣分子可以将疏水性脂蛋白从细胞内膜转运到外膜上,1995年研究发现的脂蛋白特异载体LolA揭示了疏水脂蛋白穿过亲水周质的复杂过程[16]。
到目前为止,周质分子伴侣已被证实参与两个主要过程,即位于OM(OMPs和脂蛋白)的蛋白质成熟过程[17]和在应激条件下保护周质蛋白的过程[18]。LolA伴侣蛋白是一种可溶性蛋白质,用于协助OM脂蛋白在周质中的转运。本文通过对周质分子伴侣LolA的结构、参与的转运体系和LolA生物学功能进行综述,旨在阐明脂蛋白转运的分子机制以及为细胞膜靶向药物治疗提供参考。
1 细胞周质伴侣LolA结构
LolA是Matsuyama等[16]发现的一种以单体形式存在的伴侣蛋白,它可以将疏水性脂蛋白从细胞IM穿越亲水性周质空间转运到OM上。LolA蛋白具有一段由6个高度保守氨基酸组成的短肽序列(Lys-Arg-Pro-Asn-Leu-Phe),整个蛋白折叠成一个不完整的β-桶(由11个反向平行的β链组成)和一个盖子结构(由3个α-螺旋组成),它们一起形成疏水腔,为脂蛋白酰基链提供潜在的结合位点[19]。LolA有一个额外的环结构,该结构包含一个短α-螺旋和C端的第12个β链,通过阻断载体蛋白与磷脂的相互作用,从而阻止脂蛋白逆向转移至细胞质膜[18,20]。LolA中第二个β链的Arg残基与几个α螺旋盖子残基的氢键进一步限制了脂蛋白进入LolA疏水腔[21-22](图 1)。Pastukhov等[23]通过验证LolA和 突变体LolA(R43L)的bis-ANS荧光性发现LolA的疏水区处于开放或关闭状态,取决于LolA是否结合脂蛋白,这种分子内的“扣环”允许LolA盖子可逆地打开或关闭。研究发现LolA(R43L)突变体的Arg残基突变后,LolA不能有效地将脂蛋白转移至LolB[24]。相反,通过LolA(I93C)盖子半胱氨酸残基取代突变体中的二硫键将LolA盖子锁定在关闭构象中是有毒的,会引起包膜应力并激活Cpx双组分系统[25]。
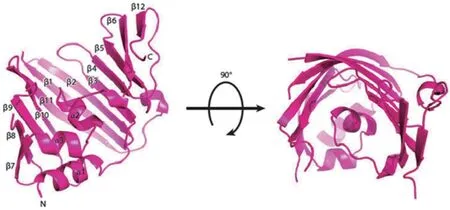
图1 大肠杆菌LolA的晶体结构[22]Fig. 1 Crystal structure of Escherichia coli LolA[22]
2 周质伴侣LolA参与脂蛋白生物合成
OM脂蛋白首先被Lol-CDE从IM中获取,周质伴侣蛋白LolA与脂蛋白的酰基链结合,保护脂蛋白的疏水部分不受周质亲水环境的影响。此后LolA和脂蛋白形成可溶复合物穿过周质空间到达OM,LolA将其底物蛋白质转移到外膜脂蛋白受体LolB,完成脂蛋白的转运过程[18,22](图2)。
2.1 LolA与LolCDE复合物相互作用
转运体系中周质伴侣LolA首先与LolCDE复合物进行相互作用。LolCDE复合物作为一种ATP结合转运蛋白,由1个膜亚基LolC、1个膜亚基LolE和2个ATP结合亚基LolD组成。大肠杆菌外膜特异性脂蛋白被ATP结合转运体LolCDE复合物识别,该转运体消耗2个ATP能量,将其传递至周质分子伴侣LolA进而形成可溶性复合物。位点特异光交联技术揭示了LolA疏水腔入口与LolCDE存在相互作用[26]。在与ATP结合之前,LolCDE与内膜中的外膜定向脂蛋白相互作用,导致LolD对ATP的亲和力增加。随后ATP与LolD的结合进一步导致LolC / LolE亚基的构象变化,并降低LolCDE与脂蛋白之间的疏水相互作用。LolD介导的ATP水解进一步引起LolC / LolE的构象变化,从而使脂蛋白转移到LolA,伴随着疏水腔的打开[26](图2)。

图2 Lol系统介导的脂蛋白转运和外膜锚定[22]Fig. 2 Lipoprotein transport and outer membrane anchoring mediated by the Lol system[22]
LolC和LolE的周质区域显示出与LolA的序列相似性,表明这些区域也具有疏水腔[22],即脂蛋白可能通过其疏水腔的入口或出口从LolCDE转移至LolA再到LolB。交联残基的空间排列显示在酰基链转移过程中,疏水腔的开口非常接近,支持脂蛋白从LolE到LolA的“mouth to mouth”转运[26-27]。LolC和LolE都是大肠杆菌生长所必需的,并且具有相似的膜拓扑结构,即具有暴露于周质的4个跨膜区域[28-29]。虽然他们的结构和序列相似,但只有LolC与LolA产生交联产物,表明LolA特异性地与LolC相互作用[22]。图3揭示了LolC暴露于溶剂的 β-发夹环(the “Hook”)和3个表面残基(the “Pad”)是如何从周质中捕获LolA进而使其接收脂蛋白[30]。另外,当LolCDE结合脂蛋白时,LolA和LolC的互作增强,然而LolA和LolE之间没有发生相互作用[26]。LolA脂蛋白复合物与LolB的相互作用不受游离LolA的抑制[30-31],这些结果说明脂蛋白的结合影响Lol蛋白之间的互作。LolCDE对ATP的依赖性随着脂蛋白结合而增加[32]。所有的这些调整对于脂蛋白从内膜单方向转运到外膜的效率来说是非常重要的。
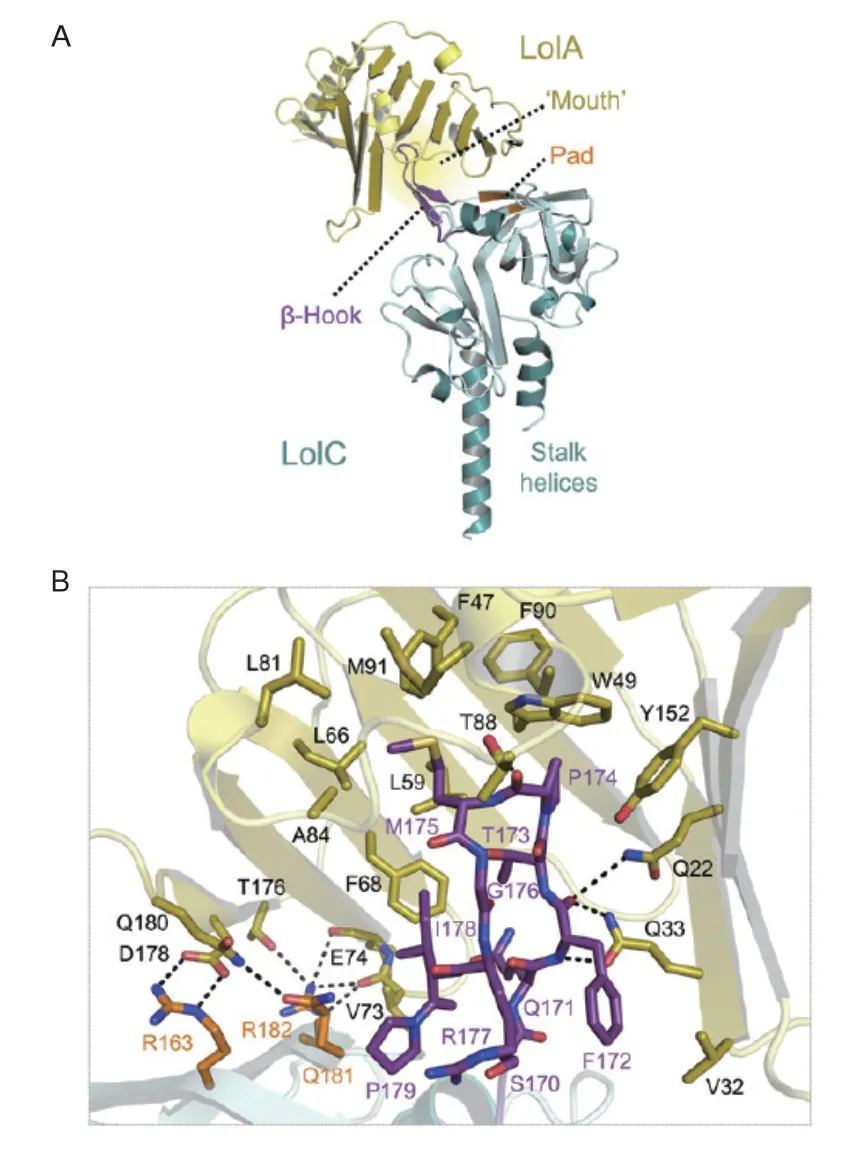
图3 LolA的晶体结构与LolC的周质域结合[30]Fig. 3 Crystal structure of LolA is combined with the periplasmic domain of LolC[30]
2.2 LolA与LolB的相互作用
使用体内光交联技术应用于Lol系统,进而阐明脂蛋白如何通过Lol蛋白从内膜转移到外 膜[26]。该技术能够将非天然的光敏氨基酸对苯甲酰基-苯丙氨酸(pBPA)引入到琥珀酸密码子(TAG) 中[33-34]。以琥珀酸突变的Lol蛋白及其靶蛋白为载体,用紫外光照射细胞进行体内光交联。对交联产物的分析表明,LolA和LolB在各自疏水腔的入口处发生相互作用[35]。脂蛋白的相互作用位点仅位于LolA和LolB的空腔内,表明它们的疏水腔是脂蛋白酰基链的结合位点。NMR分析也发现了LolA和LolB之间类似的作用模式[36](图4)。当LolA-脂蛋白复合物穿过周质到达OM,脂蛋白将以“mouth to mouth”的方式从LolA转移到LolB。LolB本身是OM特异性脂蛋白[37-39]。脂蛋白从LolA转移到LolB不需要外源性能量,这种反应是由LolA和LolB对脂蛋白亲和力的差异驱动,即脂蛋白对LolB的亲和力高于对LolA的亲和力,固定在OM内小叶上的LolB接受来自LolA的脂蛋白,然后将其转移到OM[36]。
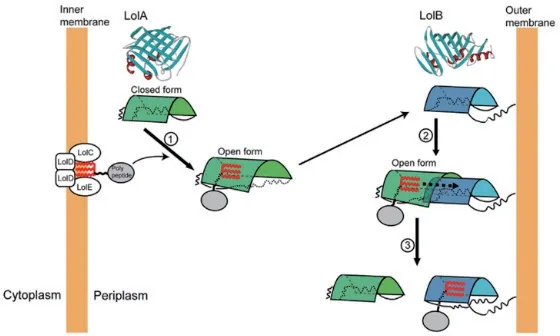
图4 脂蛋白在LolA和LolB上的转运模型[36]Fig. 4 Transport model of lipoprotein on LolA and LolB[36]
3 细胞周质伴侣LolA功能
3.1 LolA在脂蛋白外膜定位及脂蛋白分类中的重要作用
Matsuyama等[16]对脂蛋白外膜定位(Lol)系统的研究解决了脂蛋白如何转运的难题 。研究发现原生质体分泌各种周质和疏水性β-桶外膜蛋白到外部环境中,而外膜特异性脂蛋白(如Lpp蛋白)仍锚定在原生质体的内膜上。尝试在外部培养基中添加周质组分的情况下,Lpp也能够分泌到外部培养基中[26]。从细胞周质成分中纯化了能够释放Lpp的活性物质,检测到一种水溶性蛋白LolA。此后研究发现LolA也可以释放其它外膜特异性脂蛋白,如Pal、BamC、Slp以及RlpA,内膜特异脂蛋白AcrA和NlpA仍保留在内膜原生质体上,这些结果充分说明脂蛋白释放步骤对于脂蛋白向外膜的转运非常重要。
原生质体释放的脂蛋白与LolA形成1∶1的水溶性复合体[26]。LolA的缺失会导致严重的生长缺陷,并损害外膜脂蛋白Lpp和Pal的外膜定位。尽管LolA缺失并不能立即阻止缺乏Lpp的细胞的生长,但染色体lolA基因的破坏对Lpp菌株是致命的,这表明LolA是脂蛋白外膜定位所必需的[40]。另外将LolA(R43L)中43位的Arg突变为Leu,可接受来自LolCDE的脂蛋白,但不能将其转移到LolB,突变导致LolA与脂蛋白的疏水相互作用显著增加,从而导致LolA-脂蛋白复合物在周质中的积聚[41],因此LolA在脂蛋白的分类和外膜定位中都起着重要的作用。
3.2 LolA在脂蛋白释放中的重要作用
蛋白突变体LolA(I93C/F140C)衍生物中,Cys取代了位于93位的Ile和140位的Phe,由于两个Cys残基之间的化学分子内二硫化物的缺失,该衍生物强烈抑制了菌株的生长。研究发现I93C/F140C的表达可激活Cpx双组分系统,对细胞包膜应激作出反应,Cpx系统是大肠杆菌的5个包膜应激反应系统之一,通过形成二硫键使疏水性口袋关闭,阻断了脂蛋白的转运[25]。研究发现该突变体的表达强烈诱导了lolA基因的转录。LolA或LolB蛋白的缺失也触发了lolA基因的转录。LolA(I93C/F140C)揭示空腔盖子的打开和关闭是脂蛋白从LolCDE持续转移到LolA的关键。另外LolA和LolCDE促进ATP依赖的外膜定向脂蛋白从大肠杆菌内膜释放[42]。第47位Phe突变为Glu的LolA(F47E)突变体在由LolCDE重构的球质体和蛋白脂质体中释放脂蛋白方面存在缺陷。当与含有LolCDE的蛋白脂质体孵育时,LolA保留在上清中,而LolA(F47E)结合到蛋白脂质体上。LolA(F47E)与LolCDE的紧密联系导致了体内显性的负表型,揭示LolA和LolCDE的相互作用对脂蛋白的释放至关重要[43]。
3.3 LolA作为周质脂转运蛋白和细胞生长必需因子
当缺失LolA时,外膜特异性脂蛋白在大肠杆菌细胞的内膜上逐渐积累[26]。因此,在将疏水外膜特异脂蛋白穿过亲水周质转运到外膜这一过程中,LolA起到关键作用。此外,敲除lolA基因的菌株在耗尽LolA条件下会在内膜中积累OM脂蛋白,并且此菌株只能在特殊环境下生存[40],证实了LolA在体内作为周质脂蛋白转运和细胞生长的必需因子的作用。另外,LolAB在野生型细胞中的基本功能是提供一种有效的运输途径,减轻由OM脂蛋白错误定位到IM引起的毒性。当LolAB途径耗尽时,发现了两种OM靶向脂蛋白能杀死细胞:Lpp与IM形成有毒的PG交联;OsmB则可能在IM上形成孔,损耗质子动力杀死细胞[44]。因此,LolA是疏水外膜脂蛋白通过亲水性周质空间向外膜转运的关键因素。
4 细胞周质伴侣LolA抑制剂
细胞外膜OM是一种独特的结构,对抗生素等有毒分子起着很强的渗透屏障作用[45],破坏OM完整性的化合物有望降低OM的屏障功能,从而提高现有抗生素的效率。鉴于OM脂蛋白是OM组装的必要成分,且LolA在脂蛋白转运、外膜定位及分类的重要作用,LolA抑制剂的研发将为开发新的药物来克服革兰氏阴性菌的抗生素耐药性提供新的思路。最新研究表明,MAC12343(MAC)及其降解产物S-(4-chlorobenzyl)isothiourea和3,4-dichlorobenzyl carbamimidothioate等疏水小分子能够与LolA结合并在体内对其抑制,使大肠杆菌外膜更具渗透 性[46-47]。Braun lipoprotein(BLP)是大肠杆菌中含量最丰富的蛋白质通过一个脂质部分锚定在外膜上,其N端有3个烃尾,在C端共价结合在细胞壁肽聚糖上[48-49]。迄今为止,BLP是唯一已知的共价结合在细胞壁上的蛋白质,为细胞包膜提供稳定性。
研究表明,小分子MAC13243及其降解产物很容易结合到LolA的特定空腔内。即使空腔已被3个MAC分子占据,BLP脂尾也能与空腔结合,只是没有小分子存在时,脂尾与空腔结合的较弱。在腔内,BLP尾部和MAC分子相互缠绕(图5)。有趣的是,当BLP单独与腔体结合时,LolA会发生构象变化,这为BLP和LolA之间提供了稳定作用,MAC及其降解产物通过降低BLP对LolA的亲和力抑制LolA,这样MAC- BLP复合物就可以在到达LolB之前从LolA中脱落[47],从而降低LolA转运效率破坏OM完整性,使细菌更具渗透性,从而提高抗生素效率。

图5 LolA疏水腔中BLP的结合模式[47]Fig.5 Binding mode of BLP in the hydrophobic cavity of LolA[47]
5 总结与展望
综上所述,周质伴侣LolA作为脂蛋白转运和细胞生长的必需因子,在脂蛋白释放、脂蛋白外膜定位及脂蛋白分类方面发挥重要作用。随着对脂蛋白LolA晶体结构的深入分析,使得我们对疏水性脂蛋白如何通过Lol系统穿过亲水周质有了更清晰的认识[18]。基于生化实验验证结果,LolA蛋白的疏水腔的打开和关闭在脂蛋白转运中起关键作用[25,50]。此外,当用LolCDE抑制剂处理大肠杆菌时,发现LolCDE复合物亚基的转录水平没有增加。然而,在较高浓度的抑制剂作用下,lolA转录水平略微增加了3.5倍[50]。由于脂蛋白Lol系统在病原菌中的重要性[51-54],对脂蛋白转运分子机制的理解将为感染性疾病的治疗提供更多的药物靶点。
抗生素耐药性是一个重大的公共健康威胁。多重耐药革兰氏阴性菌由于其对抗菌化合物的内在渗透性较低,以及广泛存在的多药外排泵而面临着特殊的挑战。Pathania等[51]首次通过化学基因组学方法发现了一种以LolA为靶点的新型抗菌化合物MAC13243。MAC13243代表了一种针对细菌中脂蛋白的新型化学探针,并有望作为革兰氏阴性选择性的新型药物,先导MAC13243的亚致死浓度会导致LolA分子伴侣的部分抑制。这导致外膜脂蛋白部分保留在内膜上,这些错误靶向的脂蛋白中的一些直接与外膜生物发生有关,例如LolB(插入脂蛋白),BamB(插入β-桶蛋白)和LptE(插入LPS分子),因此,LolA的部分消耗可以直接影响外膜关键成分的生物发生,从而削弱膜并导致通透性增加。可利用MAC13243处理的细胞所增加的通透性来增加大支架抗生素如新生霉素和红霉素的吸收[46]。对耐多药铜绿假单胞菌有一定的抑制作用,对开发生物系统的新化学探针和治疗疾病的新药物的研发有重要作用。
近期研究表明,在缺乏底物的菌株中,当定位错误时,可以通过激活包膜应激反应绕过LolA和LolB而不会影响必需脂蛋白的运输。这意味着这些蛋白质在脂蛋白转运中不执行机械运输步骤。相反,这些蛋白质的关键功能是防止错误定位的脂蛋白的致命积累[44,55]。由此推断出LolAB的出现可能是为了提高运输效率和运输能力。随着对LolA更加深入的了解,如何抑制LolA功能降低脂蛋白的转运效率从而降低外膜完整性,将对提高抗生素效率、降低抗生素抗性具有重要意义。Flavobacterium johnsoniae(拟杆菌门)中LolA的突变会导致细菌的滑动能力丧失,这与LolA在几种已知有助于滑动机制的BaLpp定位中的作用一致。BaLpp生物合成途径特性表明,该途径可能为新型抗生素提供一个潜在靶点[56-57]。此外,抑制丝状线虫内共生体中BaLpp的生物合成,可能是预防全球重要寄生虫引起的疾病的一个靶点[57]。目前还没有LolA或LolB结合BLP或抑制剂分子的结构,因此,BLP的结合模式是未知的,而且一些重要的问题仍然没有得到解答,例如BLP与LolA的空穴结合的深度问题,空腔中可容纳多少酰基链?此外,通过阻止小分子进入疏水腔来抑制LolA的机理没有直接的结构或分子基础。因此对于LolA结合抑制剂机制的进一步阐明,不但有助于人们了解抑制剂的具体作用机制,针对脂蛋白的释放过程筛选新型药物,也有助于寻求新的抗生素靶点,以解决日益增长的抗生素抗性问题。
前期大量研究显示,对LolA功能的研究主要集中在脂蛋白的分类、释放、转运以及外膜定位等方面,但也有研究证明LolA突变体在多种膜扰动剂的存在下表现出显著的细菌粘附、胞外酶产生、毒性和耐受性的降低,突变体的这些表型变化可以通过完整lolA基因的表达回复至野生型水平[58],这项研究结果为细菌LolA的功能提供了新的见解。此外,本实验室在研究极端微生物的抗逆分子机理的过程中,发现来源于抗逆模式微生物耐辐射异常球菌的LolA同源蛋白参与细胞的非生物胁迫抗性过程。通过基因突变获得lolA基因突变体,开展非生物胁迫实验发现,该基因突变导致细菌在盐和氧化胁迫条件下的生存能力下降(数据未发表),表明LolA蛋白可能参与了细菌的耐盐抗氧化过程,推测周质分子伴侣蛋白LolA在细菌耐受非生物胁迫过程中也发挥重要作用。周质分子伴侣蛋白LolA可能通过调节未知的调控途径(如双组分信号转导系统)来影响编码多种毒力相关功能的基因的表达。但是,需要进一步研究可能编码在lolA突变后激活的未知调控途径的候选基因,以验证这种可能性。
