NF90在卵巢癌组织中的表达及对SKOV-3血管生成的影响
2021-09-14张文倩华媛媛熊正爱曾倩茹
张文倩 华媛媛 范 灵 凌 丽 熊正爱 曾倩茹
(重庆医科大学附属第二医院妇产科 重庆 400010)
卵巢癌是死亡率最高的妇科恶性肿瘤[1],易复发和转移,由于卵巢位于盆腔深处,多数患者确诊时已为晚期,5年生存率仅30-40%,患者预后差。结合靶向治疗的综合治疗卵巢癌是目前研究热点之一,血管生成在肿瘤发生发展的重要作用及抗血管生成治疗得到极大关注。卵巢肿瘤细胞生长、转移和复发都依赖于新生血管生成提供养料和氧气。缺氧、血管损伤、促血管生成因子等多种因素诱发血管生成,其中缺氧是血管生成的关键驱动力[2]。缺氧环境下缺氧诱导因子1-α(hypoxia inducible factor 1α, HIF-1α)转录活性增强,诱导肿瘤细胞和肿瘤相关基质细胞生成多种促血管生成因子,如血管内皮生长因子(vascular endothelial growth factor, VEGF)家族尤其是VEGF-A、VEGFR2、血管生成素2(angiopoietin 2, ANGPT2)[2]等,VEGF-A除在肿瘤血管生成发挥关键作用[2]外,还促进肿瘤细胞增值[3]。
核因子90(nuclear factor 90,NF90,也称为DRBP76和NFAR1)和NF110(也称为IL3、NFAR2和TCP110)是白细胞介素增强结合因子3(interleukin enhancer binding factor 3,ILF3)差异性剪接生成的主要产物[4][5][6],分子量分别为90kDa和110kDa。NF90在肝细胞癌[7]、鼻咽癌[5]、宫颈癌[8]、卵巢癌[9]、胃癌[10]等恶性肿瘤中过表达,其作用被广泛研究,但与卵巢癌血管生成的关系少有报道。本研究探寻NF90在卵巢癌组织中的表达情况,体外实验验证敲减NF90对卵巢癌细胞VEGF-A表达的影响,为后期深入研究提供实验思路。
一、材料与方法
(一)Oncomine检索ILF3 mRNA在卵巢癌组织表达情况
Oncomine(www.oncomine.org)是目前世界上最大的癌基因芯片数据库和整合数据挖掘平台,拥有最全的癌症突变谱、基因表达数据以及相关的临床信息,可利于发现新的生物标记物或新的治疗靶点。本研究通过检索“ILF3”分析ILF3 mRNA在包含卵巢癌在内的常见恶性肿瘤组织中的表达情况,从Oncomine数据库中筛选基因,在本研究中设置检索条件为:1.Gene: ILF3,2.Analysis Type: Ovarian Cancer vs. Normal Analysis,3.Data Type: mRNA, 4.Over-expression.
(二)Human Protein Atlas检索ILF3蛋白在卵巢癌组织表达情况
Human Protein Atlas(www.proteinatlas.org)是利用基于抗体的成像、基于质谱的蛋白质组学、转录组学和系统生物学技术整合各种人类蛋白质的数据库。Human Protein Atlas包括组织图谱、细胞图集和病理学图谱,其中,组织图谱显示蛋白质跨越人体所有主要组织和器官的分布,细胞图集显示蛋白质在单细胞中的亚细胞定位,病理学图谱显示蛋白质水平对患者癌症的患者存活的影响。本研究利用Human Protein Atlas中的组织图谱检索ILF3转录蛋白(NF90和NF110)在卵巢子宫内膜样腺癌、浆液性腺癌和正常卵巢组织中的表达情况。
(三)慢病毒构建
携带NF90干扰序列基因的重组慢病毒购于汉恒生物有限公司(上海,中国)。其中阴性对照插入的片段scramble为一段乱序不针对任何人或鼠的shRNA,干扰载体为pHBLV-U6-ZsGreen-PGK-Puro。
(四)细胞培养、构建缺氧模型及慢病毒转染
人卵巢癌细胞系SKOV-3购于中国科学院细胞库,细胞采用含10%胎牛血清(Ausbian,澳大利亚)的DMEM高糖培养基(Gibco,美国)培养,培养箱设定为5%CO2、37℃。
取对数期细胞,弃旧培养基,PBS洗涤后加入无血清培养基孵育过夜。次日,弃旧培养基,PBS洗涤后加入CoCl2工作液避光孵育构建化学缺氧模型。
对数期SKOV-3经细胞胰酶常规消化后按1×105个/孔接种于6孔板,常规孵育过夜。次日采用4小时小体积感染法进行慢病毒转染,即弃原培养基,加入1/2(即500μl)体积无血清培养基稀释的慢病毒液,同时设立空白对照组,37℃孵育4h后补齐无血清培养基至正常体积(即1ml)。转染24h后,弃病毒培养基,改为完全培养基,继续培养。转染72小时候,荧光显微镜观察慢病毒转染效率。用puromycin筛选稳转株,避光孵育,连续筛选2周后得到稳定转染细胞株,更换为完全培养基继续扩大培养。同时,收集细胞进行下一步实验。
(五)Western blot
RIPA裂解液、PMSF和磷酸酶抑制剂按体积比100:1:1充分混匀后裂解细胞并提取细胞总蛋白。采用BCA法测定蛋白浓度。SDS-PAGE凝胶电泳后,采用湿转法200V恒压转膜2小时;将含5%脱脂奶粉的TBST封闭液中室温封闭2小时;用相应的一抗4℃孵育过夜;TBST洗膜3次后二抗室温孵育1小时;再次用TBST洗膜3次后进行ECL成像。使用Image lab软件进行各条带灰度值的半定量分析,以β-tubulin为参照,计算目的蛋白相对表达量。
(六)细胞上清液中VEGF-A浓度测定
利用ELISA测定卵巢癌细胞上清液中VEGF-A的浓度。步骤为:1.经NF90/shRNA-control(Control)或NF90-shRNA(shNF90)转染后的SKOV-3细胞用CoCl2缺氧诱导,收集细胞培养基后3000rpm离心20min后收集上清液。根据说明书按上样—孵育—洗板—加检测抗体—洗板—加酶标试剂—洗板—显色—终止—测定OD值。根据OD值计算各组细胞上清液中VEGF-A的浓度,设置浓度调平基准为pg/ml/2×106cell。
(七)统计学方法
服从正态分布的连续性变量以均数±标准差(mean±standa rd)表示。两组间均数比较行独立样本t检验(Unpaired Student’s t-tests),多组间均数行单因素方差分析(One-way ANOVA),以α=0.05为检验水准,符合方差齐性检验组,使用Bonferonni方法分析,不符合方差齐性检验者,使用Dunnett’s T3分析,SNK法行事后两两比较。p<0.05为有统计学差异。采用SPSS 23.0软件进行统计学分析,GraphPad Prism软件作图。
二、结果
(一)NF90在卵巢癌组织中表达升高
NF90在Oncomine数据库中分析NF90在卵巢癌中的表达情况,共纳入7个数据集,包含1043个临床样本,包括卵巢浆液性腺癌、卵巢透明细胞腺癌、卵巢子宫内膜样腺癌、卵巢粘液性腺癌和正常卵巢组织的比较。分析发现,NF90在多种卵巢组织中高表达(median rank=2541, P=0.005),分析发现卵巢浆液性腺癌中NF90表达最高(图1)。在TCGA数据中分析发现在卵巢浆液性现在中ILF3基因表达较正常卵巢组织显著升高(P=4.39E-9,fold change=1.870,图2A)。基于此,进一步检索Human protein atlas(www.proteinatlas.org)数据库发现ILF3蛋白在卵巢浆液性腺癌和内膜样腺癌中强阳性表达,在正常卵巢组织中阴性表达(图2B),与Oncomine数据库的分析结果一致。
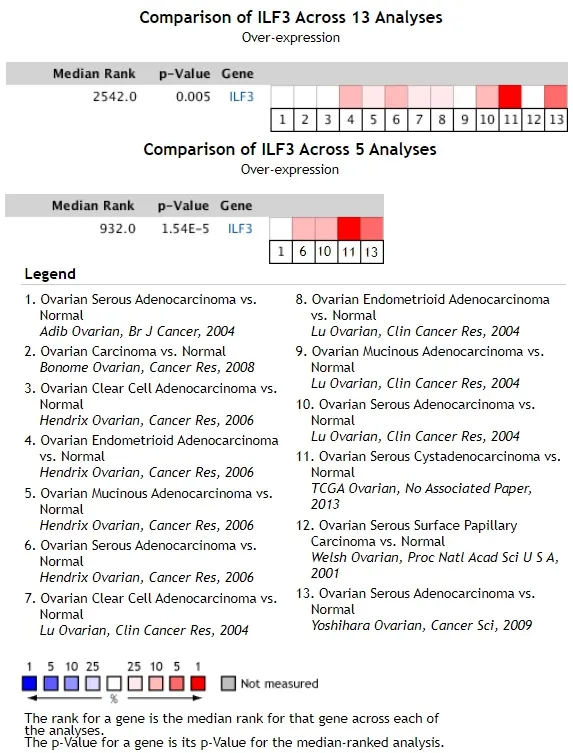
图1 Oncomine数据库中NF90在卵巢癌组织中的表达的meta分析Fig.1 The meta-analysis of the expression of NF90 in ovarian cancer in the Oncomine database
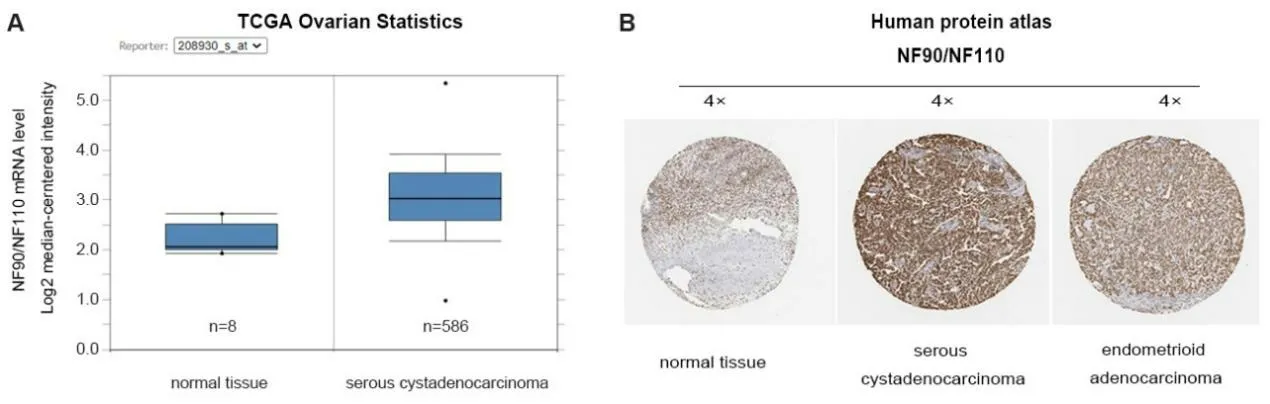
图2 NF90和NF110在卵巢癌组织中过表达Fig.2 NF90 and NF110 are upregulated in human ovarian cancer specimens
(二)缺氧环境下NF90与VEGF-A蛋白表达具有相关性
VEGF-A是血管生成的金标准之一,本研究采取VEGF-A蛋白表达作为血管生成的指标。SKOV-3细胞经饥饿处理后用CoCl2化学缺氧,发现SKOV-3细胞经CoCl2处理后HIF-1α、VEGF-A和NF90表达均升高,而NF110无明显变化(图3)。
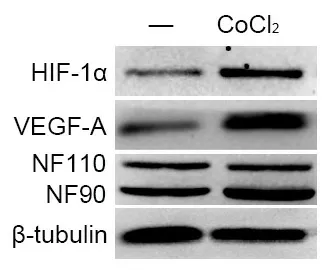
图3 缺氧条件下NF90、HIF-1α和VEGF-A表达情况Fig.3 The protein expression of NF90, HIF-1α, and VEGF-A after cultured with CoCl2.
(三)Western blot验证敲减NF90后HIF-1α和VEGF-A蛋白表达降低
将SKOV-3细胞经NF90/shRNA-control(Control)、NF90/shRNA(shNF90)转染后,经CoCl2缺氧刺激模拟细胞缺氧环境,提取蛋白,WB验证HIF-1α、VEGF-A、NF110、NF90蛋白表达情况,以β-tubulin蛋白作为内参。
CoCl2刺激后,SKOV-3细胞中HIF-1α、VEGF-A和NF90蛋白表达升高;Control组中HIF-1α、VEGF-A和NF90蛋白与未转染经CoCl2刺激组无明显差异;与Control组相比,shNF90组HIF-1α、VEGF-A和NF90蛋白表达明显降低。各组中NF110蛋白表达无明显变化(图4)。

图4 干扰/过表达NF90后HIF-1α和VEGF-A表达情况Fig.4 The protein expression of HIF-1α and VEGF-A after knockdown/overexpression of NF90.
(四)ELISA检测缺氧环境下SKOV-3细胞上清液中VEGF-A浓度
VEGF-A为分泌性蛋白,收集慢病毒转染、缺氧诱导下SKOV-3细胞的上清液,使用VEGF-A ELISA试剂盒测定各组上清液中VEGF-A的浓度,进一步验证NF90与VEGF-A表达的相关性。
CoCl2诱导缺氧环境下,SKOV-3细胞上清液中VEGF-A浓度是无缺氧下SKOV-3细胞上清液的2.334倍(1104.193±18.537pg/ml vs 471.331±37.697pg/ml,p<0.05)。与Control组细胞上清液相比,shNF90组细胞上清液中VEGF-A浓度降低了约57.6%(510.978±25.191pg/ml vs 1204.095±89.267pg/ml,p<0.05)。
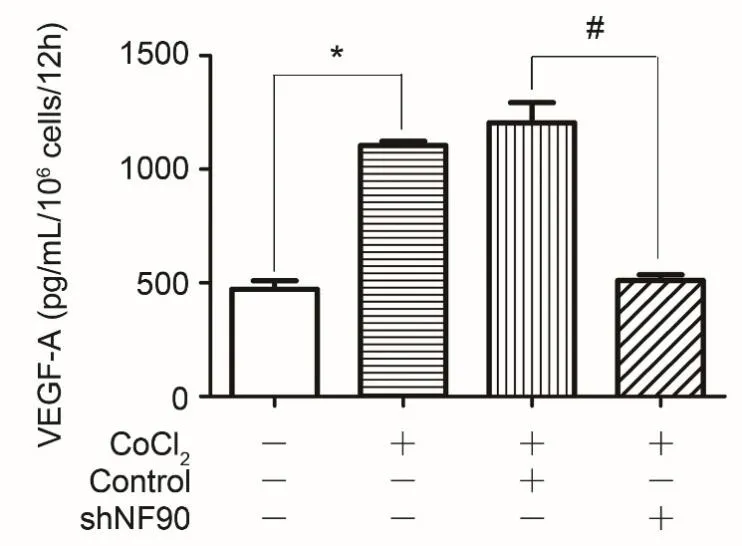
图5 干扰NF90引起SKOV-3细胞上清液中VEGF-A浓度下降Fig.5 Knockdown of NF90 decreases of the secretion of VEGF-A in CoCl2, *p <0.05, compared with SKOV-3 without CoCl2, #p<0.05, compared with Control group.
三、讨论
NF90和NF110具有不同的C-端和细胞内定位,NF110全部位于细胞核内,作用受到极大限制[11];而NF90一部分可与RNA相互作用定位于细胞核,另一部分通过与核糖核胞质接触位于细胞质,参与调控DNA代谢[12]、转录[13][14]、翻译[15][16]、mRNA稳定[7][17]以及多种病毒复制和基因表达[18][19][20]。NF90在多种恶性肿瘤的作用被广泛研究:在宫颈癌中通过p53/p21信号通路抑制宫颈癌细胞凋亡,促进肿瘤增殖[21],通过PI3K/Akt/HIF-1α/VEGF-A信号通路促进血管生成[8];在肝细胞癌中通过与cyclin E1 mRNA结合加速细胞周期促进细胞增殖[7];在乳腺癌中通过维持尿激酶型纤溶酶原激活剂(urokinase-type plasminogen activator,uPA)表达促进侵袭和转移[22],通过增强VEGF mRNA稳定性,促进血管生成[23]。然而,另有研究发现在NF90过表达抑制裸鼠卵巢癌模型细胞增殖,NF90/NF110通过控制嵌入在DICER前体mRNA中的miR-3173的加工促进DICER表达,而miR-3173的过表达以NF90和DICER依赖性方式显著增加转移,提出通过促进DICER表达,NF90可以作为卵巢癌的抑制因子[24]。
本研究应用Oncomine和Human Protein Atlas数据库发现NF90在卵巢癌,尤其是卵巢浆液性癌和内膜样腺癌中表达显著升高。体检实验构建卵巢癌细胞SKOV-3缺氧模型,进一步探讨NF90对卵巢癌血管生成的影响,结果显示,缺氧诱导NF90、HIF-1α和VEGF-A表达显著升高;干扰NF90后,SKOV-3细胞HIF-1α和VEGF-A蛋白表达显著降低,细胞上清液中VEGF-A浓度下降。
综上,NF90在卵巢癌组织中高表达,并通过诱导VEGF-A表达促进卵巢癌血管生成,但其作用机制仍需进一步研究,为以后多靶点抗血管生成治疗卵巢癌提供实验思路。
