n-3多不饱和脂肪酸对坏死性小肠结肠炎保护作用的机制研究
2021-09-14姚芳王晓睛李松霖郑梦如梁锦霞谢芳
姚芳,王晓睛,李松霖,郑梦如,梁锦霞,谢芳
坏死性小肠结肠炎(necrotizing enterocolitis, NEC) 是新生早产儿最常见的后天获得性肠道危重急症,其特征为肠黏膜甚至为肠深层的坏死。与NEC相关的总体死亡率约为20%~30%,其确切的发病机制仍不清楚[1]。目前研究认为NEC的发生主要与肠道发育不成熟、持续的肠道缺血、配方喂养及微生物定植等多种因素有关[2-3]。肠道屏障的通透性主要是由上皮细胞周围的紧密连接介导的,其功能破坏已被证明是肠道炎症发生的重要因素[4-5]。在NEC的小鼠及患儿手术标本中,跨膜紧密连接蛋白claudin-2表达明显升高,而occludin、 claudin-4 和claudin-7蛋白表达水平下降且分布发生内化,使肠道的通透性增加从而促进NEC的发生[6-8]。因此,能够逆转紧密连接蛋白和肠黏膜屏障功能的策略或干预措施对预防NEC至关重要。
多不饱和脂肪酸是指含有两个或两个以上双键且碳链长度为18~22个碳原子的直链脂肪酸,包括n-3和n-6多不饱和脂肪酸两类。n-3多不饱和脂肪酸主要包括亚麻酸(α-linolenic acid),EPA(eicosapen-taenoicacidacid)及DHA (docosahexaenoic acid),体内亚麻酸可部分转换为EPA和DHA,在妊娠期间该转换效率会升高[9]。这类多不饱和脂肪酸具有重要的生理功能,如促进胎儿及婴幼儿大脑生长发育、维持正常视力、抗血栓、抗肿瘤等方面[10-12]。近年大量研究还发现n-3多不饱和脂肪酸对保护肠黏膜屏障完整性发挥重要作用。在大鼠缺血性休克模型中,饲喂鱼油可明显缓解炎症反应,提高大鼠 Chiu′s 评分,保护肠黏膜绒毛及紧密连接完整性[13]。在IL-10敲除小鼠诱导的实验性结肠炎模型中,DHA通过恢复occludin和ZO-1表达及细胞膜的分布,维持正常的肠黏膜屏障功能,从而缓解结肠炎症状[14]。然而,n-3多不饱和脂肪酸是否在NEC发生发展中发挥重要作用尚不完全清楚。因此,本文主要探讨n-3多不饱和脂肪酸是否通过调节紧密连接蛋白的表达与分布修复损伤的肠黏膜屏障功能,从而缓解NEC的相关症状及降低疾病发生率,以期为临床防治NEC提供思路和潜在靶点。
1 材料和方法
1.1 实验动物和主要试剂
66只SPF级新生3 d的C57BL/6J乳鼠,体重1.92~2.86 g,购自广州中医药大学动物中心(动物许可证号:SCXK(粤)2013-0034);Similac Advance infant formula (Abbott Nutrition): Esbilac canine milk replacer, 2∶1;RIPA buffer(cell signaling technology货号:9806)、ZO-1 抗体(Santa cruz货号:9806)、claudin-4抗体(Santa cruz货号:sc-376643); claudin-7抗体(Abcam货号:ab27487);一步法逆转录试剂盒Maxima First Strand Synthesis Kit(Thermo Fisher scientific货号:K1671)、Mem-PERTM Plus Membrane Protein Extraction Kit(Thermo Fisher scientific货号:89842);SYBR Green PCR master mix(Thermo Fisher scientific货号:4309155),高糖DMEM、胎牛血清、细胞培养耗材购自康宁,DHA(Cayman Chemical货号:90310); IL-1 beta/IL-1F2 Quantikine ELISA Kit试剂盒(R&D Systems货号:RLB00); TNF-alpha Quantikine ELISA Kit(R&D Systems货号:RTA00)。
1.2 实验方法
1.2.1 动物模型的制备 将新生乳鼠随机分为3组(n=10):第一组为母乳喂养组(DF组),生后一直由母鼠进行喂养,不作其他处理;第二组为NEC组,利用缺氧冷刺激+人工喂养方式建立NEC模型;第三组为NEC+n-3多不饱和脂肪酸补充组(n-3组),在建立NEC模型的基础上,给予口服9 mL·kg-1·d-1鱼油进行n-3多不饱和脂肪酸补充。参考相应文献构建NEC模型[15],方法为:乳鼠生后第3天与母鼠分离,置于保育箱内,经口进行人工配方奶灌胃喂养。每次灌胃量为40 μL/g,每隔4 h灌胃一次,每天5次,一共4 d。在每天第二次与第四次灌胃后,将乳鼠放入缺氧箱内,以5 L/min流量充入95%氮气与5%氧气的混合气体,缺氧10 min,之后取出乳鼠。待乳鼠恢复后(约5 min),再将乳鼠放置于4 ℃冰箱中进行冷刺激10 min后放回保育箱。所有乳鼠在生后第7天处死,取肠道组织标本进行相关实验。
1.2.2 乳鼠一般情况观察 所有乳鼠每天上午在人工配方奶灌胃前进行体重测定,同时观察其呼吸、肤色的改变、有无明显的腹胀以及腹泻等临床症状,进行记录。
1.2.3 肠组织病理学形态观察及NEC评分 4%多聚甲醛PBS溶液固定小肠组织,脱水、透明、石蜡包埋、切片4 μm,行常规HE染色。参照相应文献[16]进行NEC病理评分标准:0分(正常),没有损伤;1分(轻度),黏膜下层和/或固有层轻微分离;2分(中度),黏膜下层和/或固有中度分离和/或黏膜下层和肌层水肿;3分(严重),黏膜下层和/或固有严重分离或黏膜下层和肌层严重水肿,同时伴有局部绒毛缺失;4分(坏死),绒毛缺失并且坏死。小鼠NEC发生的标准:组织学评分≥2分。
1.2.4 采用Werstern blotting(WB)方法和实时荧光定量PCR(qRT-QPCR)方法分别检测蛋白及基因的表达 将取材后乳鼠肠道组织或培养的CaCo2细胞在含蛋白酶抑制剂和磷酸酶抑制剂的RIPA缓冲液中匀浆,低温离心吸取上清液测蛋白浓度。 SDS-PAGE分离蛋白质,经转膜,孵育相应一抗、二抗,化学发光显影观察结果。提取乳鼠肠组织中总RNA,随之使用Maxima First Strand Synthesis Kit将1 μg总RNA逆转录合成cDNA。采用SYBR Green PCR master mix通过 罗氏LC480仪器进行定量PCR,扩增40个循环。使用的引物序列如下:ZO-1 forward: 5′-AGGACACCAAAGCATGTGAG-3′;ZO-1 reverse: 5′-GGCATTCCTGCTGGTTACA-3′;Claudin-4 forward: 5′-CGCTACTCTTGCCATTACG-3′; Claudin-4 reverse: 5′-ACTC-AGCACACCATGACTTG-3′;Claudin-7 forward: 5′-AGGGTCT-GCTCTGGTCCTT-3′;Claudin-7 reverse: 5′-GTACGCAGCTTT-GCTTTCA-3′。
1.2.5 CaCo2细胞系培养及模型构建 由于CaCo2细胞系是用于体外研究肠道上皮细胞紧密连接模型的常用细胞,因此我们用此细胞系建立NEC炎症模型。CaCo2购自上海细胞库,培养于含10%胎牛血清的高糖DMEM培养基中,2~3 d进行细胞换液或传代。体外NEC细胞模型采用LPS(5 μg/mL)进行诱导。DHA溶于DMSO中配置成合适的浓度(50 nM)保存于-80 ℃,后续利用培养基稀释成不同工作浓度对细胞进行处理。
1.2.6 细胞膜蛋白及浆蛋白分离提取 刮取细胞,300 g离心5 min,收集细胞,3 mL Cell Wash Solution重悬细胞,300 g离心5 min,弃上清,1.5 mL Cell Wash Solution重悬细胞,300 g离心5 min,弃上清,加0.75 mL Permeabilization Buffer于细胞沉淀,涡旋,4 ℃混匀10 min,16 000 g 离心15 min,收集上清(此为胞浆蛋白),沉淀加入0.5 mL Solubilization Buffer,重悬,4 ℃混匀30 min,4 ℃ 16 000g离心15 min,收集上清(此为可溶性的胞膜蛋白及膜相关蛋白)。利用WB方法检测样品中相关蛋白的表达水平。
1.3 统计学方法
2 结果
2.1 小鼠的一般状况及体重变化
进行NEC造模前,各组乳鼠的平均体重没有明显差异(P>0.05)。造模第2天后,NEC组出现明显的腹胀、腹泻及便血等消化道症状,此外还有呼吸急促、对外界的刺激反应迟钝,皮肤颜色变暗等症状的改变;而n-3组腹胀程度较轻,腹泻次数较少,便血程度相对较轻,消化道及其他症状均较NEC组好。造模完成后,NEC组乳鼠体重增长比对照组低(P<0.05),而n-3组与对照组相比没有明显差异(P>0.05)。此外,与对照组相比,NEC组乳鼠死亡较多,存活率仅为68.18%;而n-3组乳鼠死亡减少,存活率可达81.82%,明显高于NEC组,差异具有与统计学意义(P<0.05),见表1。
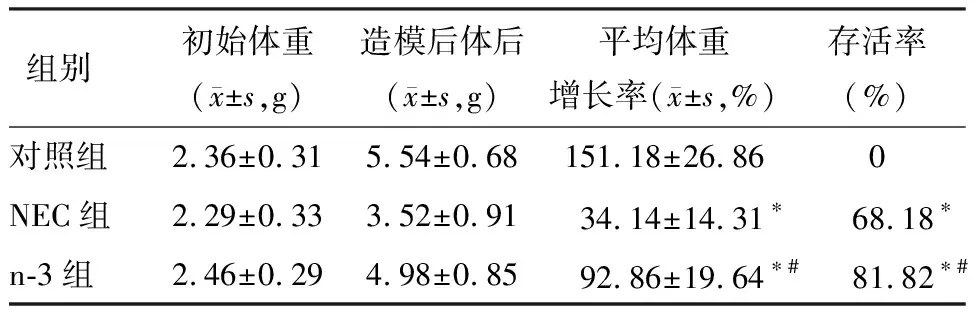
表1 乳鼠NEC造模前后的体重及存活率的变化
2.2 n-3多不饱和脂肪酸能明显减轻NEC的症状,降低NEC发生率
造模7 d后,取乳鼠全肠组织进行大体观察,可见对照组肠组织弹性良好,无明显充血及充气征;NEC组回肠部分则明显充血红肿,组织脆弱易断,肠腔内多见串珠样充气泡,肠内可见血样粪便;而n-3组乳鼠出现明显充血充气的现象较少,肠内未见明显的血样粪便(图1A)。光学显微镜下观察各组肠组织切片,对照组肠绒毛排列整齐,黏膜下层与固有层连接紧密,未见水肿或充血;NEC组肠绒毛大量脱落缺失,黏膜下层与固有层分离,并大量炎症细胞浸润及充血;n-3组肠绒毛完整性尚可,可见黏膜下层与固有层略有水肿,有炎症细胞浸润但未见明显的充血症状(图1B)。经统计提示,n-3组的组织学评分明显低于NEC组(P<0.05)(图1C)。另外,肠组织匀浆后取上清进行ELISA检测也发现,n-3组炎症IL-1β及TNF-α的表达水平较NEC组低(P<0.05)(图2)。
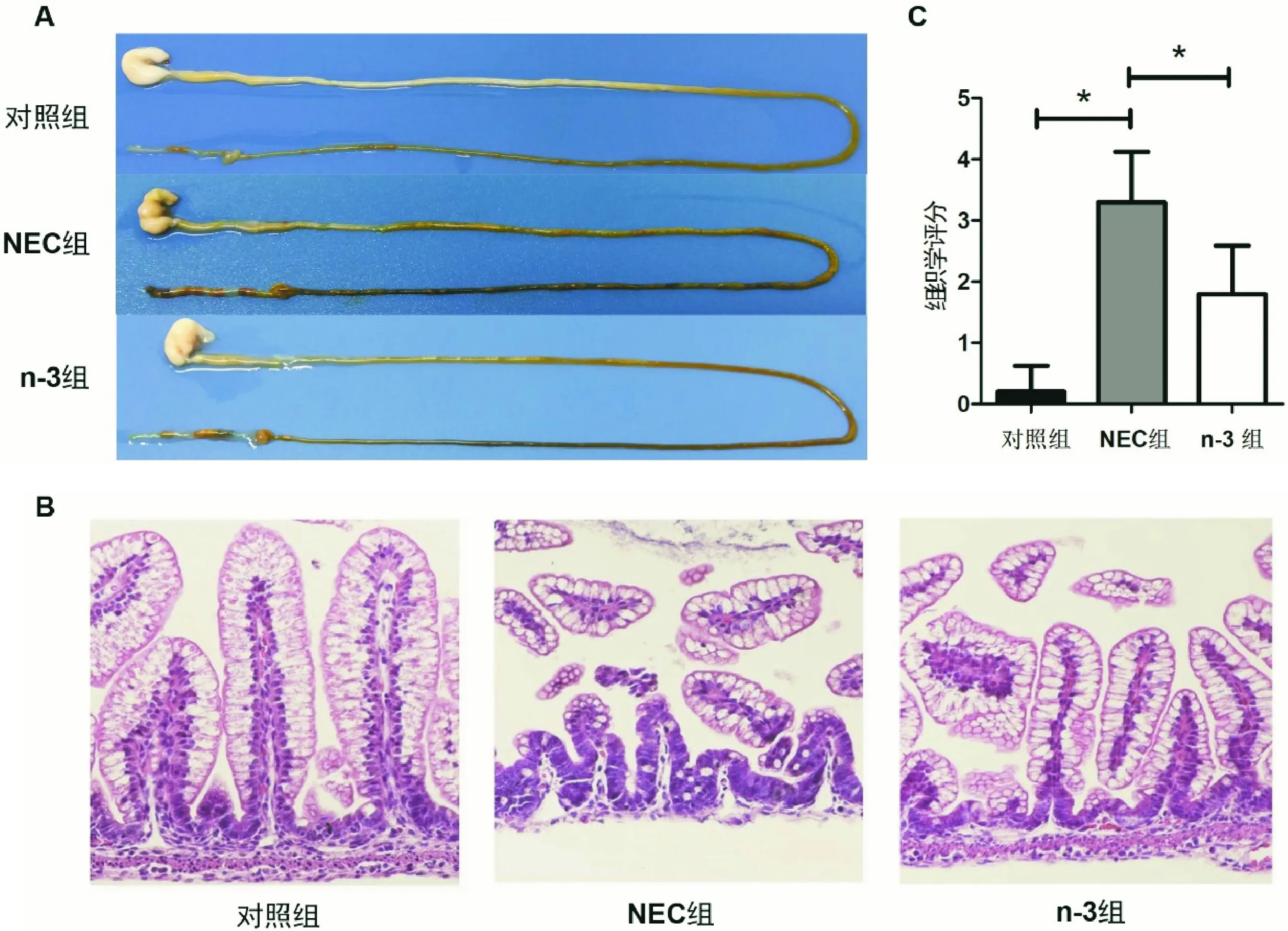
图1 乳鼠肠组织大体图 A:对照组肠道光滑,无明显充血及充气征;NEC组肠道尤其是回肠部分明显充血红肿,肠腔内多见串珠样充气泡;n-3处理组肠道充血及充气程度均较NEC组轻;B:肠组织经HE染色观察发现,NEC组肠绒毛脱落缺失,黏膜层严重水肿,n-3处理组肠绒毛相对完整,黏膜层水肿不明显;C:组织学评分提示,n-3组明显低于NEC组(*表示P<0.05)
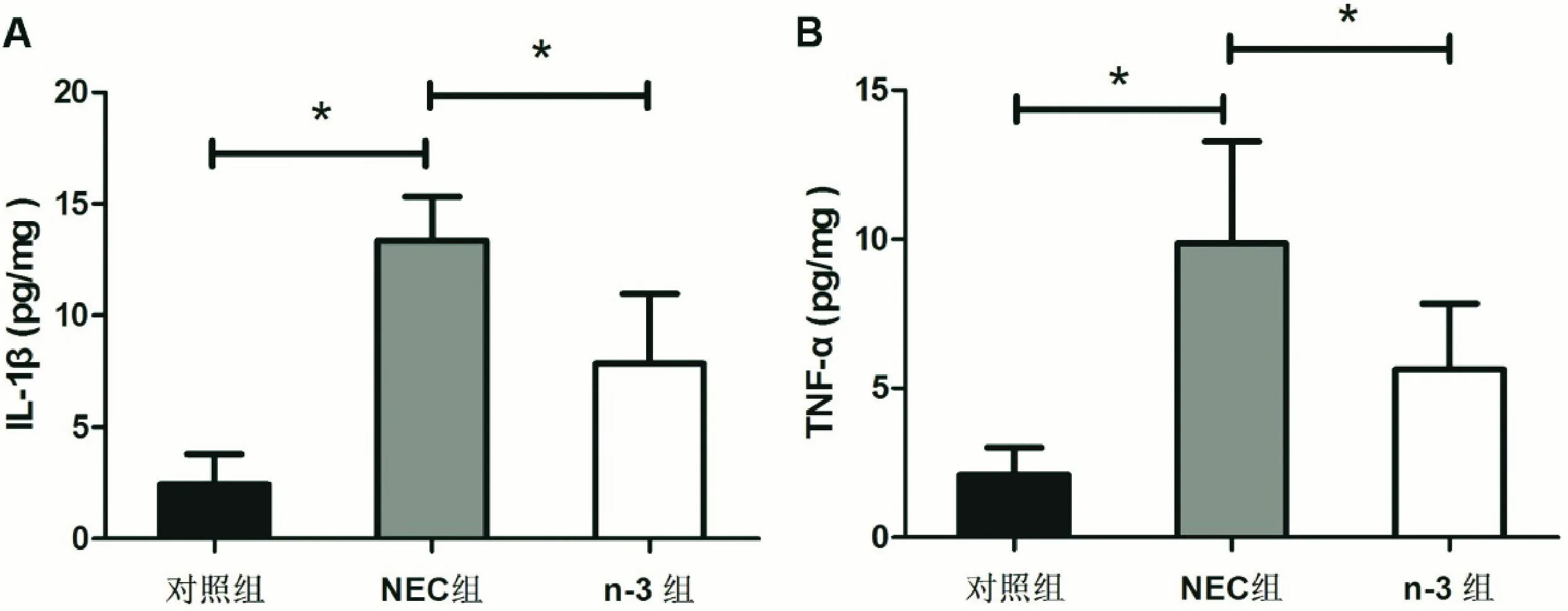
图2 EILSA方法检测IL-1β及TNF-α炎症因子表达水平 A:与对照组相比,NEC组的肠组织匀浆上清IL-1β表达水平明显增高,而n-3处理组的IL-1β表达比NEC组明显降低;B:与对照组相比,NEC组的肠组织匀浆上清TNF-α表达水平明显增高,n-3处理组TNF-α表达比NEC组明显降低(*表示P<0.05)
2.3 n-3多不饱和脂肪酸能上调紧密连接相关蛋白和基因的表达
利用蛋白裂解液提取肠组织蛋白后,我们检测了各组肠组织中紧密连接相关蛋白的表达水平。结果显示NEC组的肠组织ZO-1、claudin-4、claudin-7的表达水平较对照组明显下降,而n-3组则有一定程度的恢复(图3A-B)。此外,实时荧光定量PCR结果也提示n-3组的ZO-1、claudin-4、claudin-7基因表达水平较NEC组明显上升(图3C-E)。
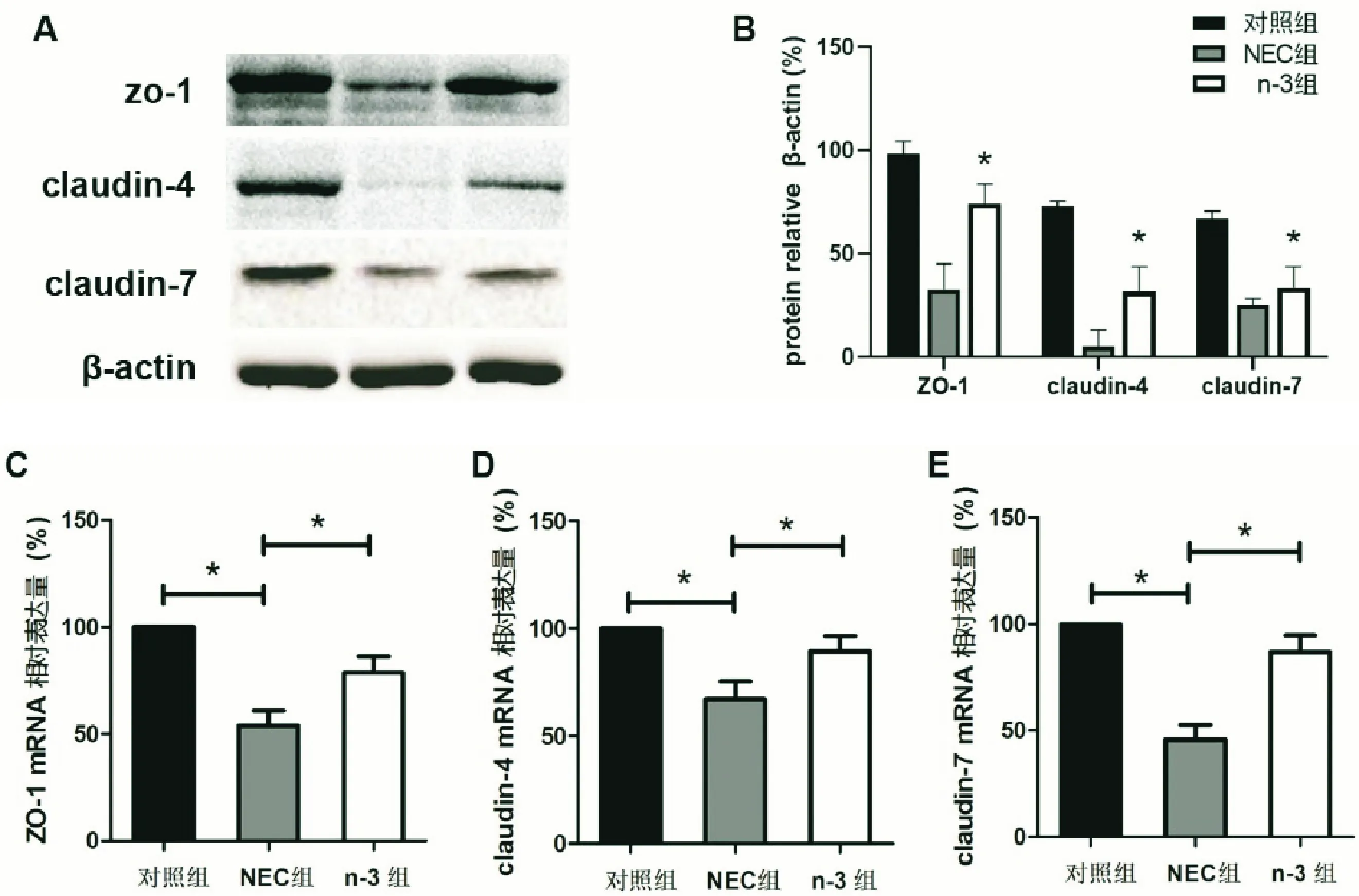
图3 检测肠组织紧密连接蛋白表达水平 A:WB结果显示n-3组ZO-1、claudin-4和claudin-7表达较NEC组明显上升;B:WB结果灰度值分析;(C-E)实时荧光定量PCR提示n-3处理组ZO-1、claudin-4、claudin-7的mRNA转录水平较NEC组明显上调(*表示P<0.05)
2.4 在炎症模型的CaCo2细胞中,DHA能提高紧密连接相关蛋白的表达水平和维持细胞紧密连接的稳定性
我们在体外模拟炎症环境,利用LPS(5 μg/mL)和不同浓度的DHA来处理CaCo2细胞,发现在LPS诱导下,ZO-1、claudin-4、claudin-7蛋白的表达下调,而DHA可逆转该趋势,且呈浓度依赖效应(图4A)。此外,运用膜蛋白分离提取试剂盒,分别抽提胞膜蛋白及胞浆蛋白进行检测,结果显示仅在LPS诱导下ZO-1、claudin-4及claudin-7既分布于细胞膜也分布于细胞浆,并且在胞浆中的含量更高;而当给予DHA处理后,ZO-1、claudin-4和claudin-7细胞膜中的含量则明显上升(图4B)。
3 讨论
NEC是导致早产儿胃肠道疾病死亡的主要原因。尽管各界医疗工作者和学术研究者几十年来对NEC疾病的诊治研究付出了巨大的努力, NEC的发生率及相关的死亡率并没有大幅降低,并且还随着超低及极低体重早产儿出生存活率的提高有进一步升高的趋势[17]。NEC发病机制目前仍不完全清楚,这也是临床缺乏有效治疗手段的重要原因。临床研究[18-19]提示,补充长链多不饱和脂肪酸可能对体重约1 000~1 500 g或低胎龄≤32周早产儿NEC的发生有预防作用,但其作用机制仍不明确。本研究通过构建乳鼠NEC模型,发现补充了富含n-3多不饱和脂肪酸的鱼油的乳鼠NEC发生率及严重程度均有所下降,提示n-3多不饱和脂肪酸一定程度上能抑制NEC的发生发展。
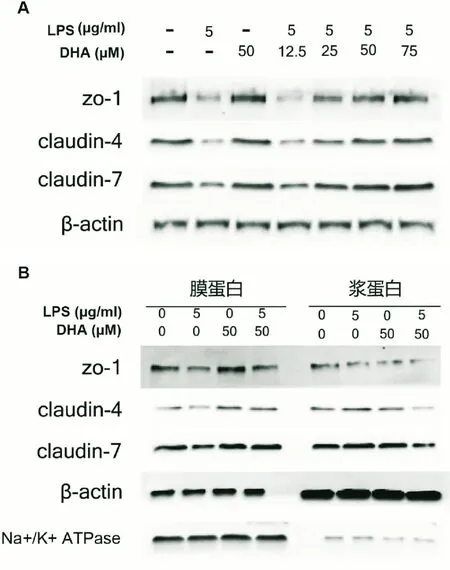
图4 CaCo2细胞紧密连接蛋白表达情况 A:WB结果显示LPS刺激细胞后使ZO-1、claudin-4、claudin-7蛋白表达明显降低,而同时加入DHA处理后,ZO-1、claudin-4、claudin-7蛋白表达上调,且呈浓度依赖性;B:LPS单独刺激时ZO-1、claudin-4和claudin-7既分布于胞膜中也分布于胞浆中,而LPS处理后再给予DHA处理,ZO-1、claudin-4和claudin-7胞膜中的含量明显上升
肠黏膜屏障不仅决定于黏液被,更取决于肠上皮细胞通过细胞连接构成的物理性屏障,紧密连接则是最主要的决定肠上皮通透性的因素[20]。紧密连接由3种类型的紧密连接蛋白构成,包括跨膜蛋白、支架蛋白及调节蛋白。在跨膜紧密连接蛋白中,四次跨膜蛋白claudin家族是其中最重要的一类,包括claudin 1、claudin 2、claudin3等;ZO家族蛋白属于支架蛋白,具有多个结构域,可直接与跨膜紧密连接蛋白如claudins及紧密连接相关蛋白家族TAMP如occludin,相互结合;而紧密连接的调节蛋白目前报道较少[21-22]。有研究表明EPA可通过上调紧密连接蛋白occludin和ZO-1表达水平,维持肠上皮正常通透性[23-24]。在本研究中我们检测了紧密连接相关蛋白的表达,结果显示n-3多不饱和脂肪酸可以促进肠组织ZO-1、claudin-4和claudin-7蛋白的表达,进一步提示n-3多不饱和脂肪酸可能是通过维持肠上皮细胞紧密连接起到抑制NEC发生发展的作用。
为进一步阐释n-3多不饱和脂肪酸对紧密连接蛋白的影响,我们采用研究肠道上皮细胞紧密连接的常用细胞系CaCo2细胞建立NEC炎症模型,验证n-3多不饱和脂肪酸DHA的作用。通过WB方法检测发现LPS刺激细胞后能明显降低细胞中ZO-1、claudin-4和claudin-7蛋白的表达水平,而DHA能抑制LPS对紧密蛋白表达的降低作用。此外,有研究报道紧密连接蛋白的表达分布改变也会破坏肠道屏障功能,引起肠黏膜通透性增加[25]。本研究采用膜蛋白分离提取试剂盒分别提取细胞膜蛋白与细胞浆蛋白,通过检测ZO-1、claudin-4和claudin-7的表达分布证实,DHA能促进蛋白从细胞浆向细胞膜更多分布,从而增强LPS诱导下细胞的紧密连接。
综上所述,我们通过体内外实验验证了n-3多不饱和脂肪酸能够上调紧密连接蛋白表达、改善其分布,以维持肠上皮细胞紧密连接的稳定性从而抑制NEC的发生发展。本研究揭示了n-3多不饱和脂肪酸在NEC中的作用,提示临床上具有NEC发生高风险的早产儿可以考虑通过增加n-3多不饱和脂肪酸的摄入预防NEC的发生或降低NEC的严重程度。
