结直肠腺瘤内镜下摘除后再发的危险因素分析
2021-09-14孙玉文武向谦严丽桃蒋志凌陈霞
孙玉, 文武,向谦, 严丽桃, 蒋志凌, 陈霞
结直肠癌(colorectal cancer, CRC)是常见的消化道恶性肿瘤,近年发病率总体呈现上升趋势,已成为我国消化系统发病率第2位,患病率第1位的恶性肿瘤[1]。结直肠良性腺瘤(colorectal adenoma, CRA)癌变占CRC发生途径的85%~90%[2-3]。内镜下摘除CRA可以预防75%的CRC,已成为CRC早期防治共识[4-5]。然而,即使接受内镜下治疗后,部分患者CRA再发率仍较高。根据不同随访周期、复发定义、术后监测频率,文献报道内镜下息肉摘除后再发率在0.5%~22%不等[6-7],甚至有研究显示CRA摘除术后1年再发率可达到59.46%[8]。随着内镜下微创治疗的开展,如何科学地监测CRA的再发就显得尤为重要。为此,我们回顾性分析内镜下摘除CRA后再发的危险因素,为内镜治疗后监控策略的选择提供更多依据。
1 资料与方法
1.1 一般资料
本研究经我院医学伦理委员会批准,回顾性选取2017年1月至2018年12月我院初次接受内镜下CRA摘除治疗患者,所有患者治疗前签署手术知情同意书,研究符合2013年修订的《赫尔辛基宣言》要求。对CRA定义和内镜下干预指征符合《中国结直肠癌预防共识意见》[9],内镜下诊治符合《中国早期结直肠癌筛查流程专家共识意见》中关于结直肠癌筛查的质量控制标准[5]。
1.2 纳入、排除标准
1.2.1 纳入标准 ①接受内镜下CRA摘除治疗的患者;②年龄40~74岁;③摘除后息肉病理结果符合腺瘤;④患者首次内镜后(12±1)月完成全结直肠镜复查。
1.2.2 排除标准 ①病理或临床高度提示恶性肿瘤,追加外科手术治疗患者;②肠道准备欠佳或其他原因,未能完成全结肠镜检查者;③伴随有其他如炎症性肠病、肠结核等可能影响结果判断疾病;④长期服用叶酸、阿司匹林等药物,可能对CRA再发判断产生影响者;⑤临床资料不全或缺失者。
1.3 随访管理
患者息肉摘除后常规给予高膳食纤维饮食、减少红肉和加工肉类摄入、戒烟、戒酒、控制体重等健康指导[9]。在首次内镜下息肉摘除后(12±1)月完成全结直肠镜复查。
1.4 资料采集
提取病例资料时由课题组两位高年资医师共同完成,采集纳入患者年龄、性别、体重指数(body mass index,BMI)、CRA或结直肠癌家族史、是否吸烟、是否长期饮酒、初次内镜下CRA摘除数量、部位、形态、最大息肉横径、病理类型,复查结直肠镜是否存在CRA再发、再发部位、再发数量、再发最大横径和病理类型。采集记录内镜下息肉摘除后(12±1)月复结直肠镜查全CRA再发情况及再发部位、数量、最大横径和病理类型。
1.5 统计方法
2 结果
2.1 再发情况
最终纳入220患者进行分析,其中男性132例,女性88例。(12±1)月内镜复查发现CRA者(再发)47例(21.36%),未检出以CRA者(未再发)173例(78.64%)。
2.2 CRA再发的单因素分析
CRA再发组与未再发组性别、BMI、CRA/CRC家族史、吸烟史、饮酒史、息肉数量、病理类型的差异均具有统计学意义,其中CRA再发组患者男性占比、BMI、家族史者占比、吸烟饮酒者占比、多发息肉占比均显著高于CRA未再发组;病理分化中绒毛状腺瘤、混合腺瘤的占比高于CRA未再发组,差异均具有统计学意义。两组患者年龄、最大息肉直径、息肉部位、息肉形态的差异均无统计学意义,见表1。
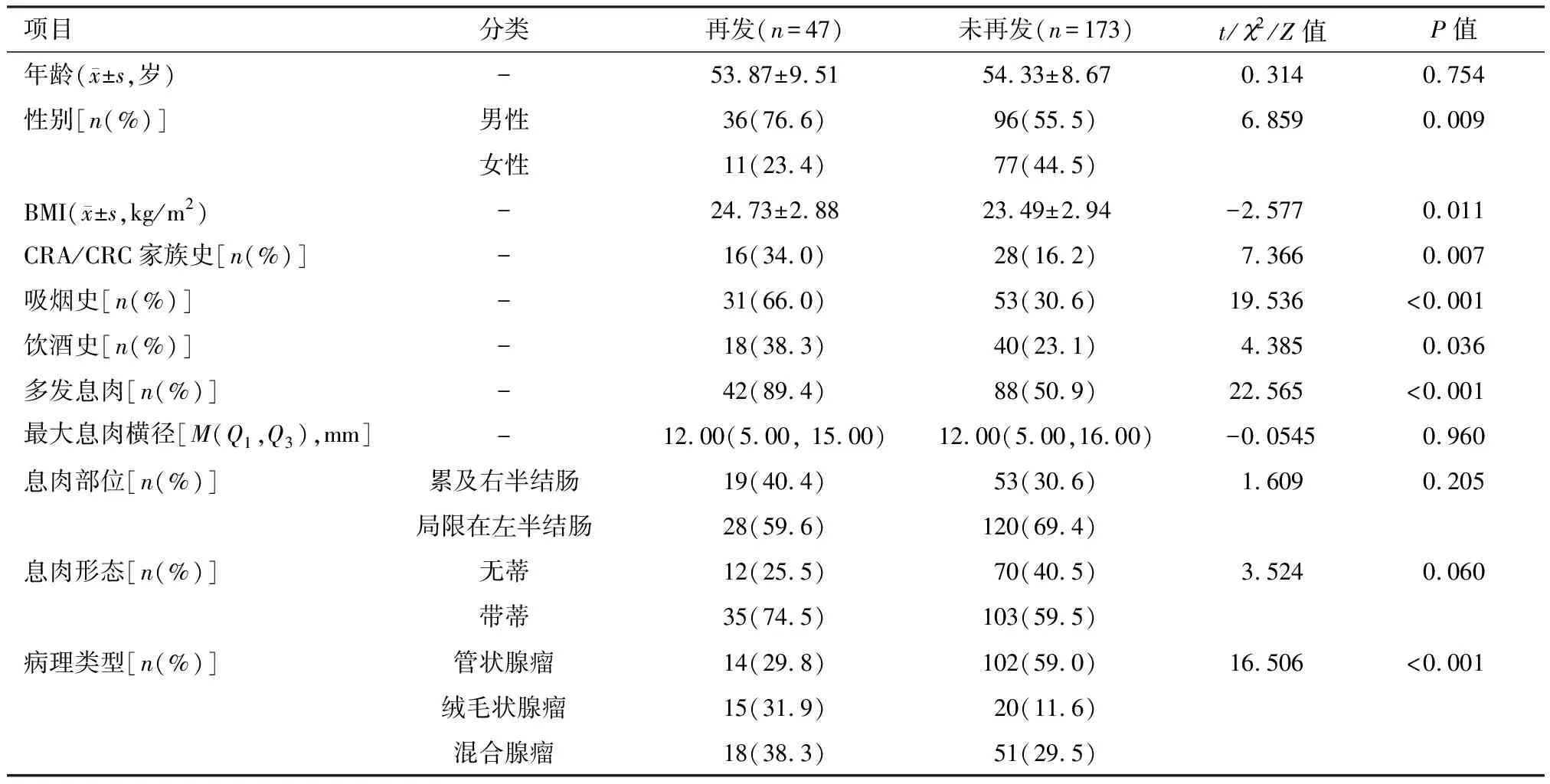
表1 再发与未再发组特征的单因素分析
2.3 CRA再发的多因素分析
将上述单因素有意义的变量(组间比较P<0.05)纳入多因素Logistic回归模型,模型中变量的进入方式为“wald向前法”。结果显示CRA家族史(OR=3.722)、吸烟史(OR=3.120)、多发息肉(OR=8.173)、绒毛状腺瘤(OR=3.387)是CRA初次内镜干预后12个月再发的独立危险因素,见表2。

表2 CRA再发多因素logistic回归模型
3 讨论
从CRA到浸润型CRC平均需要经历10~15年的时间,这使前期有效的医学干预成为了可能。然而,内镜下摘除作为CRC一级微创预防措施,最终效果受CRA再发的影响。研究报道[10-12]CRA的发生可能与性别、饮食、息肉数目、大小、病理类型及是否合并代谢性疾病等诸多因素相关,其中与摘除后再发的确切原因尚不完全明确。
本研究遵从相对严格纳入排除标准,两组患者初次接受治疗时年龄、最大息肉横径、息肉部位、息肉形态方面等基线情况在接受治疗前具有可比性。通过回顾性的分析,220例接受内镜下摘除患者在治疗后12个月CRA再检出率为21.36%,略低于部分文献报道[13],这可能与患者在首次接受内镜下治疗时严格接受内镜下治疗质量控制以及相对较短的随访时间有关。所再发息肉较首次治疗相比,特点包括:单发、更小、无蒂,也并未发现侵袭性CRA,这可以从接受治疗后再发息肉生长时间较短方面得到解释,也从侧面印证了内镜下治疗质量控制的可靠性。针对首次接受内镜下息肉摘除的患者,若能够按照CRA再发的风险进行分层管理,更有利于临床工作者制定腺瘤术后个体化随访方案,合理减少频繁肠镜对患者带来的不便及痛苦,节省医疗资源,提高患者随访依从性。
在危险因素进行分析时,除纳入年龄、性别、家族史、BMI、息肉数量、大小、病理类型等较为被认可与CRA发生相关因素以外,因发生左右半结肠CRA的分子机制并非完全一致[2],我们还加入了息肉部位、形态的指标。从我们的研究可以看到,男性、BMI>23 kg/m2、CRA或CRC家族史、吸烟、长期饮酒、初次内镜提示多发息肉、CRA病理类型为绒毛状或混合腺瘤与初次内镜干预12个月后的CRA再发相关。然而男性患者往往存在吸烟、饮酒等不良生活方式更多,饮酒人群出现BMI超标也往往更多。进入多因素分析后,显示内镜摘除12月后CRA再发的独立危险因子包括:具有CRA/CRC家族史 (OR=3.722)、吸烟或吸烟史 (OR=3.120)、肠道多发息肉 (OR=8.173)、病理类型为绒毛状腺瘤(OR=3.387)四项。其中,CRA/CRC家族史作为再发独立危险因素可能与常染色体显性遗传相关,也与既往文献报道基本一致[14-15]。烟草中含多种环芳羟基类和亚硝胺致癌物质,直接导致肠黏膜损伤,导致结肠息肉形成;也可以通过过氧化使DNA的编码错误,诱导APC和KARS基因突变,或促进异常DNA分子甲基化,上述基因均与CRA发生及进一步进展为CRC有密切关系[16-18]。此外,CRA的数量、病理类型在腺瘤复发过程中发挥重要作用[19-21]。多个CRA的数量表明从遗传表型以及肠道微生态具备息肉的生长的条件[22-23]。结肠息肉绒毛组织恶性程度高,组织细胞裂解及生长速度更快,故含绒毛管状腺瘤或绒毛状腺瘤患者复发率更高[24-25]。研究中最大横径并未成为CRA治疗再发的危险因素,这与前人研究结果并不一致14],可能与所选择不同内镜复查时间(12月vs36月)有关,相比而言,我们在12个月节点的复查并未发现存在侵袭性CRA。因此,我们更倾向于推荐有CRA/CRC家族史、吸烟或吸烟史、肠道多发息肉、病理类型为绒毛状腺瘤患者在接受首次治疗12个月完成结直肠镜复查。
本研究也存在一些不足,研究为回顾性分析,可能存在初次息肉“漏检”,也未能避免术后12月内生活干预实际效果如饮食结构、运动量对CRA再发的影响,然而考虑到研究所涉及患者年龄、性别、生活方式、息肉数量、部位、大小、形态以及病理类型等多维度数据,在内镜质控标准下筛选出与治疗后再发的独立危险因素,对临床实践仍具有一定现实指导意义。
综上,接受内镜下摘除的CRA患者存在一定再发几率,CRA/CRC家族史、吸烟、多发息肉、病理类型为绒毛状腺瘤是接受治疗12个月CRA再发的独立危险因素。按照再发的风险进行分层管理,更有利于临床工作者制定患者个体化随访方案,合理减少肠镜检查频率,节省医疗资源,提高患者随访依从性。
