船舶压载水快速检测方法的研究进展
2021-09-13李超张燊
李超 张燊


摘要:船舶压载水引发的生物入侵问题日益严重。通过对浮游生物典型检测方法的分析,对比了不同压载水检测方法的技术特点。基于不同使用环境下压载水检测要求,阐述了不同环境因素下选择压载水检测形式的方法和原则。结合目前船舶压载水检测的形势和需求,展望了压载水检测方法的发展趋势。建议今后实践应用中需要根据压载水类型和处理要求灵活选择检测手段,尤其是以数字全息技术为代表的原位检测技术具有广阔的发展前景。
关键词:压载水;浮游生物;快速检测;数字全息
中图分类号:X55 文献标志码:A
文章编号:1006-1037(2021)03-0009-05
压载水(Ballast Water)是指船舶在航行过程中为控制船舶横倾、纵倾、吃水、稳性或应力而加装到船上的水及悬浮物质。船舶压载水中含有大量生物体,包括浮游植物、浮游动物、海洋细菌、噬菌体等。这些生物被吸入压载舱后相当于处在一个封闭状态下的生态系统中,大部分因为无法适应温度、盐度等因素的变化和压载水处理系统的胁迫而死亡,但有的仍然能够生存下来。这一部分经过驯化并存活的生物往往具有极强的生命力和竞争力,一旦排放到适宜的环境中,就可能发生不可控制的“雪崩式”繁殖,引起生物入侵[1-4]。据国际海事组织(International Maritime Organization,IMO)资料,每年约有10亿吨船舶压载水被搬运,每天可有3 000多种动植物随压载水被运到世界各地不同海域,这导致全球多个港口时刻面临生物入侵的威胁。而且压载水中的生物不像其他污染物可被清除或吸收,一旦入侵和落户当地水域,几乎无法消除,带来巨大的生态灾难。避免船舶压载水排放所带来的生物入侵问题,关键在预防,重点是压载水的处理和检测,压载水排放前的检测更是重中之重。目前压载水检测方法多种多样,各有侧重,各个港口国负责压载水检测的部门和人员往往不具备专业的生物学知识,很难根据实际情况选择合适的压载水检测方法。本文基于现有的压载水排放、检测要求,对比分析通用的检测方法,筛选出先进可靠的压载水检测技术,为操作人员选择合适的压载水检测方法并防止生物入侵提供参考依据。
1 《压载水公约》对压载水排放和检测的要求
为防止船舶压载水中水生物的扩散对海洋环境造成毁灭性打击,国际海事组织(IMO)于2004年召开的国际船舶压载水管理大会通过了《国际船舶压载水和沉积物控制与管理公约》(以下简称《压载水公约》),该公约已于2017年9月8日正式生效。公約规定,压载水管理的标准有两种:D-1标准(压载水交换标准)和D-2标准(压载水处理性能标准)。D-1标准要求船舶在深海用3倍压载水舱室容积的水对原有压载水进行置换,因为深海中的水即使携带某些水生生物,被排到接收港水域后,水生生物一般因生存条件的差异而不易存活,从而降低或者避免了通过压载水引入外来有害生物的风险。D-2标准具体规定了处理过的压载水的排放标准,如表1所示。由于压载水的取样和分析技术性极强且分析指标要求高,IMO没有对压载水的浮游生物检测方法进行明确规定。目前虽有成熟的商品化海洋生物定量分析仪器,但均存在应用局限,如占用空间庞大,测试耗时长,需专业人员操作,无法辨识细胞死活等[5-6]。
2 压载水中浮游生物典型检测方法的比较
压载水中生物体的快速识别、计数和死活判别,一直是海洋科技工作者努力的目标。传统的海洋浮游生物检测手段,如显微镜计数法既费时、费力且专业性要求较高,在实际监测中已很少使用[7]。近年来,出现了一些较为先进的压载水检测方法,根据其原理,可分为染色法、荧光特性检测法、流式细胞法、光学成像检测法等。
(1) 染色法。根据染色剂的类型可分为化学染色法和荧光染色法,都是利用染色剂对细胞不同部位的亲和性差异,达到标记细胞的目的。化学染色法最常用的染色剂是台盼蓝和中性红,能够穿过受损的细胞膜进入细胞,而对于正常的细胞则无法穿透,从而实现对活细胞和死细胞的区分[8-9]。荧光染色法常用的染色剂有FDA(双醋酸荧光素)和PI(碘化丙锭)[10]。FDA本身不发荧光,但该染料可被活细胞中的非特异性酯酶分解产生荧光物质,从而使细胞发荧光。死亡细胞或活性较差的细胞中由于非特异性酯酶活性差,因此无荧光或荧光较暗[11]。PI则与细胞内DNA和RNA物质相作用生成红色荧光物,使死亡细胞发出红色荧光[12]。借助两种荧光染色剂的配合使用还可以实现细胞不同死亡类型和死亡阶段的区分[13]。相比传统的化学染色法,荧光染色法的灵敏度更高,但鉴别过程依旧需要借助荧光显微镜,单次仅能检测微量样品,难以实现高通量。染色法过程中操作不当还容易导致假阳性或假阴性,准确度较低。无论是化学染色法还是荧光染色法,都需要配合显微镜进行计数,而且染色过程需要一定的反应时间,在压载水快速检测中并不具备明显优势。
(2) 荧光特性检测法。海水中的生物体绝大多数是浮游植物,叶绿素a广泛存在于浮游植物细胞中而且具有特殊的吸收光谱。通过对叶绿素a的测量可以得知浮游植物细胞的丰度。叶绿素a浓度的测定有多种方法,其中常用的有分光光度法、荧光光谱法、高效液相色谱法(HPLC)和吸收光谱法等。这一类方法灵敏度较低,而且测得的结果只是叶绿素a的含量,有研究表明叶绿素a在藻类死亡两周后仍能检测到[14],也就是说叶绿素a含量并不能和活体藻细胞的浓度准确对应,无法和《压载水公约》进行直接对比。
(3) 流式细胞法。流式细胞术(Flow cytometry,FCM)出现于20世纪70年代,是一种集流体驱动原理、激光测量技术和计算机分析于一体的技术,能够实现对单个生物细胞的定量分析和分选,精确分析细胞的大小、形态、叶绿素含量和内容物等参数。流式细胞仪,是一种比较成熟的检测手段,已广泛应用在生物、医学和环境检测等诸多领域[15-17]。近年来,该技术更是和微流控技术相结合,改良进样方式,增强了可操作性[18]。但在压载水检测应用中测仍存在局限。《压载水公约》要求的存活水生物浓度很低,需要检测数升水样才能确保测量结果的准确性,而流式细胞仪的进样量一般在微升量级,无法直接用其检测压载水,需要配合浓缩手段,这就增加了时间成本。
(4) 分子生物学方法。利用分子生物学手段,如PCR技术、细胞杂交技术、酶联免疫吸附分析技术等,来实现海洋浮游生物的精确检测[19]。优势在于能够准确检测出特定种类的生物遗传信息,对《压载水公约》规定的三种指示病原微生物(产毒霍乱弧菌、大肠杆菌、肠球菌)的检出应用效果良好。但对实验条件要求高,反应速度慢,目前还停留在实验室检测阶段,短期内难以实现现场检测。
(5) 光学成像法。利用水下成像系统对浮游生物进行直接的图像记录是观测海洋浮游生物最直观的方法,需要配合图像处理算法,根据藻细胞的大小、形态和运动特征等信息,达到对微藻的识别和分类的目的。这类方法要想在压载水检测中发挥良好效用需要满足两个条件:分辨率要够高,图像处理算法要足够智能。《压载水公约》中不仅规定了微米级生物的含量,而且要求指示生物的含量也要达标,产毒霍乱弧菌、大肠杆菌、肠球菌的直径均在亚微米级。现有的浮游生物扫描系统,如Zoo Scan只适用于研究200 μm以上的浮游动物[20-21],并不适用于压载水的检测。单张图像往往包含了众多种类的浮游生物,如何在无人为干预的情况下将它们准确区分和计数,是光学成像法亟待解决的问题。另外,如果算法不够智能,则又会落入传统显微镜检查的窠臼。
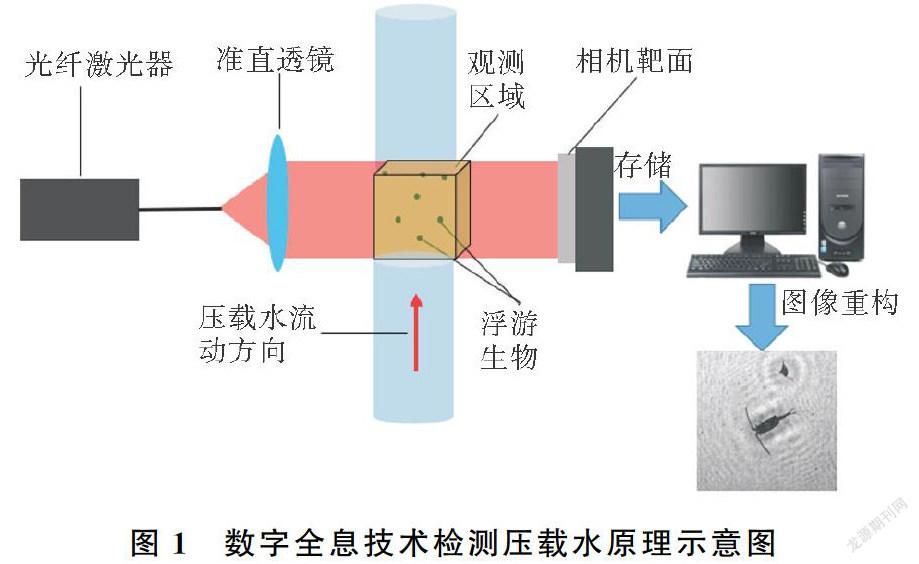
光学成像法中最具发展前景的是数字全息技术(Digital Holography),这是一种两步成像法:波前记录和波前再现[22]。一束波长已知的参考光照射到目标物,产生衍射光波,衍射光波与未被衍射的参考光相互叠加干涉,产生包含物光波波前相位和振幅的干涉图样,再将这些干涉图像通过电子成像器件存储在计算机中,这是波前记录过程。用计算机模拟衍射过程,还原被测物体的物光波前,得到符合人眼视觉的三维影像,这一过程叫做波前再现(见图1)。数字全息技术可同时获得物光场的振幅和相位信息,能够在非接触无标记的情况下对活体细胞进行真三维定量观测,获得细胞的三维形貌[22]。目前,数字全息显微的分辨率已经达到几微米甚至亚微米量级,完全可以满足大多数浮游生物的观测需求[23]。另外,通过对全息图的相位分析,可以获得光在经过藻细胞之后的相移信息。由于相移是由细胞内不同组分及细胞外组织液的细微折射率变化引起的,藻细胞死亡后胞内物质外泄,活细胞和死细胞的相移信息具有明顯差别[24-25]。基于上述原理,数字全息技术还能够精确判别藻细胞的活性[26-27]。这一点和《压载水公约》防止生物入侵的初衷刚好契合。近年来,数字全息技术发展迅速,随着深度学习等智能图像识别算法的不断优化,对部分藻类的识别准确率已经能够达到90%以上[28-29]。但这种方法运算量大,对图像的质量有很高的要求,因此还需要不断优化图像处理和智能识别算法。
除上述几个具有代表性的检测方法外,还有培养计数法等传统方法。《压载水公约》还规定,港口国在对船舶压载水进行取样和分析的过程中不得造成船舶的不当延误,一旦因极特殊原因造成船舶延误,将导致巨大的经济损失[30]。这就对船舶压载水检测方法的时效性提出了更高的要求,响应时间也成为了一个必须要考虑的因素。典型压载水检测方法的优缺点和响应时间如表2所示[31-35]。
从表2所列压载水检测手段对比可以看出,现有的压载水检测方法原理不一,各有侧重点。在实际检测中,需要根据船舶配备的压载水处理系统类型、航行轨迹、航行时间、航行日志、港口水文状况和容许检测时间等因素有的放矢地选择一种或几种进行检测,才能最大程度降低生物入侵风险同时避免人力物力的浪费。如在赤潮多发海域,需要重点检测压载水中是否含有本地高发的赤潮藻种,采用流式细胞法更加快速准确;在养殖业发达的海域,需要重点监测对海水养殖有害的生物,采用光学成像法能够更全面地获取压载水中的生物种类。传感器技术、电池技术、计算技术[36]和新材料的快速发展,带动三维成像、全息成像与图像智能识别算法的进步,以图像智能识别[37-38]和卷积神经网络算法(Convolutional Neural Network,CNN)为代表的多重神经网络算法[39-41]也逐渐被应用到压载水检测中。压载水检测设备逐渐朝着集成化、小型化、低耗能、快速响应、抗干扰等方向发展。
目前数字全息技术在浮游植物检测领域的研究应用方兴未艾。大连海事大学的王俊生教授团队在数字全息成像装置的基础上,配合微流控技术进行样品预处理,设计了一台小型化压载水检测平台。该平台使用全息衍射条纹的中心亮斑和第一级暗条纹的面积和灰度值作为评价藻细胞活性的关键参数,能够对压载水中的藻类进行活性分析,但采用的参数过于单一,准确度不高[42]。山东大学的研究团队则更加注重对藻细胞全息图像进行重构后的振幅和相位变化分析,并从中提取了多个特征值,利用机器学习算法实现了藻细胞活性的自动判别[43]。
3 结论
随着船舶压载水处理逐步受到重视,压载水检测方法和手段逐步呈现多样化。实际应用中,需要根据压载水类型和处理要求,选用不同的检测方法和手段。目前,压载水的检测方法和手段普遍存在检测时间长、灵敏度低、可操作性差、检测结果不够直观等问题。以数字全息技术为代表的真三维、非入侵成像方法和以卷积神经网络算法(CNN)为代表的智能图像处理算法的有机结合,在压载水快速检测中具有广阔的应用前景。特别是蓬勃发展的智能图像处理算法,与传统的图形类检测方法相比,它能够直接从图像像素中提取特征值,处理方式更加接近人类大脑视觉系统的处理方式,为解决现有检测方法和手段存在的弊端提供了有效的解决思路。
参考文献
[1]DRAKE J M, LODGE D M. Global hot spots of biological invasions: Evaluating options for ballast-water management[J]. Proceedings of The Royal Society B:Biological Sciences, 2004, 271(1539): 575-580.
[2]齐艳红,赵映慧,殷秀琴. 中国生物入侵的生态分布[J]. 生态环境, 2004, 13(3): 414-416.
[3]DRAKE L A,MEYER A E,FORSBERG R L,et al. Potential invasion of microorganisms and pathogens via ′Interior Hull Fouling′: Biofilms inside ballast water tanks[J]. Biological Invasions, 2005, 7(6): 969-982.
[4]刘芳明,缪锦来,郑洲,等. 中国外来海洋生物入侵的现状、危害及其防治对策[J]. 海岸工程, 2007, 26(4): 49-57.
[5]WANG J S,FAN Z Q, ZHAO Y L,et al. A new hand-held microfluidic cytometer for evaluating irradiation damage by analysis of the damaged cells distribution[J]. Science Report, 2016, 6: 23165.
[6]WANG J S, SONG Y N, MAW M M, et al. Detection of size spectrum of microalgae cells in an integrated underwater microfluidic device[J]. Journal of Experimental Marine Biology & Ecology, 2015, 473:129-137.
[7]党坤,宋家慧,赵殿荣, 等. 船舶压载水问题综述[J]. 航海技术, 2001, (4): 60-63.
[8]王帅,张波,赵昔龙,等. 适合海洋微藻活体染色的方法评价[J]. 海洋科学进展, 2018, 36(2): 321-330.
[9]PICCININI F, TESEI A, ARIENTI C, et al. Cell counting and viability assessment of 2D and 3D cell cultures: Expected reliability of the trypan blue assay[J]. Biological Procedures Online, 2017, 19(1):8.
[10] HOLMSTRUP M E, HAECKY P, BLACKBURN N. Preliminary verification studies of the motility and fluorescence assay (MFA) for ballast water quality monitoring[J]. Journal of Sea Research, 2020, 159:101889.
[11] GARVEY M, MORICEAU B, PASSOW U. Applicability of the FDA assay to determine the viability of marine phytoplankton under different environmental conditions[J]. Marine Ecology Progress, 2011, 352(12):17-26.
[12] 谭晓华,张亚历,姜泊,等. PI染色流式细胞仪检测细胞凋亡的影响因素[J]. 第一军医大学学报, 2000, 20(4): 344-346.
[13] 祁爱群,钱凯先,邵健忠,等. FDA-PI双色荧光分光光度法检测细胞活性变化[J]. 细胞生物学杂志, 2000, 22(1): 50-52+57.
[14] STEINBERG M K,LEMIEUX E J, DRAKE L A. Determining the viability of marine protists using a combination of vital, fluorescent stains[J]. Marine Biology, 2011, 6(158): 1431-1437.
[15] 张新莉,杨晓莉,潘玙璠,等. 流式细胞仪检测微细胶黏物中尼罗红染料选择性吸附的研究[J]. 中国造纸, 2020, 39(2): 27-32.
[16] 吴建勇,赵德璋. 流式细胞仪检测细胞凋亡的几种方法的比较[J]. 重庆医科大学学报, 2010, 35(9): 1386-1389.
[17] DUNKER S. Imaging flow cytometry for phylogenetic and morphologically based functional group clustering of a natural phytoplankton community over 1year in an urban pond[J]. Cytometry Part A, 2020, 97A: 727-736.
[18] 穆莉莉,侯麗雅,章维一. 基于微流体数字化技术的流式细胞术的设计[J]. 化工学报, 2010, 61(4): 949-954.
[19] HARVEY J B J,HOY M S,RODRIGUEZ R J. Molecular detection of native and invasive marine invertebrate larvae present in ballast and open water environmental samples collected in puget sound[J]. Journal of Experimental Marine Biology and Ecology, 2009, 369(2): 93-99.
[20] 代鲁平,李超伦,王世伟,等. 基于ZooScan图像技术的南黄海夏季浮游动物群落结构分析[J]. 海洋与湖沼, 2016, 47(4): 764-773.
[21] 孙晓霞,孙松. 海洋浮游生物图像观测技术及其应用[J]. 地球科学进展, 2014, 26(6): 748-755.
[22] XU W, JERICHO M H, MEINERTZHAGEN I A, et al. Digital in-line holography of microspheres[J]. Applied Optics, 2002, 41(25):5367-5375.
[23] 郜鹏,温凯,孙雪莹,等. 定量相位显微中分辨率增强技术综述[J]. 红外与激光工程, 2019, 48(6): 81-93.
[24] VICAR T, RAUDENSKA M, GUMULEC J, et al. The quantitative-phase dynamics of apoptosis and lytic cell death[J]. Scientific Reports, 2020, 10(1): 1566.
[25] MACHADO M D,SOARES E V. Quantification and viability analyses of Pseudokirchneriella subcapitata algal cells using image-based cytometry[J]. Journal of Applied Phycology, 2015, 27(2): 703-710.
[26] BAKER K L,BOUCHER K M, JUDSON-TORRES R L, et al. Label-free classification of apoptosis, ferroptosis and necroptosis using digital holographic cytometry[J]. Applied Sciences, 2020, 10: 4439.
[27] MACIEL D, VERES S P, KREUZER H J, et al. Quantitative phase measurements of tendon collagen fibres[J]. Journal of Biophotonics, 2017, 10(1): 111-117.
[28] WANG J S, MAW M M, YU X M, et al. Applications and perspectives on microfluidic technologies in ships and marine engineering: A review[J]. Microfluidics & Nanofluidics, 2017, 21(3):1-16.
[29] GO T, BYEON H, LEE S J. Label-free sensor for automatic identification of erythrocytes using digital in-line holographic microscopy and machine learning[J]. Biosensors & Bioelectronics, 2018, 103:12-18.
[30] 章奇林,孫玉杰. 压载水管理缺陷滞留案例分析[J]. 世界海运, 2020, 43(5): 44-47.
[31] CASAS-MONROY O,CHAN P S,LINLEY R D,et al. Comparison of three techniques to evaluate the number of viable phytoplankton cells in ballast water after ultraviolet irradiation treatment[J]. Journal of Applied Phycology, 2016, 28(5): 2821-2830.
[32] DE CASTRO M C T,VELDHUIS M J W,FILEMAN T W,et al. Different approaches and limitations for testing phytoplankton viability in natural assemblies and treated ballast water[J]. Marine Pollution Bulletin, 2018, 137: 172-179.
[33] GOLLASC H S,DAVID M. Algae viability over time in a ballast water sample[J]. Journal of Sea Research, 2018, 133: 112-114.
[34] 孟雄飞,王俊生,潘新祥. 船舶压载水中微藻快速检测系统设计[J]. 仪表技术与传感器, 2016, (9): 55-58.
[35] 王雨,林茂,林更铭,等. 流式影像术在海洋浮游植物分类研究中的应用[J]. 海洋科学进展,2010, 28(2): 266-274.
[36] 董水峰,柳林,张倩,等. 多源海洋数据综合管理应用平台的研究与实现[J]. 青岛大学学报(自然科学版), 2017, 30(1): 73-78.
[37] 陈作聪,宋武. 基于改进粒子群SVM的海洋赤潮监测算法设计[J]. 青岛大学学报(自然科学版), 2016, 29(4): 30-33.
[38] GO T, KIM J H, BYEON H, et al. Machine learning-based in-line holographic sensing of unstained malaria-infected red blood cells[J]. Journal of Biophotonics, 2018,11(9): e201800101.
[39] LEE S J,YOON G Y,GO T. Deep learning-based accurate and rapid tracking of 3D positional information of microparticles using digital holographic microscopy[J]. Experiments in Fluids, 2019, 60(11): 170.
[40] REIMANN R, ZENG B, JAKOPEC M, et al. Classification of dead and living microalgae Chlorella vulgaris by bioimage informatics and machine learning[J]. Algal Research, 2020, 48:101908.
[41] 生龍,马建飞,杨瑞欣,等. 基于特征交换的CNN图像分类算法研究[J]. 计算机工程, 2019, 46(9): 274-279.
[42] WANG J S, YU X M,WANG Y J, et al. Detection of viability of micro-algae cells by optofluidic hologram pattern[J]. Biomicrofluidics, 2018, 12(2): 024111.
[43] WANG Y Y, JU P, WANG S, et al. Identification of living and dead microalgae cells with digital holography and verified in the East China Sea[J]. Marine Pollution Bulletin, 2021, 163(4):111927.
