驯化对长焰煤制生物气过程氢化酶活性的响应分析*
2021-09-13夏大平闫夏彤刘春兰孙长彦郭红玉
黄 松 夏大平, 闫夏彤 刘春兰 孙长彦 郭红玉,3
(1.河南理工大学能源科学与工程学院,454000 河南焦作;2.河南理工大学资源环境学院,454000河南焦作;3.中原经济区煤层(页岩)气河南省协同创新中心,454000 河南焦作)
0 引 言
煤炭开采势必会对水资源、大气及土壤等环境造成不利影响,如何清洁高效地利用煤炭资源,减轻环境负担已成为当今煤炭转型考虑的重中之重。煤制生物气技术是在微生物的作用下,将煤定向转化为氢气、甲烷等有利物质的一种新技术,具有反应条件温和、耗能少等优点,必将成为未来煤炭资源清洁高效开采的有效途径之一[1-2],而这种技术的首要环节便是高效菌源的获取。目前,众多学者已经在菌源选择上做了许多先导性的工作。在不同地区、不同煤阶的新鲜煤样中均检测有产氢产甲烷菌群[3-4],另外,对煤层水的群落结构研究中也发现存在互营挥发性脂肪酸代谢产甲烷菌系[5]。对比不同煤阶煤分别在本源菌和外源(如沼液、活性污泥和底泥等)菌作用下产气效率的差异,发现外源菌的整体产气效果要优于本源菌的整体产气效果,而驯化是获取高效菌更为关键的因素,微生物经过逐步驯化可缩减对煤的适应过程,使不同菌源菌群的产气效率均得到提高[6-8],这为后续增产研究提供了思路。通过将驯化后的外源菌群注入到煤层气产量低、本源微生物活性弱的浅埋煤层,外源菌协同煤层本源菌共同促进煤层生物气的产出。
氢化酶是一类存在于微生物体内的重要的生物酶,它能够催化伴有氢分子吸收与释放的氧化还原反应[9-11],并且通过调控微生物体内氢气的代谢来调节其他生理代谢活动[12]。氢化酶直接参与了产氢菌及产甲烷菌的物质代谢和能量代谢,在煤制生物气过程中担当着重要的角色[13-14]。通过测定H2产率,氢化酶活性可用于评价不同厌氧接种物的H2生成潜力[15]。有学者[14]在煤制生物气过程中添加铁镍离子来探讨氢化酶活性的变化,发现氢化酶活性随离子浓度的增加呈现先增后减的变化趋势,在产气达到稳定时氢化酶活性也出现峰值,但由于菌群并未驯化,即便是添加最佳离子组合的铁镍离子,其活性峰值也仅为0.6 mL/(mg·min)[14]。氢化酶活性较低严重制约了菌群的表达活性,进而不利于生物气的产出,因此,提高菌的氢化酶活性对于增产生物气具有极大的现实意义。
随着煤化程度的提高,煤分子中易被降解的侧链官能团发生脱落,使芳构化程度不断提高[16],煤样的发酵产气能力与煤的降解率逐步下降[17],所以低阶煤是作为生物产气底物的最佳选择。而长焰煤属于变质程度最低的烟煤,因其挥发分含量高且富含微生物生长所必需的一些微量元素,逐渐受到研究人员的青睐。鉴于此,本研究选择以河南义马千秋矿长焰煤为底物,分别选用矿井水、沼液和污泥作为菌源,逐代驯化培养产氢菌和产甲烷菌,并针对目前氢化酶活性的测定方法普遍存在的检测灵敏度低、安全性差等问题[18]优化氢化酶活性的检测方法,区分产氢菌与产甲烷菌氢化酶活性的测试差异,以有助于后续验证驯化对氢化酶活性的影响;理清氢化酶活性与产气量和菌浊的响应机制,以期为进一步进行氢化酶的分离纯化和酶学性质的研究提供活性酶体的参考,从而为从酶学水平上调控煤厌氧发酵产生物气提供依据。
1 实验部分
1.1 实验材料
为尽量减少煤样运输过程中存在的氧化、有机质损耗等潜在问题,按照就近取样原则对河南省义马千秋矿长焰煤进行采样。样品采集后用清水洗涤,实验前将煤样用粉碎机粉碎至粒径为0.10 mm~0.15 mm,高压灭菌后于样品袋中密封保存备用,煤样的基本物性参数见表1。实验所用菌源分别为煤矿矿井水、农家沼气池中的沼液及污水处理厂排泄池中的厌氧污泥。为尽量保证厌氧条件,采集后要迅速密封,并及时送回实验室置于4 ℃冰箱低温冷藏保存,以保证菌种活性。

表1 煤样的工业分析和元素分析Table 1 Proximate and ultimate analyses of coal sample
1.2 实验设计
1.2.1 不同菌源菌群的富集培养
分别配制产氢培养基及产甲烷培养基对采集到的不同菌源菌群进行富集培养,培养基及微量元素液的配方如下。
1) 产氢培养基(g/L):1 L蒸馏水中分别加1.0 g NH4Cl,0.4 g K2HPO4·3H2O,2.0 g NaCl,2.0 g NaHCO3,0.1 g MgCl2·6H2O,1.0 g胰化酪蛋白,1.0 g酵母膏,10 g葡萄糖,0.5 g L-半胱氨酸盐酸盐,2.0 gEDTA二钠,10 mL微量元素液。
2) 产甲烷培养基(g/L):1 L蒸馏水中分别加1.0 g NH4Cl,0.1 g MgCl2·6H2O,0.4 g K2HPO4·3H2O,0.2 g KH2PO4,0.1 g胰化酪蛋白,0.1 g酵母膏,2.0 g乙酸钠,2.0 g甲酸钠,0.5 g L-半胱氨酸盐酸盐,0.2 g Na2S·9H2O,2.0 g NaHCO3,0.001 g NaHCO3,10 mL微量元素液。
3) 微量元素液(g/L):1 L蒸馏水中分别加1.5 g氮三乙酸,0.1 g CaCl2,3.0 g MgSO4·7H2O,0.05 g H3BO3,0.1 g FeSO4,1.0 g NaCl,0.1 g CoCl2,0.5 g MnSO4,0.1 g ZnSO4,0.05 g NaMoO4,0.01 g AlK(SO4)2,0.1 g NiCl2,0.01 g CuSO4。
1.2.2 氢化酶活性的测定
分别对三种来源的产氢菌和产甲烷菌的氢化酶活性进行测定分析。用A1和B1分别代表矿井水中的产氢菌和产甲烷菌,A2和B2分别代表沼液中的产氢菌和产甲烷菌,A3和B3分别代表污泥中的产氢菌和产甲烷菌;用A11,A21,A31,B11,B21,B31分别代表分别添加0.1 mL溶菌酶的矿井水、沼液和污泥中的产氢菌和产甲烷菌;用A12,A22,A32,B12,B22,B32分别代表各添加0.1 mL蒸馏水的矿井水、沼液和污泥中的产氢菌和产甲烷菌。将灭完菌的25 mL厌氧管放入厌氧工作站中30 min后,分别注入1 mL待测菌液,加入0.1 mL溶菌酶溶液或蒸馏水,向厌氧管中充N210 min后盖上橡皮塞密封。预处理后将厌氧管置于40 ℃恒温水浴锅中,恒温培养时间均为60 min,酶促反应10 min后添加0.2 mL 10%的三氯乙酸使反应终止,随后及时抽取厌氧管中的气体进行气相色谱分析。
在保证菌源不变的情况下,分别选用甲基紫精和甘氨酸为氢化酶活性测定时的电子载体,考察不同电子载体对氢化酶活性测定的影响。
采用灼烧减重法对待测菌液中挥发性悬浮固体(mixed liquor volatile suspended solids,MLVSS)的质量进行测算,精度为0.01 mg。
氢化酶活性(HPE)的计算公式为:
(1)
式中:φ为酶促反应产生的氢气的体积分数,%;V为厌氧管中的气体体积,mL;mMLVSS为每1 mL待测菌液中挥发性悬浮固体的质量,mg;t为酶促反应进行的时间,min。
利用优化后的氢化酶活性测定方法分别对不同驯化周期及不同培养时间下产氢菌和产甲烷菌的氢化酶活性进行测试。
1.2.3 不同菌源菌群的驯化
环境温度是影响高效菌驯化的重要因素,一般产氢菌的适宜温度范围为26 ℃~39 ℃,中温产甲烷菌的适宜温度范围为30 ℃~45 ℃,而相关文献[19-20]对于温度条件的优选,普遍认为35 ℃是煤制生物氢、甲烷中菌群生长的适宜温度,因此,选择35 ℃作为本次驯化的最佳环境温度。
产氢菌的一次驯化:在25 mL的厌氧管中分别加入20 mL无葡萄糖的产氢培养基、2 mL接种后的菌液和0.2 g煤样,在35 ℃环境下驯化培养4 d。二次驯化:在25 mL的厌氧管中分别加入20 mL无葡萄糖的产氢培养基、2 mL一次驯化后的发酵菌液和0.4 g煤样,继续在35 ℃环境下驯化培养4 d。三次驯化:在25 mL的厌氧管中分别加入20 mL无葡萄糖的产氢培养基、2 mL二次驯化后的发酵菌液和0.6 g煤样,继续在35 ℃环境下驯化培养4 d。
产甲烷菌的一次驯化:在25 mL的厌氧管中分别加入20 mL无乙酸钠和甲酸钠的产甲烷培养基、2 mL接种后的菌液和0.2 g煤样,在35 ℃环境下驯化培养4 d。二次驯化:在25 mL的厌氧管中分别加入20 mL无乙酸钠和甲酸钠的产甲烷培养基、2 mL一次驯化后的发酵菌液和0.4 g煤样,继续在35 ℃环境下驯化培养4 d。三次驯化:在25 mL的厌氧管中分别加入20 mL无乙酸钠和甲酸钠的产甲烷培养基、2 mL二次驯化后的菌液和0.6 g煤样,在35 ℃环境下驯化培养4 d。
1.2.4 驯化后产气量及生物活性的测定
采用GC-4000A型气相色谱仪(北京东西分析仪器有限公司)测定气体产物的组分和含量。首先使用外标法对气相色谱进行标定,测试气样时依据其峰面积得到样品中被测组分的体积分数(%),通过总产气量确定被测组分的体积(mL),最后得出单位质量煤的产气量(mL/g)。色谱条件:色谱柱采用填充柱,检测器为TCD热导检测器,5A柱,进样器温度为50 ℃,检测器温度为100 ℃,热丝温度为120 ℃,载气为高纯氦气,进样量为1 mL。采用UV-5200型紫外-可见分光光度计(上海元析仪器有限公司)测定不同产氢菌及产甲烷菌驯化阶段在600 nm处的吸光值,用来表征细菌的生物活性。
2 结果与讨论
2.1 氢化酶活性测定方法的优化
2.1.1 溶菌酶对氢化酶活性测定的影响
根据酶促反应中产生的氢气量和菌液中挥发性悬浮固体(MLVSS)的质量,利用式(1)并统一以气体总体积(V)为22.5 mL,酶促反应时间(t)为10 min对各来源产氢菌和产甲烷菌的氢化酶活性进行计算,结果如图1所示。
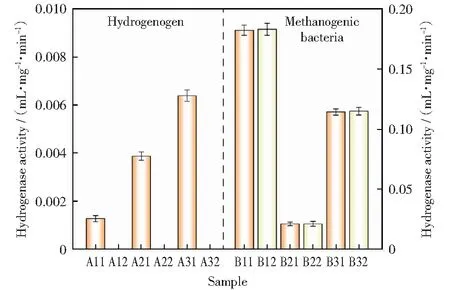
图1 溶菌酶对氢化酶活性测定的影响Fig.1 Influence of lysozyme on determination of hydrogenase activity
由图1可以看出,溶菌酶对产氢菌氢化酶活性的测试有效果,而对产甲烷菌氢化酶活性的测试不起作用。这是由于溶菌酶主要破坏产氢菌菌体细胞壁中的N-乙酰胞壁酸和N-乙酰氨基葡糖之间的β-1,4糖苷键,使细胞壁不溶性多糖分解成可溶性糖肽,导致细胞壁破裂,胞内氢化酶逸出[21]。而已有的研究[22-23]表明,产甲烷菌是典型的革兰氏阴性菌,而革兰氏阴性菌细胞壁所含的脂质比肽聚糖多,肽聚糖层很薄,除少量革兰氏阴性菌如大肠杆菌、普通变形菌和副溶血性弧菌等,溶菌酶对大多数的革兰氏阴性菌都不起作用,因而在产甲烷过程氢化酶活性的预处理时,溶菌酶可以用等量的蒸馏水来代替。
2.1.2 电子载体对氢化酶活性测定的影响
不同电子载体对氢化酶活性测定的影响见图2。由图2可知,在以甘氨酸为电子载体时检测出的产氢菌氢化酶活性均明显高于以甲基紫精为电子载体时检测出的产氢菌氢化酶活性。原因可能是甘氨酸作为电子载体,在预处理及恒温处理过程中稳定性较甲基紫精稳定性高,一方面反应过程中甲基紫精易受到温度的影响而发生部分分解;另一方面在操作过程中可能会有少量的氧气混入厌氧管,而甲基紫精更容易被氧气氧化,即使添加了还原剂,但在一定程度上仍会影响其发挥作用。

图2 不同电子载体对氢化酶活性测定的影响Fig.2 Influence of different electron carriers on determination of hydrogenase activity
在以甘氨酸为电子载体时检测出的矿井水中产甲烷菌氢化酶活性稍低于以甲基紫精为电子载体时检测出的矿井水中产甲烷菌氢化酶活性,而对于沼液和污泥菌源产甲烷菌来讲情况相反。原因可能是矿井水中产甲烷菌以铁氧还蛋白为电子传递体的氢化酶催化反应稍微活跃,而甲基紫精的添加可以大大提高氢化酶催化放氢的速率[24],所以在检测矿井水中产甲烷菌的氢化酶活性时,甲基紫精的效果要稍微优于甘氨酸的效果。但总体而言,甘氨酸的作用效果要优于甲基紫精的作用效果。
2.2 不同菌源驯化培养菌群的氢化酶活性
根据上述实验结果,现用优化后的氢化酶活性测定方法检测驯化培养对不同菌源菌群的氢化酶活性的影响。
通过延长驯化周期和恒温培养时间,发现二者的耦合效应可以最大程度上优选出氢化酶活性最佳的驯化条件,从而有利于后续产氢产甲烷的进行。图3所示为逐代驯化培养对不同菌源菌群氢化酶活性的影响。由图3可以看出,三种菌源菌群在未驯化就直接接种培养时,对煤表现出极大的不适应,随着培养时间的延长,氢化酶活性逐渐增强,但始终保持在较低的水平。对菌群驯化能有效提高菌群对环境的适应能力,矿井水中的产氢菌在三次驯化并恒温培养48 h后氢化酶活性最高,为0.11 mL/(mg·min);产甲烷菌的氢化酶活性普遍高于产氢菌的氢化酶活性,其中,矿井水中的产甲烷菌在三次驯化并恒温培养56 h后氢化酶活性达到最大值2.84 mL/(mg·min);另外两种菌源菌群均提前达到氢化酶活性最高值,其中沼液中产氢菌在二次驯化并恒温培养48 h后氢化酶活性最大,为0.17 mL/(mg·min),而沼液中产甲烷菌在二次驯化并恒温培养64 h后氢化酶活性最大,为2.23 mL/(mg·min);污泥中产氢菌在二次驯化并恒温培养56 h后氢化酶活性最大,为0.14 mL/(mg·min),而污泥中产甲烷菌在二次驯化并恒温培养80 h后氢化酶活性最大,为2.45 mL/(mg·min)。

图3 逐代驯化培养对不同菌源菌群氢化酶活性的影响Fig.3 Influence of successive generation acclimation and cultivation on hydrogenase activity of bacterium from different bacterial sourcesa—A1;b—A2;c—A3;d—B1;e—B2;f—B3
对以矿井水为菌源的产氢菌和产甲烷菌进行驯化,达到氢化酶活性峰值的延滞期都要比对其他两种菌源产氢菌和产甲烷菌进行驯化达到氢化酶活性峰值的延滞期长,分析认为,矿井水为采自煤层的地下水,沼液是利用生物有机质厌氧发酵的液体,而污泥是由微生物群体及吸附的污水中有机和无机物质组成,由于其底物及水源的限制,矿井水中菌的数量和种类较少,所以总体而言,矿井水菌群的氢化酶活性要低于沼液菌群和污泥菌群的氢化酶活性[6]。在驯化时间较短时,细菌刚进入延滞期,还未达到生长对数期,而随着驯化培养的进行,细菌的数量逐渐增多,代谢活性也逐渐增强,总的氢化酶活性增大;不同菌源菌群的氢化酶活性随恒温培养时间的延长基本表现出先增后减的趋势,培养初期,煤表面官能团结构复杂,较难脱落,导致菌群对煤的降解不充分;随着时间的延长,降解产生的氨氮及代谢毒素对菌群造成不利作用[25],氢化酶活性也随之降低。
在对菌源中的产氢菌和产甲烷菌进行氢化酶活性测定时分别添加了产甲烷菌抑制剂2-溴乙烷磺酸钠和产氢菌抑制剂盘尼西林-G,从而在对产氢菌氢化酶活性进行测定时,由于产甲烷菌的活性受到抑制,无法利用已产生的氢气,故厌氧管中的氢分压难以降低,因此没有更多的氢气产生;而在对产甲烷菌氢化酶活性进行测定时,驯化培养阶段菌液中产生的乙酸、丙酸、丁酸等发酵产生氢气,进而在测定氢化酶活性时被产甲烷菌消耗使得氢分压降低[26],菌液中的小分子酸进而转化产生氢气,故产甲烷菌氢化酶活性的测定值远高于产氢菌氢化酶活性的测定值。
2.3 产气特征与氢化酶活性的关系
不同菌源菌群在逐代驯化培养时的氢化酶活性具有差异,而这种差异就直观地表现在产气特征上。图4所示为逐代驯化培养后不同菌源菌群的产气特征。
由图4可以看出,矿井水无论作为产氢菌源还是产甲烷菌源,菌群的产气量均随着驯化代数的增加而增大,在三次驯化时均达到最大值,其中产氢量最大值为10.89 mL/g,产甲烷量最大值为6.54 mL/g。以沼液和污泥为菌源时,菌群的产气特征与以矿井水为菌源时菌群的产气特征相似,两者无论是作为产氢菌源还是产甲烷菌源,菌群的产气量都呈现出先增后减的变化趋势,并且都在二次驯化时达到最大值,其中,沼液菌群的产氢量最大值为14.45 mL/g,产甲烷量最大值为4.95 mL/g;污泥菌群的产氢量最大值为11.32 mL/g,产甲烷量最大值为5.51 mL/g。

图4 逐代驯化培养后不同菌源菌群的产气特征Fig.4 Gas production characteristics of bacterium fromdifferent bacterial sources after successive generationacclimation and cultivation
不同菌源菌群的产气效果与各自驯化阶段表现出的氢化酶活性高度一致。在未驯化前,由于菌群还未适应以煤为底物的环境,导致初期氢化酶活性较弱,产气量也较低。其中,由于沼液中可能存在可供微生物利用的生物有机质,导致在驯化前以沼液为菌源的菌群产气量较大。对菌群的逐代驯化有效地提高了菌群对环境的适应能力,氢化酶活性逐渐增强,对应的产气量也逐渐增大。沼液产氢菌在二次驯化时氢化酶活性最大,同时其产氢量也是三种菌源产氢菌产气量中最大的。同理,矿井水中产甲烷菌在适应煤环境后,在三次驯化时氢化酶活性和产甲烷量同时达到最大值。
对比文献[27]研究,煤制生物氢技术属于暗发酵,与传统的光解水制氢技术相比,其能量转化效率更高。对比同样以河南义马千秋矿长焰煤为底物,以矿井水为菌源的产氢实验,发现其最终累计产氢量为6.24 mL/g[28],而本研究矿井水中产氢菌经驯化后的产氢量为10.89 mL/g,增产了74.52%,足以说明驯化菌群对于增产有极大的促进作用。而另一项研究[29]在优化煤制氢产出条件时,获得的氢气产量高达24.26 mL/g,原因在于添加了10 mL/g的FeCl2·4H2O,Fe是氢化酶的重要组成部分,Fe2+的添加通过促进氢化酶的合成来达到提高氢气产量的目的。驯化本身是为了提高菌群对环境的适应性,其虽也增大氢化酶活性,但仍不及添加Fe2+的促进效果。同理,经驯化后的产甲烷菌的产气能力相较于其他文献[30]报道中产甲烷菌的产气能力均有所提高。
2.4 菌浊与氢化酶活性的关系
以煤为唯一碳源的驯化培养能增强菌种对煤的适应性,逐步提升氢化酶活性,细菌培养液在600 nm处的吸光值D(600)可直接反映菌浊特征,并间接考察菌浊与氢化酶活性的关系。
三种来源产氢菌在不同驯化培养阶段的D(600)值如图5所示。由图5可以看出,驯化前菌液的D(600)明显高于驯化后菌液的D(600),说明三种产氢菌液在驯化前的微生物总量高于驯化后的微生物总量,驯化前产氢菌液中可能存在大量的非产氢细菌,它们的存在会使得菌液的生物活性很大,但却会干扰针对产氢菌的氢化酶活性测定,而在测定过程中,为了提高测定结果的准确性,虽添加了产甲烷菌活性抑制剂2-溴乙烷磺酸钠,但其对大部分的非产甲烷杂菌并不起作用。驯化后菌液中原本存在的无法利用煤的细菌因缺乏碳源而大量死亡。随着驯化的进行,产氢菌的相对含量不断增加,加之恒温培养时间的延长,使得产氢菌源的D(600)值不断增大。

图5 逐代驯化过程检测的不同菌源的D(600)值Fig.5 D(600) values of different bacterial sources detected in the process of generational acclimation
将三种产甲烷菌源在不同培养阶段的D(600)测算值进行对比后可以看出,产甲烷菌源的D(600)值在不同培养阶段的变化规律与产氢菌源的D(600)值在不同培养阶段的变化规律不同,产甲烷菌源在驯化前的D(600)值低于驯化后的D(600)值,说明接种后细菌的生长速度缓慢,这基本符合产甲烷菌的生长繁殖特性,产甲烷菌属于典型的长生长周期的厌氧细菌[31-32],接种后短短3 d的培养时间,产甲烷菌仍处于生长缓慢期,特别是矿井水菌源,因其中的细菌数量本就少于沼液和污泥中的细菌数量,故相应的D(600)值也小于沼液和污泥的D(600)值,这也是初期氢化酶活性较弱的原因。而随着驯化的进行,产甲烷菌逐渐适应以煤为碳源进行生长和繁殖,数量不断增多,之后D(600)出现下降,此时氢化酶活性也有所减弱。
3 结 论
1) 分别确定了产氢菌和产甲烷菌氢化酶活性的测定条件,产氢菌氢化酶活性的测定需加入溶菌酶,而产甲烷菌氢化酶活性的测定可以添加等量的水替代,并且以甘氨酸为电子载体测定氢化酶活性的作用效果要优于以甲基紫精为电子载体测定氢化酶活性的作用效果。
2) 不同菌源中,产甲烷菌经过逐代驯化培养的氢化酶活性远高于产氢菌经过逐代驯化培养的氢化酶活性,产甲烷菌的氢化酶活性保持在2 mL/(mg·min)左右,而产氢菌的氢化酶活性基本维持在0.1 mL/(mg·min)这一很低的水平。主要是因为产甲烷菌的耗氢作用能够有效降低环境中的氢分压,有利于有机物分解产氢。
3) 不同菌源菌群的氢化酶活性随驯化培养时间的延长基本表现出先增后减的趋势,各菌源菌群驯化培养氢化酶活性达到峰值的条件分别为:A1经三次驯化并培养48 h,峰值为0.11 mL/(mg·min);A2经二次驯化并培养48 h,峰值为0.17 mL/(mg·min);A3经二次驯化并培养56 h,峰值为0.14 mL/(mg·min);B1经三次驯化并培养56 h,峰值为2.84 mL/(mg·min);B2经二次驯化并培养64 h,峰值为2.23 mL/(mg·min);B3经二次驯化并培养80 h,峰值为2.45 mL/(mg·min)。
4) 不同菌源菌群的产气效果和菌浊与各自驯化阶段表现出的氢化酶活性高度一致。其中A1,A2和A3的氢气产量峰值分别为10.89 mL/g,14.45 mL/g和11.32 mL/g,B1,B2和B3的甲烷产量峰值分别为6.54 mL/g,4.95 mL/g和5.51 mL/g。
