重症急性胰腺炎合并消化道瘘的临床特点分析
2021-09-13何益信李颖霞姜利彬温洪涛
何益信,李颖霞,姜利彬,温洪涛
(郑州大学第一附属医院 消化内科,河南 郑州 450000)
重症急性胰腺炎(severe acute pancreatitis,SAP)是急性胰腺炎的一种亚型,约占急性胰腺炎的20%,通常发病迅速、病情凶险、死亡率较高[1],SAP早期即可引起全身性炎症反应综合征甚至多器官功能障碍综合征[2],极易合并多种严重的并发症,大大增加了患者死亡的风险。消化道瘘为SAP较严重的并发症之一,轻者可无明显症状,重者多伴有营养不良、腹膜炎甚至脓毒症休克等,内科药物处理效果较差,通常需要手术干预[3]。本研究通过回顾性分析SAP合并消化道瘘的临床特点、诊疗及预后,提高对该疾病的进一步认识,为临床诊治提供一定的参考价值。
1 对象与方法
1.1 研究对象收集2018年4月至2020年10月在郑州大学第一附属医院接受诊治的SAP合并消化道瘘患者13例,占此期间确诊重症急性胰腺炎患者总数的2.46%(13/529)。采用回顾性调查分析方法研究SAP合并消化道瘘的一般资料、发病部位及时间、病因、临床表现、实验室检查、影像学检查、治疗及转归等临床特点。
1.2 统计描述方法采用SPSS 22.0软件对数据进行统计。计数资料用频数和率(%)表示,呈非正态分布的计量资料以中位数和四分位数M(P25,P75)表示,采用Kaplan-Meier绘制生存曲线。
2 结果
2.1 一般情况13例SAP合并消化道瘘的患者中,男性6例,女性7例,发病年龄为26~76岁,中位年龄为45岁。发病原因中,胆源性2例(15.38%),酒精性5例(38.46%),高脂血症1例(7.69%),暴饮暴食2例(15.38%),妊娠合并胰腺炎1例(7.69%),2例病因不明确。
2.2 发生部位及时间13例SAP合并消化道瘘的患者中,胃瘘2例,占15.38%,其中胃体、胃底各1例;十二指肠瘘7例,占53.85%,其中主要以十二指肠球降移行处为主;结肠瘘3例,占23.08%;小肠瘘1例,占7.69%。消化道瘘发生于SAP后2~26周,中位间隔时间为6周,其中女性的中位间隔时间相对低于男性,如图1。年龄段>35岁的患者中位间隔时间相对低于年龄段≤35岁的患者,如图2。

图1 不同性别发生消化道瘘与SAP发病间隔时间

图2 不同年龄段发生消化道瘘与SAP发病间隔时间
2.3 临床表现13例SAP合并消化道瘘的患者均有不同程度的腹痛、腹胀、恶心、呕吐、发热症状,其中上腹痛者占多数,并伴有不同程度的后背部放射性疼痛。3例患者合并肾功能不全,4例患者合并肝功能不全,13例患者合并腹腔积液,其中血性腹水4例,脓性腹水7例,其余2例为淡黄色液体。腹水中的淀粉酶均有不同程度升高。11例患者腹腔引流液细菌培养提示感染肺炎克雷伯杆菌、鲍曼不动杆菌、大肠埃希菌、屎肠球菌等耐药菌,其中2例患者腹腔引流液培养出了白念珠菌和光滑念珠菌。10例患者合并胸腔积液。1例患者合并心功能不全,该患者在治疗过程中曾出现心跳骤停,经及时心肺复苏及后续积极治疗后恢复正常。2例患者合并呼吸窘迫综合征;3例患者合并胆囊结石、胆囊炎等胆道系统疾病。消化道出血及胰性脑病各1例。
2.4 实验室检查13例患者淀粉酶均有不同程度的升高,最高可达6 147 U·L-1,中位数为197.7 U·L-1;13例患者脂肪酶均有不同程度的升高,最高可达 5 528 U·L-1,中位数为132 U·L-1;白细胞升高者12例,最高可达43.18×109L-1,中位数为16.30×109L-1;血小板降低者4例,最低可达7×109L-1,中位数为132×109L-1;血红蛋白降低者13例,最低可达54 g·L-1,中位数为69.2 g·L-1;血糖升高者11例,最高可达40.50 mmol·L-1,中位数为16.10 mmol·L-1;血钙降低者7例,最低可达1.24 mmol·L-1,中位数为1.91 mmol·L-1;甘油三酯升高者8例,最高可达15.54 mmol·L-1,中位数为5.48 mmol·L-1;降钙素原升高者12例,最高可达15.4 ng·mL-1,中位数为2.39 ng·mL-1;D-二聚体升高者11例,最高可达22.80 mg·L-1,中位数为5.56 mg·L-1。
2.5 影像学及内镜检查所有患者CT检查均提示不同程度的斑片状渗出。9例患者因发现引流液性质改变而早期发现瘘口存在的可能性,并最终经过进一步的影像学及内镜检查得以确诊。8例患者完善钡餐检查,结果回示腹腔团片状对比剂显示并游离对比剂显示。十二指肠降部与水平部交界处可见钡剂漏入腹腔内,如图3。1例患者通过鼻肠管注射美兰后引流管内的引流液变蓝。1例患者通过窦道及瘘管造影可见对比剂进入十二指肠降部。余3例患者在内镜下直观看到瘘口情况。胃镜下可见胃体后壁巨大瘘口,腹腔窦道腔内可见较多坏死物附着及脓性物,如图4。内镜下可见患者瘘口大小不等,其中最小的瘘口直径约0.4 cm,最大瘘口直径约2.7 cm。瘘口数目个数不等,其中最多为3处瘘口。
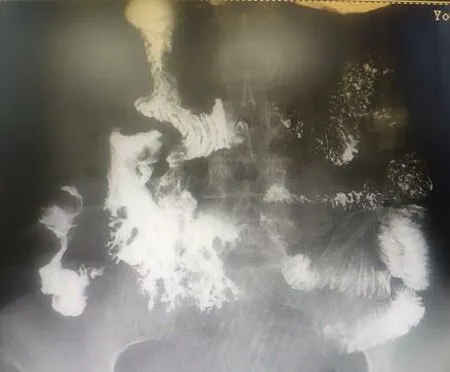
图3 钡餐造影

图4 胃镜下表现
2.6 治疗
2.6.1一般治疗 13例患者入院后均严密检测生命体征及血生化指标的变化,并结合患者的病情给予禁食、胃肠减压、止痛、减少胰液分泌、抑制胰酶活性、营养支持、液体复苏及纠正水、电解质酸碱失衡等对症支持治疗,根据血液及腹腔引流液细菌培养及药敏试验结果调整抗生素的应用,根据血糖监测结果积极调控血糖。
2.6.2肠瘘的治疗及转归 采用电话方式对患者进行随访,随访截至2020年12月,随访时间为1.3~31个月,中位随访时间为7个月,随访过程中瘘口愈合7例,11例生存,2例死亡,治愈率达58.33%,生存率为84.62%,如图5。5例十二指肠瘘患者经过普通引流管或双套管充分引流冲洗并行空肠营养管置入早期恢复肠内营养后4例患者肠瘘自行愈合,1例患者无好转,随访截止时仍在继续治疗。1例十二指肠瘘患者行内镜IT刀沿瘘口周围扩大切开并经十二指肠肠壁瘘口行胰腺假性脓肿清创及引流术,术后经过后期的营养支持及充分引流后患者瘘口愈合。余1例十二指肠瘘患者行空肠造瘘术及空肠营养管置入,然而该患者在治疗过程中因胰腺坏死较重且合并严重的感染而死亡。1例小肠瘘及1例结肠瘘患者分别行小肠造瘘及回肠造瘘术,然而该2例患者随访截止时瘘口仍未好转。1例胃底瘘患者行胃十二指肠营养管置入术并恢复肠内营养后瘘口可自行修补。余1例胃体瘘患者瘘口直径达2.7 cm,因瘘口较大且感染较重前期暂行经胃壁瘘口胰腺周围脓肿清创术,然而该患者因合并脓毒血症、脓毒症休克及多器官功能障碍综合征等多种并发症而死亡。1例降结肠3处瘘口患者经2次内镜下钛夹夹闭修补及充分引流管引流冲洗后3处瘘口均愈合。1例降结肠瘘患者行“瘘口连同降结肠瘘口水肿处肠管一并切除联合端侧吻合肠管联合残端封闭术”,随访过程中患者一般情况良好。
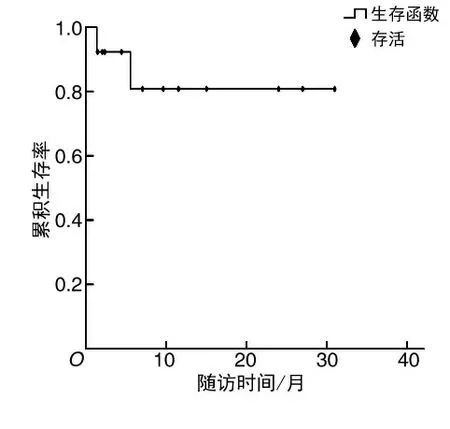
图5 13例重症急性胰腺炎合并消化道瘘生存曲线
3 讨论
SAP是消化科较为常见的一种急危重症,通常伴发严重的全身炎症反应及多器官功能障碍,其病死率达9%~40%[4]。近年来,随着生活水平的提高及饮食习惯的改变,SAP的发病率逐年升高,严重危害人们的健康[5]。SAP在疾病的发生发展过程中通常伴发各种严重的并发症,消化道瘘作为SAP的并发症之一,一方面造成肠内营养成分的丢失,另一方面影响了患者的预后,降低了患者的生活质量[6-7]。
研究表明,SAP可通过以下途径诱发消化道瘘:(1)腐蚀作用,胰腺与胃肠道在解剖上相毗邻,SAP患者胰周渗出液或继发感染形成的脓液可腐蚀相邻的胃肠道壁而形成瘘口[8];(2)压迫作用,胰周渗出液或脓液的局限占位效应、引流管置入不当等因素可压迫肠系膜血管或肠管导致肠壁局限性的缺血坏死[9];(3)手术创伤,SAP患者在行腹部手术或者反复的清创引流过程对肠壁的机械性损伤可增加瘘口形成的风险[10]。本研究中SAP合并消化道瘘的主要部位为十二指肠和结肠,其中十二指肠以降部为主,结肠以结肠脾区为主,而胃瘘和小肠瘘相对较少,这可能与解剖关系、胃肠道壁的血供及厚度情况有关。
早期及时发现SAP合并消化道瘘的存在及定位对疾病的诊疗至关重要,初步的判定一般有赖于引流液的性状,通常胃、十二指肠和小肠瘘时引流液主要是食物残渣,而结肠瘘时引流液主要是粪样物质。有研究表明,CT可通过肠壁增厚、肠壁最大厚度、胰腺外气灶的存在等参数预测消化道瘘形成的风险[11]。当然,精确的定位需要内镜或造影等相关检查。值得一提的是,本研究中,9例患者因发现引流液性质改变而早期发现瘘口存在的可能性,其中2例SAP患者在早期恢复饮食时因进食红心火龙果后引流管可见红色引流液,且仔细观察引流液可见细小颗粒状的火龙果籽,并经后期的内镜检查进一步确诊了消化道瘘的存在。
SAP合并消化道瘘患者通常吸收功能较差且常合并肠内营养液的大量丢失,导致营养不良。本研究中,所有患者均有不同程度的低蛋白血症,这一方面与胃肠道的消化吸收功能有关,另一方面也与反复的感染消耗有关,低蛋白血症可引起血管胶体渗透压降低而导致胃肠道壁的水肿,进一步增加了胃肠道瘘口形成的风险。另外,SAP的严重程度对消化道瘘的发生也很重要。低钙血症及腹腔出血通常与SAP渗出液的强腐蚀性有关,SAP时大量的脂肪酶分解脂肪组织后形成的脂肪酸与钙离子结合从而消耗大量的钙离子导致低钙血症,另外,这些酶也可溶解皮下脂肪组织破坏毛细血管导致腹腔出血。本研究中,7例患者存在不同程度的低钙血症,4例患者引流出血性腹水且均存在不同程度的贫血。由此可见,低钙血症及腹腔出血可提示SAP渗出液的强腐蚀性,因而增加了肠瘘的风险。
SAP患者常因肠道菌群异位、胆源性感染或有创操作等继发感染。有研究表明,SAP合并感染可增加肠瘘发生的概率[12],这可能与感染诱发的炎症反应引起胃肠道壁通透性增加有关。本研究中,7例患者引流管可引流出脓性液体,并且引流液可培养出鲍曼不动杆菌、肺炎克雷伯杆菌及大肠埃希菌等耐药菌株。因而,当SAP患者合并感染时应警惕消化道瘘的发生。有研究表明,SAP患者过早手术治疗可增加肠瘘的风险,这可能与早期疾病仍处于活动期不能彻底清除坏死组织而增加了感染及创伤的风险有关[13]。本研究中,4例SAP患者消化道瘘均发生于胰腺术后,其中1例在胰腺部分切除术后3 d即继发肠瘘。刘付宝等[14]的研究表明,SAP患者在保守治疗过程中择期手术时机的选择对提高SAP的治疗效果至关重要。
SAP合并消化道瘘的治疗可分为保守治疗和手术治疗,治疗方式随着病情进展的时期、瘘口部位而不同,应结合患者自身情况采取有针对性的个体化治疗[15]。一般治疗主要包括早期的胃肠减压、抑酸剂及生长抑素的应用减少胰液的分泌、乌司他丁降低胰酶的活性、腹腔积液的穿刺引流、根据药敏试验适当调整抗生素的应用、及时有效的液体复苏及营养支持等,另外,适当的清胰或大承气汤应用不仅可改善肠道麻痹、促进肠道蠕动、缓解腹胀症状、预防肠黏膜萎缩及促进肠道功能的恢复,还可以预防细菌移位及腹腔感染。一般治疗不仅可改善患者的症状,而且早期积极采取有效的治疗措施对于预防SAP患者消化道瘘的形成至关重要。然而,对于消化道瘘的处理,有研究表明,肠瘘的自愈率达88.8%[16],本研究中,非手术切除治疗主要包括内镜下钛夹夹闭修补瘘口、高位消化道瘘(胃十二指肠)通过空肠营养管越过瘘口恢复肠内营养、小肠瘘及结肠瘘的肠管临时性造瘘并择期还纳,12例患者经过以上非手术切除治疗后,7例患者瘘口愈合,3例患者瘘口无好转,2例患者因SAP合并多器官功能障碍而死亡,治愈率达58.33%。有研究表明,SAP合并胃肠道瘘患者的死亡率与无胃肠道瘘的患者的死亡率差异无统计学意义[17]。另外,本研究中仅有1例降结肠瘘患者行外科手术切除包含瘘管的肠段,随访过程中患者一般状况良好。
总之,SAP合并消化道瘘主要与胰周渗出液或继发脓液的腐蚀、压迫作用及手术创伤等因素有关,积极治疗SAP、及时有效地控制疾病的进展对预防消化道瘘的形成至关重要。SAP患者合并严重的低钙血症、腹腔出血或重度感染时应警惕合并消化道瘘的发生,密切观察引流液性状的改变有助于早期发现消化道瘘,目前治疗以非手术切除方式为主,具体的治疗方式根据瘘口情况而定。
