HPLC法测定大果山楂果实中八种酚酸类成分的含量
2021-09-12孙博霍华珍蔡爱华谢运昌李海云李典鹏
孙博 霍华珍 蔡爱华 谢运昌 李海云 李典鹏

摘 要: 建立HPLC法同時测定大果山楂果实中原儿茶酸、绿原酸、二氢咖啡酸、咖啡酸、根皮酸、p-香豆酸、阿魏酸和肉桂酸的方法,并通过HPLC法分析这八种酚酸在不同产地大果山楂果实中的含量。采用ZORBAX SB-C18色谱柱,以甲醇/1.5%甲酸水溶液(v/v)为流动相,梯度洗脱,柱温35 ℃,流速1.0 mL·min-1,检测波长280、320 nm。结果表明:(1)在线性范围内八种酚酸质量浓度与色谱峰峰面积的线性关系良好,相关系数均>0.997,检出限0.08~0.20 μg·mL-1,定量下限 0.27~0.67 μg·mL-1,变异系数均<5.0%,加标回收率99.3%~103.3%;(2)10个不同产地的大果山楂果实中酚酸含量丰富,均检出原儿茶酸、绿原酸、二氢咖啡酸、咖啡酸、根皮酸、阿魏酸和肉桂酸七种酚酸,其中,二氢咖啡酸、根皮酸、阿魏酸均为首次检出,以绿原酸为主(8 410.2~13 826.7 μg·g-1),占总酚酸的80%以上,总酚酸的质量分数在10 187.8~15 583.9 μg·g-1之间,其中广西百色靖西和桂林恭城产的果实总酚酸质量分数相对较高,均大于15 000 μg·g-1。综上结果表明,该研究的HPLC法适用于大果山楂果实中酚酸含量的测定,可为大果山楂优良品种的选育、产品质量控制及深度开发利用提供方法和科学参考。
关键词: HPLC, 大果山楂, 果实, 酚酸, 含量
中图分类号: Q946 文献标识码: A 文章编号: 1000-3142(2021)07-1135-10
Abstract: The contents of phenolic acids in Malus doumeri fruits from different production areas were investigated, and at the same time, HPLC method was developed to detect eight phenolic acids, including protocatechuic acid, chlorogenic acid, dihydrocaffeic acid, caffeic acid, phloretic acid, p-coumaric acid, ferulic acid and cinnamic acid. ZORBAX SB-C18 column was adopted. The mobile phase was composed of methanol and 1.5% formic acid aqueous with a gradient elution. The column temperature was 35 ℃, the flow rate was 1.0 mL·min-1, the detection wavelength was 280, 320 nm, and the injection volume was 20 μL. The results were as follows: (1) Linear relationship between the mass concentration and the peak area of the chromatogram of eight phenolic acids good, with the correlation coefficient > 0.997, the detection limit 0.08-0.20 μg·mL-1, the lower limit of quantitation 0.27-0.67 μg·mL-1, the coefficient of variation <5.0%, and the adding standard recovery 99.3%-103.3%. (2) Seven phenolic acids (protocatechuic acid, chlorogenic acid, dihydrocaffeic acid, caffeic acid, phloretic acid, ferulic acid and cinnamic acid) were detected over ten samples in different production areas. Among the seven phenolic acids, dihydrocaffeic acid, phloretic acid and ferulic acid were detected in M. doumeri fruits for the first time, and chlorogenic acid (8 410.2-13 826.7 μg·g-1) was predominant, accounting for more than 80% of the total phenolic acids. The mass fraction of total phenolic acids ranged from 10 187.8 to 15 583.9 μg·g-1. The mass fraction of total phenolic acids from fruits picked from Jingxi of Baise and Gongcheng of Guilin in Guangxi was relatively high, more than 15 000 μg·g-1. The above results indicate that the HPLC method used in this study is suitable for the determination of phenolic acids contents in M. doumeri fruit, and can provide methods and scientific basis for screening superior variety, products quality control, and deep exploitation and utilization of M. doumeri fruits.
Key words: HPLC, Malus doumeri, fruits, phenolic acids, content
大果山楂,又名涩梨、广山楂等,为蔷薇科(Rosaceae)苹果属(Malus Mill.)植物台湾林檎(M. doumeri )或光萼林檎(M. leiocalyca )的果实,主要分布于中国南部广西、福建、台湾等地,广西逐步成为大果山楂台湾林檎人工栽培主产区(王雷宏等,2012;曾勇豪等,2014;黄欣欣,2015)。大果山楂含有丰富的营养成分和活性成分,具有降脂、保肝和抗肿瘤等生理功效(Zhu et al., 2019;赵帅等,2020),是广西道地药材之一(邓家刚和韦松基,2007),为壮药,其果实酸甜,可加工成果糕、果酒等地方特色食品,具有广阔的开发利用前景(广西壮族自治区食品药品监督管理局,2011;张巧等,2018;郭婷等,2019)。但大果山楂物质基础研究不够深入,缺乏科学、合理的质量评价方法,阻碍了其深度开发和利用(温玲蓉,2016;赵帅等,2020)。
酚酸类化合物是含有活泼氢供体结构的酚羟基有机酸,具有抗氧化、抗菌和抗病毒等多种生物活性,是大果山楂果实中重要的功效成分之一(温玲蓉,2016;Choi et al., 2017;陈志杰等,2018),定性定量分析大果山楂果实的酚酸类组成及含量对评价果实的品质并促进其深度加工利用具有重要意义。现有多种分析酚酸类化合物的方法,而高效液相色谱法(HPLC)因具有准确度高、经济简便等优点被检测领域广泛使用(李岩等,2018;邓渝等,2018;屈艳勤等,2019)。目前,对大果山楂果实中酚酸类成分进行定性定量分析的报道较少,仅有Wen et al.(2016)采用HPLC法测定了果实中绿原酸、咖啡酸、肉桂酸三种酚酸的含量,且分离效果仍有待改进。本研究建立HPLC法同时测定大果山楂果实中原儿茶酸、绿原酸、二氢咖啡酸、咖啡酸、根皮酸、p-香豆酸、阿魏酸和肉桂酸的方法,并比较分析这八种酚酸在不同产地大果山楂果实中的含量,以期为大果山楂优良品种的选育、原料和产品的质量控制以及深度开发和利用提供科学参考。
1 材料与方法
1.1 材料和试剂
大果山楂样品采自10个不同产地的新鲜果,经广西壮族自治区中国科学院广西植物研究所李典鹏研究员和黄渝松副研究员鉴定,均为台湾林檎(Malus doumeri) 果实,具体见表1。选择无病虫害、无机械损伤且成熟度基本一致的样品,在温度4 ℃、湿度78%左右环境中贮藏。
原儿茶酸、绿原酸、咖啡酸、肉桂酸、p-香豆酸、阿魏酸、二氢咖啡酸和根皮酸对照品(纯度≥98%),西安玉泉生物科技有限公司;甲醇、乙腈(色譜纯),安徽天地高纯溶剂有限公司;氢氧化钠、盐酸、甲酸(AR),西陇化工股份有限公司;乙酸乙酯、乙醚(AR),天津市大茂化学试剂厂;EDTA、抗坏血酸(AR),国药集团化学试剂有限公司;水为超纯水。
1.2 仪器和设备
Shimadzu LC-20A高效液相色谱仪(配有Prominence SPD-M20A PDA检测器),日本岛津公司;高速冷冻离心机,德国Eppendorf公司;真空冷冻干燥机,上海乔枫实业有限公司;RIOS 8超纯水系统,美国Millipore公司;XS205DU电子分析天平,梅特勒-托利多国际贸易(上海)有限公司;F-020ST数控超声波清洗机,深圳福洋科技集团有限公司;LHS智能恒温恒湿箱,上海一恒科学仪器有限公司;N-1100旋转蒸发仪,日本东京理化器械株式会社;BCD-213D11D双门冰箱,广东容声电器股份有限公司。
1.3 方法
1.3.1 溶液的配制 1.5%甲酸水溶液的配制:取15.0 mL甲酸,超纯水定容至1.0 L,用0.45 μm水相膜过滤,超声5 min,现配现用。酚酸单一对照品储备液的配制:分别精确称取20.0 mg的原儿茶酸、绿原酸、咖啡酸、肉桂酸、p-香豆酸、阿魏酸、二氢咖啡酸和根皮酸对照品,置于25 mL 棕色容量瓶中,并用色谱甲醇溶解后定容至刻度,得到800.0 μg·mL-1的单一对照品储备液,置于-20 ℃冰箱中避光保存备用。样品稀释液的配制:取1.5%甲酸水溶液95 mL,加入5 mL色谱甲醇,混匀,现配现用。混合酚酸对照品工作液的配制:等量移取8种单一对照品储备液,充分混匀后,用样品稀释液稀释至0.05~100 μg·mL-1的系列混合酚酸对照品溶液,过0.45 μm有机滤膜,超声脱气5 s,现配现用。碱提取液:分别先配成4 mol·L-1 NaOH、1%抗坏血酸和10 mmol·L-1 EDTA 溶液,将三者按120∶2∶3的比例添加后混匀;萃取液:乙醚和乙酸乙酯按体积比1∶1混匀即可。
1.3.2 大果山楂果实总酚酸的提取及分析前样品预处理
1.3.2.1 总酚酸的提取 参照文献方法(Luo et al., 2013; 李岩等,2018;匡凤元等,2019),稍作改进。将新鲜的大果山楂果实切成小块,冻干磨成粉。酚酸有机溶剂提取:称取粉末样品2.000 g,加入80%甲醇水溶液40 mL,常温浸提24 h,40 ℃超声提取 30 min,过滤,10 000 r·min-1 离心 5 min,滤渣重复提取2次,合并上清液得到A提取液。碱提取:将上述过滤得到的残渣和离心得到的沉淀合并后加入50 mL碱提取液,在氮气保护并密封条件下室温搅拌约24 h,用HCl调节pH为2.0,用60 mL萃取液萃取三次,合并萃取液10 000 r·min-1 离心5 min,得到B提取液。酸提取:继续将上述碱处理过的残渣和沉淀在85 ℃下用50 mL HCl(4 mol·L-1)水解30 min,冷却后用NaOH调节pH为2.0,其余同碱提取方法,得到C提取液。合并A、B、C三种提取液即为总酚酸提取液。
1.3.2.2 分析前样品预处理 将1.3.2.1得到的总酚酸提取液50 ℃真空旋蒸干,用色谱甲醇溶解并定容至25.0 mL,进样前用样品稀释液稀释至标准曲线线性范围内的浓度,10 000 r·min-1离心5 min,过0.45 μm有机滤膜备用。
1.3.3 色谱条件优化及系统适应性试验 检测波长:取八种酚酸对照品储备液各50 μL,单独稀释成80.0 μg·mL-1,分别在波长190~400 nm之间扫描紫外光谱,选择有较大吸收且无溶剂干扰的波长作为检測波长。色谱柱:选用四种不同填料的反相色谱柱(Symmetry C18、Atlantis T3、BEH C18和ZORBAX SB-C18),分析80.0 μg·mL-1的混合酚酸对照品工作液,选择分离度和峰型相对较好的色谱柱。流动相及检测条件:以甲醇-水溶液或乙腈-水溶液为流动相,改变水溶液的酸种类和浓度、梯度洗脱程序、柱温和流速,以对照品各色谱峰之间的分离度、样品中主要目标组分的理论塔板数以及样品中目标组分与干扰峰的分离效果评价系统适应性,并确定较优的色谱条件。
1.3.4 方法学验证方法
1.3.4.1 线性关系和灵敏度试验 将混合酚酸对照品工作液按1.3.3优化的色谱条件进行检测,以色谱峰面积为纵坐标(y),质量浓度为横坐标(x)绘制八种酚酸的标准曲线确定线性方程和线性范围,以信噪比(S/N)为3时,确定检出限(LOD),S/N为10时,确定定量下限(LOQ)(陈丹丹等,2019),重复6次。
1.3.4.2 精密度试验 精密吸取40.0 μg·mL-1混合酚酸对照品工作液,处理方法同1.3.4.1,连续进样检测6次,以色谱峰面积计算每个酚酸的变异系数(RSD)值。
1.3.4.3 稳定性试验 移取5.0、20.0、60.0 μg·mL-1混合酚酸对照品工作液,处理方法同1.3.4.1,在1 d内进样检测6次,时间间隔4 h;在6 d内,每日同一时间点进样1次。按照1.3.4.2方法计算每个酚酸日内和日间的RSD值。
1.3.4.4 重复性试验 精密称取1.3.2.1方法制备的大果山楂冻干粉2.000 g,共6份,分别按1.3.2的方法提取酚酸并进行样品预处理,进样检测,按照1.3.4.2方法计算每个酚酸的RSD值。
1.3.4.5 加标回收率的测定 精密称取1.3.2.1方法制备的大果山楂冻干粉1.000 g,以原有目标化合物量的150%、100%、50%加入8个酚酸对照品溶液,按照1.3.2的方法提取酚酸并进行样品预处理,进样检测,重复3次,将得到的色谱峰面积代入线性方程,根据样品和加标样品的浓度计算每个酚酸的加标回收率和RSD值。
1.3.4.6 样品色谱图分析 移取1.3.2.2制备的样品进行检测,比较单一对照品的保留时间并结合相应的紫外光谱对样品中目标组分进行定性,根据标准曲线和峰面积计算对应样品中每个酚酸的含量,重复6次。
1.4 数据处理
采用Excel 2019软件进行数据处理,SPSS 23.0软件对数据进行差异性分析(ANOVA),Adobe Photoshop cc 2019软件对图像进行处理。
2 结果与分析
2.1 色谱条件的确定
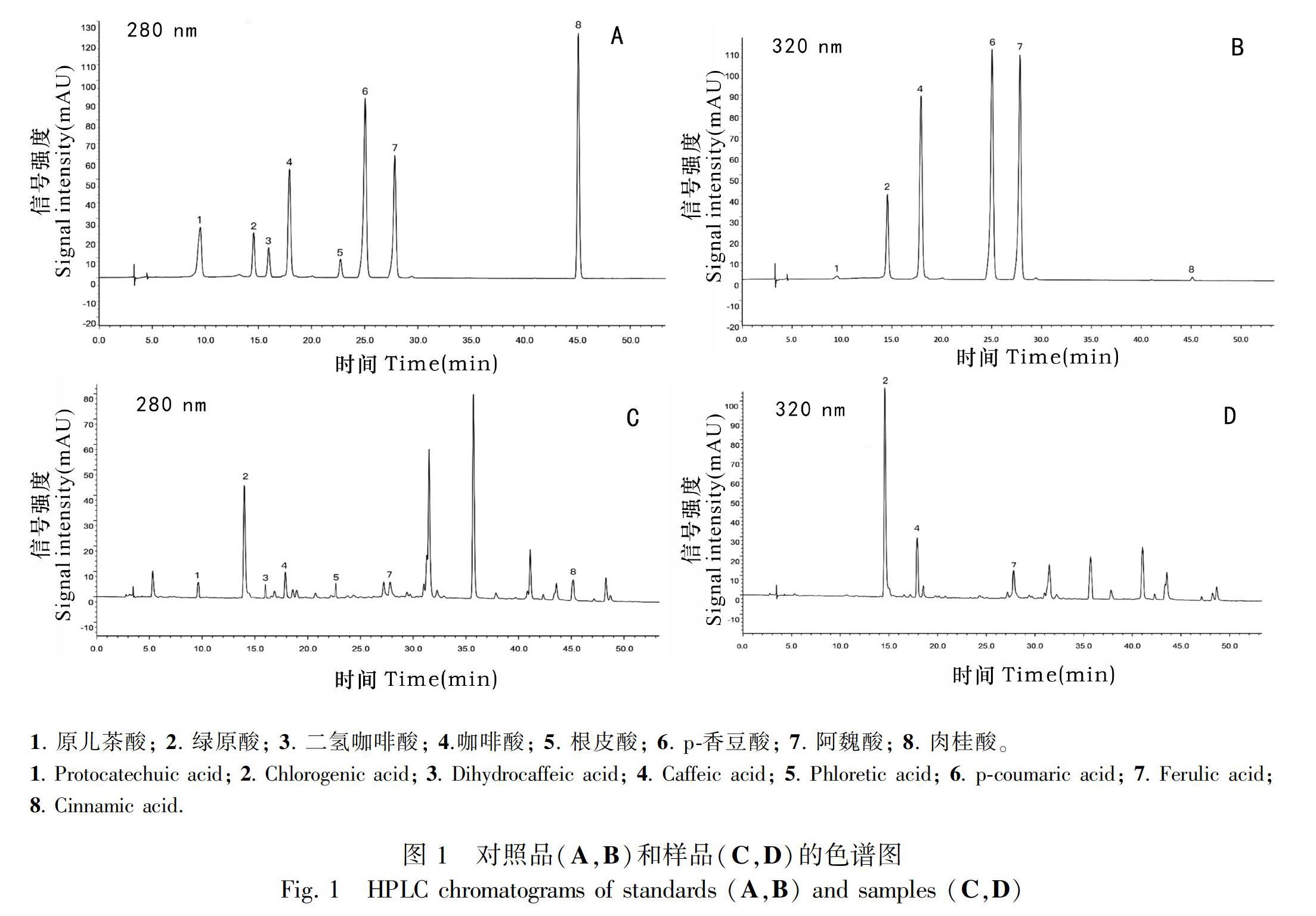
2.1.1 检测波长的选择 酚酸单一对照品紫外扫描的结果表明:原儿茶酸、二氢咖啡酸、根皮酸和肉桂酸在280 nm附近有最大吸收峰;绿原酸、咖啡酸、p-香豆酸和阿魏酸在320 nm附近有最大吸收峰。因此,选择280、320 nm作为检测波长。
2.1.2 色谱条件优化结果及对照品和样品色谱图分析 色谱柱是HPLC检测分析的核心部件,其性能发挥受到分析样品的化学组成和理化性质的影响(李旻昊等,2019)。四种反相色谱柱研究结果表明,ZORBAX SB-C18色谱柱在同一分析条件下目标组分峰形相对较好,因此,选择该色谱柱用于本实验后续进一步的研究。流动相是影响HPLC分离效果的重要因素,甲醇-水溶液或乙腈-水溶液是酚酸类成分分析采用较多的流动相,在水溶液中添加适量浓度的酸对改善样品的分离度和峰形有明显的效果,甲酸或乙酸比较常用(王晓梅等,2016;邓宝安等,2017;李岩等,2018;邓渝等,2018;匡凤元等,2019;屈艳勤等,2019)。比较甲醇、乙腈、甲酸水溶液和乙酸水溶液对目标组分的分离效果,结果表明:以0.1%乙酸水溶液为流动相时,甲醇和乙腈的分离效果均不理想,绿原酸和二氢咖啡酸大部分重叠,而以0.1%甲酸水溶液为流动相时,甲醇和乙腈均能改善绿原酸和二氢咖啡酸的分离效果,两者的分离度分别为1.0和0.8,甲醇稍优于乙腈,但随着绿原酸和二氢咖啡酸的分离,相邻咖啡酸与二氢咖啡酸的分离度只能达到1.2。以甲醇为流动相,进一步研究不同浓度的甲酸水溶液对目标组分分离效果的影响,当甲酸水溶液为1.0%时,八种对照品酚酸之间的分离度可达到1.5,基线平稳且色谱峰峰形较好,因此,选择甲醇-甲酸水溶液作为流动相。
准确地对目标成分进行定性和定量分析,不仅对照品的分离度需要满足要求,也需考虑样品中的目标成分是否与干扰峰实现到有效分离。大果山楂酚酸样品提取过程中不可避免会带入其他黄酮类成分,研究发现,阿魏酸、肉桂酸与大果山楂中的黄酮糖苷出峰时间很容易重合或非常接近,进一步调整流动相组成、柱温和流速等参数,结果显示提高流动相水溶液中的酸浓度和柱温可显著改善样品的酚酸与黄酮糖苷的分离效果。综合考虑色谱柱的使用寿命和样品的分离效果,优化后的色谱条件:ZORBAX SB-C18色谱柱(4.6 mm × 250 mm, 5 μm);流动相为1.5%甲酸水溶液(A)-甲醇(B),梯度洗脱程序(0~25 min,10%~35% B;25~45 min,35%~45% B;45~48 min,45% B);柱温35 ℃;流速1.0 mL·min-1;进样量20 μL。
采用以上优化的色谱条件进行液相分析,混合酚酸对照品及大果山楂果实酚酸提取物样品的色谱图见图1,八种酚酸的保留时间分别为原儿茶酸9.6 min、绿原酸14.6 min、二氢咖啡酸16.0 min、咖啡酸17.9 min、根皮酸22.7 min、p-香豆酸25.0 min、阿魏酸27.8 min、肉桂酸45.1 min,各酚酸之间的色谱峰分离度均大于1.5,理论塔板数以样品中的主成分绿原酸色谱峰计算大于3 000,基线平整,峰形好,表明本检测分析方法可以对大果山楂果实中的八种酚酸类成分进行定性与定量分析。1. 原儿茶酸; 2. 綠原酸; 3. 二氢咖啡酸; 4.咖啡酸; 5. 根皮酸; 6. p-香豆酸; 7. 阿魏酸; 8. 肉桂酸。
2.2 方法学考察结果
2.2.1 线性关系、检出限及定量下限 从表2中可以看出,八种酚酸对照品在线性范围内均呈现良好的线性关系,相关系数0.997 7~0.999 5,检出限 0.08~0.20 μg·mL-1,定量下限0.27~0.67 μg·mL-1,表明本方法检测灵敏度较高,能够实现样品中低浓度酚酸的定量分析。
2.2.2 精密度测定 同一样品连续进样得到的峰面积越接近,说明仪器的精密度越好,试验结果越精准。本方法的精密度试验显示酚酸对照品的RSD值分别为原儿茶酸1.07%、绿原酸1.11%、二氢咖啡酸2.59%、咖啡酸2.14%、根皮酸0.85%、p-香豆酸2.60%、阿魏酸2.11%、肉桂酸1.46%,最大的变异系数为2.59%,表明精密度良好,符合测定要求。
2.2.3 稳定性测定 样品在放置的时间段内,测得的峰面积变化越小,说明样品越稳定,试验结果则越准确。本方法不同浓度对照品的日内和日间稳定性测定结果如表3所示,各种酚酸在日内的变异系数均小于4.62%, 日间的变异系数均小于4.99%,表明对照品日间和日内的稳定性良好,符合稳定性要求。
2.2.4 重复性测定 同样的大果山楂样品进行酚酸提取和预处理,测得的峰面积越接近,表明试验在操作过程中出现的误差越小,试验结果则越准确。本研究方法的重复性试验显示样品中各个酚酸的RSD值分别为原儿茶酸3.16%、绿原酸1.19%、二氢咖啡酸3.37%、咖啡酸1.48%、根皮酸3.08%、p-香豆酸1.71%、阿魏酸1.96%、肉桂酸2.09%,最大的变异系数为3.37%,表明该方法的重复性较好,符合实验要求。
2.2.5 加标回收率的测定 本方法大果山楂果实样品加标回收率结果如表4所示,八种酚酸的平均加标回收率在99.3%~103.3%之间,RSD值均小于3.45%,表明该方法准确度良好,可以用于对大果山楂果实酚酸含量的检测。
2.3 不同产地大果山楂果实酚酸含量的比较分析
10个不同产地大果山楂果实中测定的八种酚酸含量见表5,样品中均检出原儿茶酸、绿原酸、二氢咖啡酸、咖啡酸、根皮酸、阿魏酸和肉桂酸七种酚酸,其中二氢咖啡酸、根皮酸、阿魏酸在大果山楂果实中首次检出(赵帅等,2020),p-香豆酸虽存在于大果山楂叶中(Zhao et al., 2015),但本研究的所有样本中均未检出,表明果实中可能不存在这种酚酸或含量极其微量,不在检测范围内。进一步的单因素方差分析可知,不同产地果实的酚酸总含量以及各酚酸之间的含量均存在明显差异,七种酚酸总含量在10 187.8~15 583.9 μg·g-1之间,绿原酸均为最主要的酚酸类成分(8 410.2~13 826.7 μg·g-1),占总酚酸80%以上,广西百色靖西和桂林恭城产的果实,其总酚酸和绿原酸含量相对较高,分别大于15 000、13 500 μg·g-1;其余六种酚酸含量都远低于绿原酸,分别为咖啡酸471.6~850.5 μg·g-1、原儿茶酸184.3~487.8 μg·g-1、二氢咖啡酸102.6~391.5 μg·g-1、肉桂酸81.2~520.1 μg·g-1、阿魏酸57.8~423.4 μg·g-1、根皮酸24.2~230.8 μg·g-1,根皮酸为含量相对较少的酚酸成分,整体水平最低。以上结果表明,大果山楂果实中酚酸类成分种类和含量丰富,这为今后对大果山楂果实的开发利用提供了方向和依据。
3 讨论与结论
本文建立了HPLC法测定大果山楂果实中原儿茶酸、绿原酸、咖啡酸、肉桂酸、p-香豆酸、阿魏酸、二氢咖啡酸和根皮酸的方法,该方法不仅可以实现同时检测这八种酚酸,而且与以往三种酚酸的检测方法相比(Wen et al., 2016),酚酸之间分离度好,酚酸与干扰峰之间得到有效分离, 基线平整,准确度、灵敏度和精密度高,重复性和稳定性好,符合检测分析的要求,因此定性和定量更为准确。色谱条件为ZORBAX SB-C18色谱柱(4.6 mm × 150 mm,5 μm),以甲醇/1.5%甲酸水溶液(v/v)为流动相,梯度洗脱,柱温35 ℃,流速1.0 mL·min-1,检测波长280、320 nm,进样量20 μL。
大果山楂果实中酚酸组成和含量丰富,共检出原儿茶酸、绿原酸、二氢咖啡酸、咖啡酸、根皮酸、阿魏酸和肉桂酸七种酚酸,二氢咖啡酸、根皮酸、阿魏酸在大果山楂果实中首次检出;果实中总酚酸及酚酸之间的含量差异明显,七种酚酸总的质量分数在10 187.8~15 583.9 μg·g-1之间,以绿原酸为主(8 410.2~13 826.7 μg·g-1),占总酚酸的80%以上,广西百色靖西和桂林恭城的果实总酚酸和绿原酸质量分数均相对较高,分别大于15 000、13 500 μg·g-1,绿原酸含量为同属植物苹果的3~180倍(Feliciano et al., 2010; 李鑫,2015;韩明虎等,2018),在后续的品种选育、原料选择和加工利用方面值得关注。
酚酸类化合物是高等植物中普遍存在的一类次生代谢产物,也是合成木质素的中间产物(陈志杰等,2018;高媛等,2018),果实中的酚酸组成和含量除了与品种、产地有关外,也与果实采摘时的成熟度和贮藏条件等密切相关(Seraglio et al., 2018; 匡凤元等,2019),进一步研究不同时期酚酸类成分的变化规律更有利于准确评估不同产地大果山楂果实中的酚酸类组成和含量。本研究结果能为以上这些后续研究提供检测方法和研究方向。
参考文献:
CHOI K, SON Y, HWANG J, et al., 2017. Antioxidant, anti-inflammatory and anti-septic potential of phenolic acids and flavonoid fractions isolated from Lolium multiflorum [J]. Pharm Biol, 55(1): 611-619.
CHEN DD, GUO XF, ZHAO L, et al., 2019. Stimultaneous determination of four flavone C-glycosides in bamboo leaves of Phyllostachys by HPLC [J]. Chem Ind For Prod, 39(5): 108-114. [陈丹丹, 郭雪峰, 赵蕾, 等, 2019. HPLC法同时检测刚竹属竹叶中4种黄酮碳苷的含量 [J]. 林产化学与工业, 39(5): 108-114.]
CHEN ZJ, WU JQ, MA Y, et al., 2018. Biosynthesis, metabolic regulation and bioactivity of phenolic acids in plant food materials [J]. Food Sci, 39(7): 321-328. [陈志杰, 吴嘉琪, 马燕, 等, 2018. 植物食品原料中酚酸的生物合成與调控及其生物活性研究进展 [J]. 食品科学, 39(7): 321-328.]
DENG BA, WANG KJ, WANG F, et al., 2017. Determination of nine phenolic acids in different Atractylodes macrocephala koidz extracts using HPLC [J]. Food Ind, 38(8): 277-280. [邓宝安, 王科杰, 王芳, 等, 2017. 采用HPLC法同时检测白术中酚酸类物质 [J]. 食品工业, 38(8): 277-280.]
DENG JG, WEI SJ, 2007. Authentic medicines of Guangxi [M]. Beijing: China Traditional Chinese Medicine Press: 24-31. [邓家刚, 韦松基, 2007. 广西道地药材 [M]. 北京: 中国中医药出版社: 24-31.]
DENG Y, CHEN YS, WANG X, et al., 2018. HPLC simultaneous determination of four phenolic acids in Herba Glechomae [J]. Chin J Pharm Anal, 38(4): 643-647. [邓渝, 陈友生, 王茜, 等, 2018. HPLC法同时测定连钱草中4个酚酸类成分的含量 [J]. 药物分析杂志, 38(4): 643-647.]
Food and Drug Administrationof Guangxi Autonomous Region, 2011. Quality standard of Zhuang medicine of Guangxi Autonomous Region [M]. Vol. 2(2011 ed). Nanning: Guangxi Science & Technology Press: 26-27. [广西壮族自治区食品药品监督管理局, 2011. 广西壮族自治区壮药质量标准 [M]. 第二卷(2011版). 南宁: 广西科学技术出版社: 26-27.]
FELICIANO RP, ANTUNES C, ROMOS A, et al., 2010. Characterization of tradition andexotic apple varieties from Portugal. Part 1-Nutritional, phytochemical and sensory evaluation [J]. J Funct Food, 2(1): 35-45.
GAO Y, MA S, DAI M, et al., 2018. Progress in research on the biosynthesis pathway and metabolic regulation of phenolic acids [J]. Food Sci, 39(9): 286-293. [高媛, 马帅, 代敏, 等, 2018. 果蔬酚酸生物合成及代谢调控研究进展 [J]. 食品科学, 39(9): 286-293.]
GUO T, BAI XL, CHEN YN, 2019. Effect of drying treatment methods on the drying rate and quality characteristics of big fruit hawthorn [J]. Food Mach, 35: 122-125. [郭婷, 白向丽, 陈益能, 等, 2019. 干燥方式对大果山楂粉干燥速率及品质的影响 [J]. 食品与机械, 35: 122-125]
HAN MH, WANG CL, HU HB, et al., 2018. Analysis of compostion and content of polyphenols in Qingyang Red Fuji Apple [J]. Sci Technol Food Ind, 39(20): 244-248. [韩明虎,王春林,胡浩斌,等,2018. 庆阳红富士苹果中多酚类成分组成及含量分析 [J]. 食品工业科技,39(20): 244-248.]
HUANG XX, 2015. Study on the anti-oxidant activity andhypolipemic effect of Malus doumeri (Bois) Chev. flavonoid extract [D]. Nanning: Guangxi University. [黄欣欣, 2015. 大果山楂黄酮类物质的提取及其抗氧化性和降血脂功能研究 [D]. 南宁: 广西大学.]
HUANG XX, YE ZQ, GUO BB, et al., 2015. Reflux extraction process optimization of total flavonoids from Malus doumeri (Bois) Chev. fruits by response surface methodology [J]. J S Agric, 46(6): 1089-1095. [黄欣欣, 叶志青, 郭兵兵, 等, 2015. 响应面法优化回流提取大果山楂总黄酮工艺 [J]. 南方农业学报, 46(6): 1089-1095.]
KUANG FY, WU GB, ZHANG K, et al., 2019. Simultaneous determination of 5 phenolic acids of phenylpropanoid pathway in postharvest wax apple [Syzygium samarangenese (Blume) Merrill & L.M. Perry] fruit by high performance liquid chromatography [J]. Food Sci, 40(8): 165-170. [匡鳳元, 吴光斌, 张珅, 等, 2019. HPLC法同时测定采后莲雾果实木质素代谢途径中5种酚酸的含量 [J]. 食品科学, 40(8): 165-170.]
LI MH, WANG ZM, YANG J, et al., 2019. Advances in monolithic columns technology in HPLC [J]. Chem Bull, 82(1): 18-26. [李旻昊, 王泽溟, 杨杰, 等, 2019. 高效液相色谱整体柱技术研究进展 [J]. 化学通报, 82(1): 18-26.]
LI X, 2015. Polyphenolic compounds determination and bioactivity evaluation of different apple (Malus pumila Mill.) cultivars\[D\]. Hangzhou: Zhejiang University. [李鑫,2015. 不同品种苹果多酚组分分析及其相关生物活性研究 [D]. 杭州: 浙江大学.]
LI Y, CHEN DQ, YE ZB, 2018. Determination of the composition and content of phenolic acids in Dendrobium officinale by HPLC [J]. Food Res Dev, 39(7): 174-179. [李岩, 陈德泉, 叶泽波, 2018. HPLC法测定铁皮石斛中酚酸类物质组成及含量 [J]. 食品研究与开发, 39(7): 174-179.]
LUO CY, WANG XX, GAO G, et al., 2013. Identification and quantification of free, conjugate and total phenolic compounds in leaves of 20 sweetpotato cultivars by HPLC-DAD and HPLC-ESI-MS/MS [J]. Food Chem, 141(3): 2697-2706.
QU YQ, MARAT T, ZHENG DY, et al., 2019. HPLC determination of phenolic acids in tea [J]. Acta Tea Sin, 60(2): 69-74. [屈艳勤, MARAT T, 郑德勇, 等, 2019. 高效液相色谱法测定茶叶酚酸化合物的含量 [J]. 茶叶学报, 60(2): 69-74.]
SERAGLIO SKT, SCHULZ M, NEHRING P, et al., 2018. Nutritional and bioactive potential of Myrtaceae fruits during ripening [J]. Food Chem, 239: 649-656.
WANG LH, YANG JX, ZHENG YH, et al., 2012. Modeling of geographic distribution of Malus doumeri [J]. J NE For Univ, 40(9): 15-18. [王雷宏, 杨俊仙, 郑玉红, 等, 2012. 台湾林檎[Malus doumeri (Bois) Chev.]地理分布模拟 [J]. 东北林业大学学报, 40(9): 15-18.]
WANG XM, YU Y, WANG XL, et al., 2016. Simultaneous determination of 5 salvianolic acid constituents in the roots and rhizomes of Salvia deserta Schang by HPLC [J]. Chin J Pharm Anal, 36(5): 805-810. [王晓梅, 余妍, 王新玲, 等, 2016. HPLC法同时测定新疆鼠尾草中5个酚酸类成分的含量 [J]. 药物分析杂志, 36(5): 805-810.]
WEN LR, 2016. Study on the bioactive chemical constituents and their antioxidantive and anti-proliferative activities of Crataegus pinnatifida and Malus doumeri fruits [D]. Guangzhou: South China University of Technology. [温玲蓉, 2016. 北山楂和大果山楂的活性成分及其抗氧化与抗增殖活性研究 [D]. 广州: 华南理工大学.]
WEN LR, ZHENG GQ, YOU LJ,et al., 2016. Phytochemical profiles and cellular antioxidant activity of Malus doumeri (Bois) chevalier on 2, 2′-azobis (2-amidinopropane ) dihydrochloride ( ABAP)-induced oxidative stress [J]. J Funct Foods, 25: 242-256.
ZHANG Q, CHEN CX, CHEN ZL, et al., 2018. Research of compositions and antioxidant activity during natural fermentation of Malus domeri (Bois) Chev. enzyme drink [J]. Food Res Dev, 39(22): 15-19. [张巧, 陈春喜, 陈振林, 等, 2018. 大果山楂酵素发酵过程中组分及抗氧化性研究 [J]. 食品研究与开发, 39(22): 15-19.]
ZHAO S, HAO EW, DU ZC, et al., 2020. Advance in studies on chemical constituents, pharmacology and quality control of Malus doumeri [J]. Chin Trad Patent Med, 42(1): 169-175. [赵帅, 郝二伟, 杜正彩, 等, 2020. 广山楂的化学成分、药理作用与质量控制研究进展 [J]. 中成药, 42(1): 169-175.]
ZHAO HD, HU X, CHEN XQ, et al., 2015. Analysis and improved characterization of minor antioxidants from leaves of Malus doumeri using a combination of major constituents knockout with high-performance liquid chromatography-diode array detector-quadrupole time-of-flight tandem mass spectrometry [J]. J Chromatogr A, 1398: 57-65.
ZHU K, HUANG GB, XIE J, et al., 2019. Preventive effect of flavonoids from Wushan Shencha (Malus doumeri leaves) on CCI4-induced liver injury [J]. Food Sci Nutr, 7(11): 3808-3818.
ZENG YH, TANG CM, ZHOU YT, et al., 2014. Study of characteristics and utilization value of Malus doumeri in Guangxi [J]. For Invest Des, 170(2): 85-88. [曾勇豪, 唐初明, 周云濤, 等, 2014. 广西风味小野果涩梨的特点及开发利用价值研究 [J]. 林业勘查设计, 170(2): 85-88.]
(责任编辑 李 莉)
